七叶莲花醇提物减轻丁哌卡因大鼠中枢神经毒性反应及心脏毒性的机制
2022-05-11祝劲松陈荣韩徐唐松江
祝劲松 陈荣 韩徐 唐松江
(贵阳中医药大学第一附属医院麻醉科,贵州 贵阳 550002)
局部麻醉(局麻)是临床上通常采用的麻醉方法,其特点是术后恢复平稳、保持清醒及经济实惠等,但近年来,局麻药的中枢神经毒性反应和心脏毒性受到越来越多的关注〔1〕。丁哌卡因作为一种长效的局麻药,若其使用过量或误入血管可产生严重的中枢神经毒性反应和心脏毒性,严重威胁患者的生命健康〔2~4〕。临床麻醉中预先给予咪达唑仑、丙泊酚等麻醉药预防及治疗丁哌卡因引起的心脏毒性及中枢神经毒性反应,取得了一定的效果,但同时也出现了呼吸抑制、循环抑制等并发症〔5〕。研究发现多种中药对丁哌卡因造成的中枢毒性反应及心脏毒性有一定的预防作用〔6〕。《中华本草苗药卷》记载七叶莲有抗惊厥、增强心肌收缩力、行气止痛、活血消肿、壮筋骨等多种作用〔7~10〕。研究表明七叶莲含有萜烯类、有机酸、皂苷类等化合物,对中枢神经系统有镇静、镇痛及抗惊厥作用,除此之外,腹腔注射七叶莲注射液能够增加心肌收缩力〔11〕。同时,七叶莲花作为七叶莲新的药用部位,研究表明其醇提物具有抗炎、镇痛活性〔9,12,13〕。但是,七叶莲花醇提物对局麻药丁哌卡因诱发中枢神经毒性反应和心脏毒性的作用研究较少,本研究探讨七叶莲花醇提物对丁哌卡因引起中枢神经毒性反应及心脏毒性的影响及可能的机制。
1 材料与方法
1.1实验动物与药物 取七叶莲花以60%乙醇溶液渗漉提取,减压浓缩成浸膏,由南京欧际医药科技服务有限公司提取制备,实验时给大鼠灌胃给药。盐酸丁哌卡因(阿拉丁公司),用微量注射泵经股静脉泵注给药。75只健康雄性成年SD大鼠(贵阳中医学院实验动物研究所提供)。体重200~350 g,随机分为5组,对照组(D组)、3种不同剂量七叶莲花醇提物组(S1组、S2组、S3组)及阳性药组(P组)。每组15只。
1.2实验试剂与仪器 一氧化氮(NO)和一氧化氮合酶(NOS)测定试剂盒、蛋白裂解液、磷酸酶抑制剂、蛋白酶抑制剂、总RNA裂解液Trizol(碧云天);anti-NMDA1 antibody、anti-NMDA2B antibody、β-actin抗体(CST);辣根过氧化物酶(HRP)标记山羊抗兔IG、HRP标记山羊抗鼠IG(Abcam)。生理参数记录使用仪(COLINBP-508,日本考林公司);NanoDrop 2000 Spectrophotometer、荧光定量-聚合酶链反应(PCR)仪(ABI Stepone plus型)、酶标仪(赛默飞);Bio-Rad GelDoc EZ凝胶成像系统(Bio-Rad)。
1.3实验方法 所有动物实验经过动物伦理委员会的同意和批准,给药剂量参考之前的文献〔13〕S1组(七叶莲3.06 g/kg)、S2组(七叶莲6.12 g/kg)、S3(七叶莲12.24 g/kg),P组(丙泊酚100 mg/kg)。造模前灌胃给予七叶莲花醇提物,1次/d,连续3 d,D组大鼠灌胃给予等体积生理盐水。
1.4动物模型制作 实验前,大鼠禁食12 h,腹腔注射10%水合氯醛麻醉,并维持大鼠持续纯氧吸氧状态,固定于操作实验台,将三根针式电极针分别插入大鼠双上肢及右下肢皮下,监测12导联心电图(ECG)。暴露股动脉,放入24G套管针用于监测平均动脉压(MAP)和抽取血样,进行血气分析。按2 mg/(kg·min)速度经股静脉匀速持续泵注丁哌卡因,同时监测大鼠MAP、心率和ECG,观察记录大鼠出现抽搐、心律失常(以QRS波延长为标准)、循环塌陷(以MAP降至40 mmHg为标准)和心搏骤停时间。在泵药前、出现抽搐及循环塌陷时抽取血样,进行血清生化检测,分别计算大鼠出现抽搐、心律失常、循环塌陷和心搏骤停时丁哌卡因的累积剂量。
1.5海马神经元凋亡TUNEL染色检测 大鼠海马组织冰冻切片,4%多聚甲醛固定30 min,用0.1 mmol/L磷酸盐缓冲液(PBS)中的0.1%Triton X-100透化10 min,置于TUNEL反应物中避光37℃孵育60 min,PBS洗涤3次,随后使用4′,6-二脒基-2-苯基吲哚(DAPI)复染细胞核15min,封片,用免疫荧光显微镜观察并拍照,使用ImageJ软件进行图像处理和量化。海马组织N-甲基-D-天冬氨酸(NMDA)1、NMDA2B mRNA检测采用Primer Express 2.0软件设计引物,NMDA1:正义链:5′-GATAGAAAGAGTGGTAGAGC-3′,反义链:5′-CCAGGGTGGAGGTGATAGCC-3′;NMDA2B:正义链:5′-ACCAATAAGCCAGTGGTGGTC-3′,反义链:5′-CACAGGGGTTGGACTGGTTC-3′;β-actin:正义链:5′-TGCTATGTTGCCCTAGACTTCG-3′,反义链:5′-GTTGGCATAGAGGTCTTTACGG-3′。分离和收集实验大鼠海马组织,称取约30 mg,加入1 ml Trizol,组织研磨仪匀浆,提取组织总RNA,用NanoDrop 2000 Spectrophotometer检测RNA的浓度和纯度,用逆转录试剂盒和DNA清除试剂将RNA(1 μg)逆转录为cDNA,使用配有荧光定量PCR试剂的荧光定量PCR系统进行qRT-PCR定量分析,扩增条件:95℃预变性5 min;95℃变性15 s,60℃延伸30 s,重复40个循环,最后根据2-ΔΔCt法计算NMDA1、NMDA2B相对于甘油醛-3-磷酸脱氢酶(GAPDH)mRNA的表达水平。
1.6海马组织NMDA1、NMDA2B蛋白检测 分离收集实验大鼠海马组织,称取约30 mg,加入0.5 ml蛋白裂解液,研磨仪组织匀浆,Western印迹检测海马组织NMDA1和NMDA2A蛋白表达。根据制造商说明操作提取组织总蛋白,采用二喹啉甲酸(BCA)法进行蛋白定量,加入结合缓冲液于100 ℃煮沸5 min,然后采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,电泳条件:80 V,30 min;120 V,60 min。随后采用100 V,90 min将电泳分离后的蛋白转移至聚偏氟乙烯(PVDF)膜,用5%牛血清白蛋白(BSA)室温封闭60 min,TBST洗涤5次,5 min/次,用一抗(NMDA1、NMDA2B及GAPDH,按1∶1 000稀释)4℃孵育过夜,TBST洗涤5次,5 min/次,用二抗(HRP标记山羊抗兔IG和HRP标记山羊抗鼠IG,按1∶10 000稀释)室温孵育90 min,TBST洗涤5次,5 min/次,用电化学发光(ECL)法显影检测,ImageJ分析灰度值。
1.7统计学方法 采用GraphPad Prism8.0软件进行方差分析、t检验。
2 结 果
2.1七叶莲花醇提物对丁哌卡因大鼠中枢神经毒性反应和心脏毒性的影响 泵注丁哌卡因后,与D组相比,S2组、S3组、P组出现抽搐、心律失常、循环衰竭、心搏骤停时,泵注丁哌卡因的累积剂量显著升高;S1组出现心律失常、循环衰竭时,泵注丁哌卡因的累积剂量显著升高(均P<0.05),见表1。

表1 大鼠泵注0.5%丁哌卡因出现中枢神经毒性反应和心脏毒性的用量比较
2.2七叶莲花醇提物对丁哌卡因大鼠MAP的影响 泵注丁哌卡因之前,5组MAP水平均无显著差异(P>0.05);与泵注前相比,出现抽搐和心律失常时,5组MAP水平均显著升高(均P<0.05),且出现抽搐时,S1组、S2组、S3组及P组MAP水平均显著低于D组;发生心律失常时,仅S3组和P组MAP水平均显著低于D组(P<0.05)。见表2。
2.3七叶莲花醇提物对丁哌卡因大鼠NO和NOS水平的影响 在泵注丁哌卡因之前,5组NO和NOS水平差异均无统计学意义(P>0.05),出现抽搐时5组NO水平均显著高于泵注前(P<0.05),循环衰竭时恢复至泵注前水平,且出现抽摔时,S1组、S2组、S3组、P组NO水平显著高于D组(P<0.05);在抽搐和循环衰竭时,S1组、S2组、S3组、P组NOS水平均显著高于D组(P<0.05),见表3。

表2 大鼠泵注0.5%丁哌卡因不同时间点MAP水平比较

表3 大鼠泵注0.5%丁哌卡因不同时间点NO含量和NOS水平变化
2.4七叶莲花醇提物对丁哌卡因大鼠海马NMDA受体mRNA表达的影响 与D组相比,S2组、S3组、P组NMDA1和NMDA2B mRNA表达水平显著下调(均P<0.05),见表4。
2.5七叶莲花醇提物对丁哌卡因大鼠海马神经元凋亡的影响 D组海马神经元出现了与凋亡相关的形态变化,如核浓缩、核收缩及凋亡小体形成等,见图1。D组海马神经元凋亡率〔(69.05±2.90)%〕显著高于S1组、S2组、S3组、P组〔(44.48±2.66)%、(40.04±5.08)%、(22.93±2.29)%、(32.12±4.42)%,均P<0.05〕。

表4 大鼠泵注0.5%丁哌卡因海马NMDA受体mRNA水平比较
2.6七叶莲花醇提物对丁哌卡因大鼠海马NMDA受体蛋白表达的影响 与D组相比,S2组、S3组、P组海马组织中NMDA1和NMDA2B蛋白表达水平显著下调(均P<0.05),见图2、表5。

图1 七叶莲花醇提物对丁哌卡因大鼠海马神经元(TUNEL染色,×40)
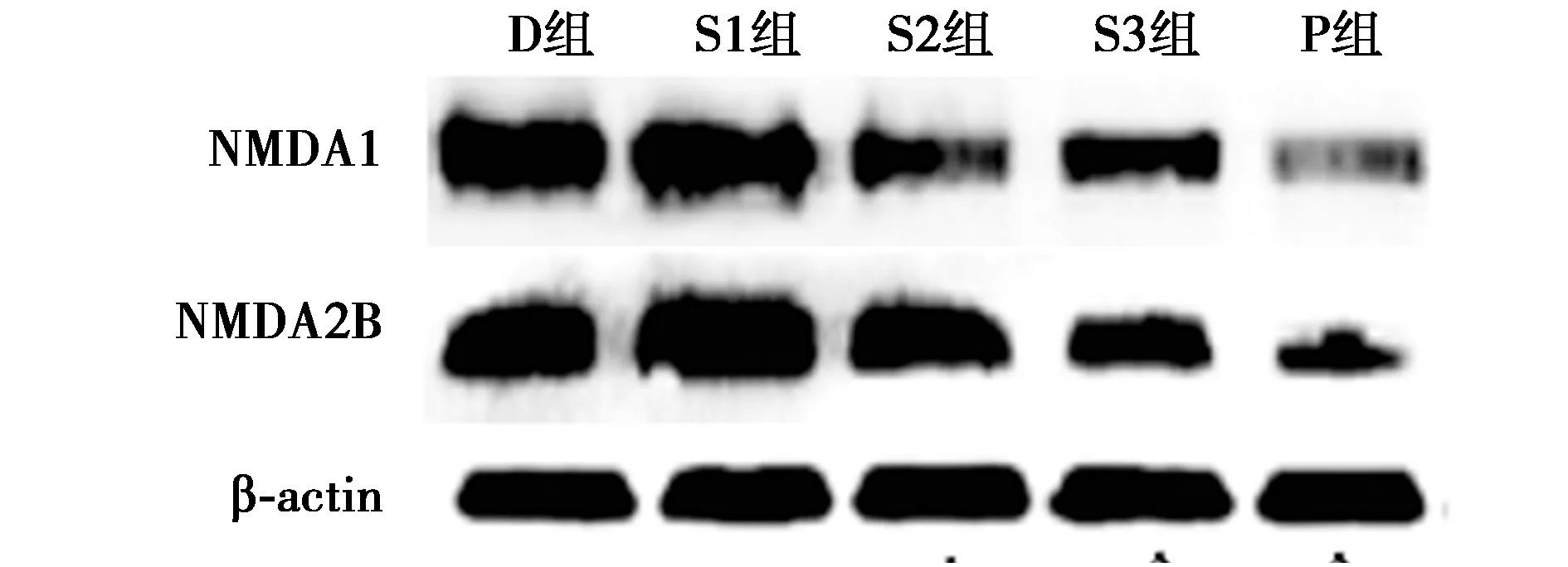
图2 七叶莲花醇提物对丁哌卡因大鼠海马中NMDA受体蛋白表达的影响

表5 大鼠泵注0.5%丁哌卡因海马NMDA受体蛋白表达变化
3 讨 论
本研究表明在泵注丁哌卡因之前,灌胃给予SD大鼠七叶莲花醇提物能够显著增加丁哌卡因大鼠出现抽搐、心律失常、循环衰竭及心搏骤停的丁哌卡因累积剂量,提高中毒耐受剂量;七叶莲醇提物能够显著降低丁哌卡因引起的海马神经元凋亡;能够减轻丁哌卡因引起的中枢神经毒性反应和心脏毒性。
丁哌卡因能够通过影响能量代谢、钠离子、钾离子通道的快结合和慢解离引起传导延迟,进而引起窦性心动过缓、心搏骤停及房室传导阻滞等〔14~16〕。除此之外,丁哌卡因能够通过影响中枢神经系统平衡、NMDA-Ca2+-NO通路产生中枢神经毒性〔17,18〕。NO作为体内一种重要气体信号分子,其在保护心脏和减轻心脏毒性方面具有重要的作用,如临床通过提供外源性NO保护缺血受损的心肌细胞〔19〕。本研究表明七叶莲花醇提物预处理能够在毒性反应开始期和反应末期,机体进入循环塌陷时显著提高机体的NO和NOS水平,从而提高局麻药心脏毒性末期的抢救成功率。
NMDA受体是中枢神经系统中主要的兴奋性神经递质谷氨酸敏感的阳离子通道受体,属于配体门控型离子通道的超家族,NMDA受体受电压和配体双重门控、对Ca2+有较强通透性,该受体活性的维持是神经元存活和发育的重要因素〔20〕。NMDA受体广泛分布于大脑皮层、海马、丘脑、纹状体、小脑及脑干等中枢神经系统,以海马组织最为密集。在已发现NMDA受体的7个亚单位,即NRl亚单位(NMDA1)、4种NR2亚单位(NR2A、NR2B、NR2C和NR2D)以及2种NR3亚单位(包括NR3A和NR3B),研究表明NR1缺失能够引起大鼠的前脑、尾状核、壳核、海马和丘脑区代谢活动降低〔21〕。NR2亚单位是修饰蛋白,不能单独形成功能性受体,具有功能性的NMDA受体必须是NRl亚基与一种NR2或NR3亚基形成的复合物〔22〕。临床上,丁哌卡因能够引起严重的兴奋性神经毒性,NMDA受体是介导兴奋性神经毒性的主要受体〔23〕,本研究结果表明在泵注丁哌卡因之前,用七叶莲花醇提物预处理能够显著下调大鼠海马组织NMDA1和NMDA2B表达。因此,预先给予七叶莲花醇提物能够下调丁哌卡因大鼠海马组织中NMDA受体的表达和活化。
综上,七叶莲花醇提物减轻丁哌卡因静脉注射产生的心脏毒性与中枢神经毒性反应可能与下调NMDA受体表达及提高NOS活性相关,但是中药成分复杂,作用靶点广泛,所以不能够确定七叶莲花醇提物减轻丁哌卡因大鼠中枢神经毒性反应和心脏毒性的主要活性成分,也不能够排除其他作用机制。因此,后续研究仍需进一步探索有效成分及相关机制。
