超重、肥胖、2型糖尿病患者血清Gal-3水平及利拉鲁肽的干预作用
2022-05-11何婷刘云涛江攀潘敬芳
何婷 刘云涛 江攀 潘敬芳
(三峡大学附属仁和医院内分泌科, 湖北 宜昌 443000)
半乳糖凝集素(Gal)-3是半乳糖结合凝集素家族中的一员,既往研究〔1,2〕发现,Gal-3 参与了胰岛素抵抗(IR)、炎症、糖脂代谢异常的发生。Gal-3具有多种生物活性,除了与糖脂代谢异常有关外,还与细胞的凋亡有关〔3〕。前期研究〔4〕发现Gal-3 在糖尿病及其大血管病变中发挥了重要作用。而胰高血糖素样肽(GLP)-1类似物利拉鲁肽作为新型降糖药物在改善IR、糖脂代谢中发挥重要作用〔5〕,并且能促进β细胞增殖和减少凋亡,改善胰岛功能〔6〕。但是其确切机制尚未完全阐明。本研究通过观察超重、肥胖、2型糖尿病(T2DM)患者血清Gal-3水平及利拉鲁肽的影响作用,旨在研究Gal-3在肥胖、糖脂代谢异常中的作用,并探讨利拉鲁肽新的作用机制。
1 对象与方法
1.1研究对象 选择2018年4月至2020年8月于三峡大学附属仁和医院内分泌科门诊及住院的T2DM患者111例。符合1999年世界卫生组织(WHO)对T2DM诊断分型标准。超重、肥胖的纳入标准为体重指数(BMI)≥24 kg/m2。排除标准:有甲状腺髓样癌既往史、胰腺炎病史患者;1型糖尿病(T1DM)及其他特殊类型糖尿病患者;合并糖尿病急性并发症及严重慢性并发症者;严重心脑血管疾病及肝肾功能异常病患者;对治疗药物过敏、存在药物治疗禁忌证或出现严重胃肠道反应患者;合并影响糖脂代谢的其他内分泌疾病患者;孕妇或哺乳期妇女;无法自行完成注射及依从性较差患者。其中体重正常的T2DM患者57例(T2DM 组),平均年龄(50.44±8.88)岁;合并超重、肥胖的T2DM患者54例(T2DM+OWB 组),平均年龄(50.48±7.97)岁;正常健康体检者56例为对照(NC)组,口服葡萄糖耐量试验(OGTT)排除T2DM,平均年龄(50.04±6.96)岁;体检中心体检者选取糖耐量正常合并超重、肥胖者55例(OWB组),平均年龄(48.95±6.84)岁。研究对象均签署知情同意书。本研究经伦理委员会批准。
1.2研究方法 临床指标测定:测量体重、身高、血压、腰围(WC)。计算BMI 、稳态模型胰岛素抵抗指数(HOMA-IR)、胰岛分泌指数(HOMA-β)。
相关生化指标测定:受试者禁食、水8 h后于次日晨抽取空腹肘静脉血检测空腹血糖(FPG)、餐后2 h血糖(2 h PG)、空腹胰岛素(FIns)、血脂、糖化血红蛋白(HbA1c)。FPG、2 h PG、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)采用美国雅培ARCHITECT C800全自动生化分析仪检测。HbA1c采用ARKRAY HA-8160型全自动HbA1c分析仪检测。FIns采用罗氏Cobase411电化学发光法全自动分析仪检测。超氧化物歧化酶(SOD)测试盒由南京建成生物研究所提供,采用羟胺法测定。HOMA-IR=FPG×FIns/22.5。HOMA-β=(20×FIns)/(FPG-3.5)。白细胞介素 (IL)-6使用weiBioTek Cere酶标仪酶联免疫吸附试验 (ELISA) 检测。Gal-3采用ELISA检测,采用武汉中美科技公司(USCN Science Co,Ltd)试剂盒,批内精密度(CV)及批间CV<10%。药物干预:将T2DM患者随机分为基础治疗组〔Con组,年龄(50.55±8.27)岁)、利拉鲁肽治疗组〔L组,年龄(50.36±8.63)岁〕。Con组给予口服二甲双胍(0.5 g,3次/d)联合磺脲类药物控制血糖。L组在口服二甲双胍(0.5 g,3次/d)或联合磺脲类药物控制血糖的基础上加利拉鲁肽(丹麦诺和诺德公司,规格3 ml/1.8 mg)治疗,起始剂量 0.6 mg,1次/d,皮下注射,1 w后无不适反应加量至1.2 mg,两组均维持治疗12 w。将空腹血糖控制在4.4~7.0 mmol/L,餐后血糖控制在4.4~10.0 mmol/L。
1.3统计学方法 采用SPSS22.0软件进行t检验、单因素方差分析、Pearson相关分析、多元线性回归分析。
2 结 果
2.1各组生化指标的比较 与NC组比较,OWB组、T2DM+OWB组、T2DM组血清IL-6、HOMA-IR、FIns、TG、Gal-3水平显著上升,SOD水平显著下降(P<0.05,P<0.01);与NC组比较,T2DM+OWB组、T2DM组FPG、2 h PG、HbA1c、LDL-C水平显著上升,HOMA-β、血清HDL-C水平显著下降(P<0.01);与NC组比较,OWB组、T2DM+OWB组WC、BMI水平上升(P<0.01);与OWB组比较,T2DM+OWB组、T2DM组血清FPG、2 h PG、HbA1c、IL-6、HOMA-IR、LDL-C、Gal-3水平显著升高,HOMA-β、HDL-C水平显著下降(P<0.05,P<0.01);与OWB组比较,T2DM+OWB组血清FIns、TG水平上升,SOD水平显著下降(P<0.01);与OWB组比较,T2DM组BMI、WC、血清FIns水平显著下降(P<0.05,P<0.01);与T2DM组比较,T2DM+OWB组BMI、TG、IL-6、FIns、HOMA-IR、Gal-3、WC水平显著升高,HOMA-β、SOD水平显著下降(P<0.01)。见表1。
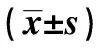
表1 各组一般资料及生化指标比较
2.2Gal-3与其他指标的Pearson相关分析 血清Gal-3水平与BMI、WC、FIns、FPG、2 h PG、HbA1c、HOMA-IR、IL-6、TG呈正相关(r=0.250、0.154、0.200、0.516、0.533、0.615、0.396、0.437、0.428;P<0.05,P<0.001),与HDL-C、HOMA-β、SOD呈负相关(r=-0.258、-0.519、-0.234,均P<0.001)。
2.3多元线性回归分析 以Gal-3为因变量,以FPG、2 h PG、HbA1c、HOMA-IR、FIns、SOD、BMI、WC、IL-6为自变量,行多元逐步回归分析结果显示HbA1c、BMI、IL-6是Gal-3的独立影响因素。回归方程:y=0.051×BMI+0.228×HbA1c+0.149×IL-6-0.967。见表2。
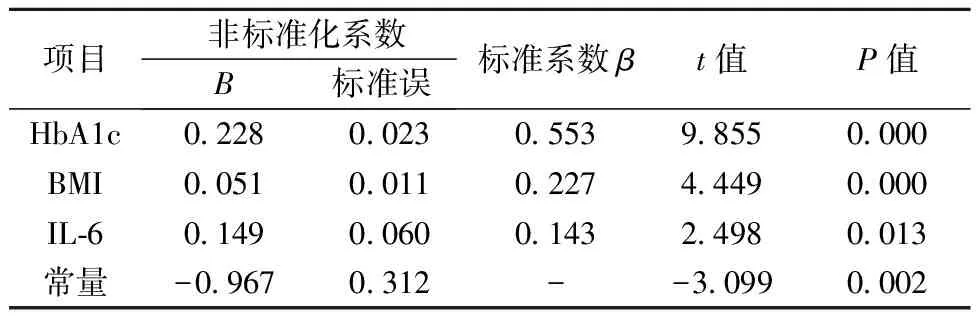
表2 多元逐步回归分析血清Gal-3的影响因素
2.4两组治疗前后一般指标及生化指标比较 与治疗前比较,L组治疗后血清 IL-6、HOMA-IR、FPG、2 h PG、FIns、Gal-3、TG、LDL-C、HbA1c水平下降;WC、BMI降低,血清SOD、HDL-C水平上升,HOMA-β升高,差异均有统计学意义(P<0.05 或P<0.01)。L组治疗后较Con组血清Gal-3、IL-6、FIns、LDL-C、TG、HOMA-IR水平下降;BMI、WC降低,差异均有统计学意义(P<0.05 或P<0.01),血清SOD、HDL-C水平上升,HOMA-β升高,差异均有统计学意义(P<0.05 或P<0.01)。见表3。
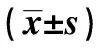
表3 L组、Con组治疗前后各指标比较
3 讨 论
研究发现,肥胖大鼠的脂肪组织及肥胖患者通过抽脂术取得的脂肪组织其Gal-3的表达均增加〔7〕。实验发现,Gal-3能够激活脂肪细胞过氧化物酶体增殖物激活受体(PPAR)γ,促进脂肪细胞分化〔8〕。已有临床研究发现肥胖的患者血清Gal-3水平增加,与BMI呈正相关〔9〕,这些提示Gal-3与肥胖关系密切,参与了肥胖的发生。而本研究也发现超重、肥胖患者血清Gal-3水平增高,与BMI相关,这与相关研究〔9〕结果一致。本研究进一步证实Gal-3与肥胖关系密切。与野生型小鼠相比,Gal-3基因敲除型小鼠体重减轻,白色脂肪组织减少,并且高脂喂养的Gal-3基因敲除鼠较高脂喂养的野生型大鼠体重轻〔8〕。这些提示抑制Gal-3的表达可减轻体重。本研究发现,利拉鲁肽治疗组Gal-3水平更低,同时伴有BMI的下降,利拉鲁肽可能通过降低Gal-3的水平影响了BMI。临床研究发现,Gal-3与血脂关系密切〔10〕。而本研究也发现,Gal-3与TG、LDL-C正相关,与HDL-C负相关,这与Melin等〔10〕研究结果一致,这也说明Gal-3与血脂关系密切。可能高水平的Gal-3参与了脂代谢异常的发生。而实验发现给予Gal-3抑制剂柑橘果胶 (MCP)能降低高脂喂养的肥胖大鼠的血脂水平〔11〕,提示降低Gal-3水平能改善脂代谢。本研究发现利拉鲁肽能够更显著地降低Gal-3水平,同时改善脂代谢的作用较为明显。本研究推测利拉鲁肽降低血脂部分依赖于Gal-3水平的降低。Gal-3 可直接结合胰岛素受体,抑制胰岛素及其下游转导信号通路,导致葡萄糖转运蛋白(GLUT)4对葡萄糖转运作用降低,加重IR〔12〕。实验发现,给予外源性的重组人Gal-3可以抑制胰岛素受体底物磷酸化,从而抑制胰岛素介导的葡萄糖的利用〔13〕,并且过表达的Gal-3可导致胰岛β细胞的凋亡〔14〕。临床研究发现,糖尿病患者Gal-3水平增高,与血糖、HOMA-IR、FIns具有相关性〔15〕。说明Gal-3参与了糖代谢异常的发生。而本研究也发现糖尿病患者Gal-3水平也增高,Gal-3和FPG、HOMA-IR、FIns正相关,并且HbA1C是Gal-3的独立影响因素,这进一步证实Gal-3参与了IR、糖代谢紊乱的发生。 已有研究发现,炎症因子能增加Gal-3的表达〔16〕,同时还有研究发现Gal-3还能增加IL-6等炎症因子的表达〔17〕。说明Gal-3与炎症关系密切,炎症与Gal-3能互相促进,两者之间形成了恶性循环。本研究发现IL-6与Gal-3具有相关性,这与相关研究结果一致〔9,18〕。本研究还发现IL-6是Gal-3的独立影响因素,这进一步证实Gal-3与炎症关系密切。本研究发现超重、肥胖者较体重正常者Gal-3水平更高。而超重、肥胖时机体处于炎症状态,可能超重、肥胖者高水平的炎症状态是其Gal-3水平升高的原因之一。实验发现,给予Gal-3抑制剂能够降低IL-6、TNF-α等炎症因子的水平〔19〕,提示抑制Gal-3能够改善炎症。已证实利拉鲁肽能够抑制炎症〔20〕。而本研究发现,利拉鲁肽治疗组Gal-3的水平下降的更显著,同时伴随有IL-6的水平明显降低,利拉鲁肽抑制炎症部分通过影响Gal-3完成。同时,炎症贯穿了IR、2型糖尿病的发生、发展的始终〔21〕。本研究发现利拉鲁肽治疗组HOMA-IR下降更明显,可能利拉鲁肽通过抑制Gal-3影响了炎症水平,从而发挥了改善IR、糖代谢的作用。
氧化应激是IR、T2DM发生的重要促进因素。而研究发现,Gal-3能够促进氧化应激的发生,其机制与增加过氧化物还原酶4的表达有关〔22〕。本研究发现,Gal-3与SOD负相关,这也说明Gal-3与氧化应激关系密切。Gal-3可能通过对氧化应激的影响参与了IR、T2DM的发生。研究发现肾脏缺血再灌注损伤的Gal-3基因敲除鼠肾脏ROS表达较野生型降低〔23〕。Fulton等〔24〕研究发现给予Gal-3抑制剂可降低肺动脉高压大鼠肺组织的活性氧水平。这些说明通过降低Gal-3的表达能够抑制氧化应激。利拉鲁肽有抗氧化应激的作用〔25〕。本研究发现,利拉鲁肽降低Gal-3的水平同时伴有SOD水平显著升高,推测利拉鲁肽抗氧化应激的作用部分依赖于降低Gal-3的水平。利拉鲁肽可能通过降低Gal-3的水平改善氧化应激,从而减轻了IR。
炎症、氧化应激同时可导致胰岛β功能降低〔26〕。并且研究发现糖尿病大鼠胰岛β细胞过表达Gal-3可导致β细胞凋亡〔14〕。在体内和体外实验发现,Gal-3表达增加在心肌缺血再灌注损伤中发挥了重要作用〔27〕。这些说明Gal-3在细胞的凋亡、损伤中发挥了重要作用。而本研究发现,糖尿病患者Gal-3水平增加,HOMA-β下降,Gal-3与HOMA-β负相关,推测Gal-3可能参与了T2DM患HOMA-β下降。研究〔27〕发现给予Gal-3抑制剂后,心肌缺血再灌注损伤的心肌细胞半胱氨酸天冬氨酸蛋白酶(Caspase)-3、促凋亡蛋白B淋巴瘤细胞相关x蛋白(Bax)等凋亡因子表达下降。有研究发现,Gal-3基因敲除鼠其胰岛β细胞在葡萄糖刺激下所分泌的胰岛素较野生型大鼠多,胰岛细胞Bax,caspase-3等凋亡因子表达降低〔28〕。这些提示抑制Gal-3能够减少细胞凋亡。利拉鲁肽能够减少胰岛β细胞凋亡,改善胰岛β细胞功能〔29〕。本研究发现利拉鲁肽降低Gal-3后伴有胰岛功能明显改善。可能利拉鲁肽改善胰岛β细胞功能可能与降低Gal-3水平有关。
综上所述,Gal-3与肥胖、糖脂代谢异常、炎症、氧化应激、HOMA-β关系密切。利拉鲁肽能够给减轻体重、改善脂代谢、减轻胰岛素抵抗、改善胰岛功能,其作用可能与降低Gal-3水平有关。深入研究Gal-3在肥胖、糖脂代谢异常、细胞损伤中的作用,对肥胖、糖尿病、血脂异常的防治提供了新的线索。
