颅底孤立性纤维性肿瘤的临床特点及其治疗
2022-05-11张广涛蔡洪庆赵兵何洁王嘉炜李学记万经海
张广涛,蔡洪庆,赵兵,何洁,王嘉炜,李学记,万经海
孤立性纤维性肿瘤(solitary fibrous tumor,SFT)是一种罕见的原发性颅内肿瘤,在所有颅内肿瘤中占比少于1%,颅底SFT临床更是少见。颅底SFT侵袭能力强,极易侵犯到周围正常的组织;恶性SFT(2、3级)还会出现颅外转移、预后更差[1-2]。其临床表现及影像学特征缺乏特异性,术前容易误诊;目前相关文献仅有个案报道,且尚无标准治疗方案推荐。本研究回顾性分析了中国医学科学院肿瘤医院和安徽医科大学第二附属医院2015年9月—2019年9月收治的10例颅底SFT患者的临床资料,就其临床特征和诊疗模式进行初步探讨。现报告如下。
1 资料与方法
1.1 一般资料 共纳入10例原发性颅底SFT患者,其中男4例,女6例;年龄27~67岁,中位年龄57.5岁。常见的临床症状有头颈部包块(3例)、头痛(3例)、听力下降(3例)、视觉障碍(2例);此外,还有头晕1例,耳鸣1例,癫痫1例,声音嘶哑伴饮水呛咳1例,闭目难立征1例;初治6例,复发4例,其中多次复发3例,肺部转移1例,介入栓塞治疗后1例,伽马刀治疗后1例。
1.2 影像学检查 患者术前均进行薄层CT、平扫和增强MRI检查,部分病例同时行CTA或MRA检查以了解颈内动脉、椎动脉的通畅情况及它们和肿瘤的关系。肿瘤巨大者行DSA检查和术前栓塞。肿瘤位于颈静脉孔区4例,桥小脑角区3例,中颅底颞下窝1例,颅颈交界区椎管内外沟通肿瘤1例,多发、同时累及右侧颞下窝和同侧颈静脉孔区肿瘤1例。CT平扫SFT多为稍低密度或等密度,肿瘤多侵犯骨质(图1)。MRI平扫T1WI信号呈等或稍低信号,T2WI信号大部分呈高信号(图2),注射对比剂后明显均匀强化,无囊变、坏死。
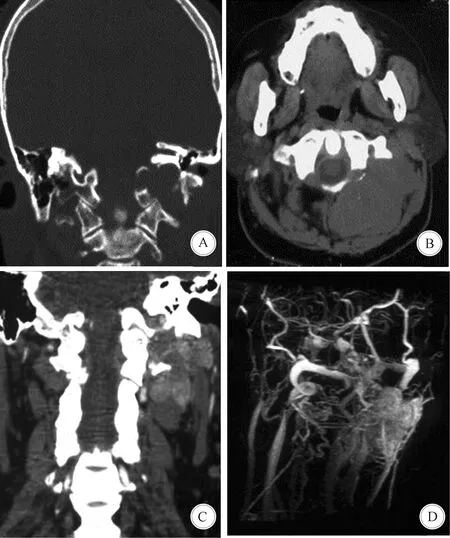
A:CT骨窗示左侧颈静脉孔区肿瘤侵犯骨质; B:CT轴位平扫示肿瘤呈等密度; C:CT冠状位增强示肿瘤呈不均匀强化; D:CTA可见肿瘤血供丰富

A:肿瘤轴位T1WI呈等信号; B:轴位T2WI呈混杂稍高信号; C:增强扫描呈明显强化; D:DWI明显扩散受限; E:冠状位T2WI肿瘤信号不均,有高信号区也有低信号区,呈特征性的“阴阳征”; F:术后轴位增强MRI示肿瘤全切; G:术后矢状位MRI示肿瘤全切除; H:术后冠状位MRI示肿瘤全切; I:颅颈联合入路C型切口,便于制作带蒂颞肌筋膜瓣用来重建颅底,必要时可以取颞肌填塞颈静脉孔区手术死腔
1.3 方法 所有病例经术前综合评估后均行个体化手术治疗,根据肿瘤部位选择个体化手术入路和手术方式。手术过程中尽可能全切除肿瘤、受累骨质和硬脑膜,尽可能采用锐性分离方式分离和肿瘤黏连的神经血管,最大限度地保留神经血管结构。1例颅颈交界区椎管内外沟通肿瘤和1例多发巨大颅颈沟通肿瘤因肿瘤巨大和血供丰富术前进行了栓塞治疗。1例颅颈交界区椎管内外沟通肿瘤、4例颈静脉孔区颅颈沟通肿瘤和1例多发巨大颅颈沟通肿瘤采用颅颈联合入路切除,3例桥小脑角区肿瘤则取乙状窦后入路显微手术切除,1例中颅底颞下窝肿瘤取唇下经上颌窦入路内镜手术切除。术后均嘱患者进行辅助放射治疗。
1.3.1 颅颈联合入路 侧卧位,头抬高15°,可减少术中出血。手术切口采用自枕部乳突后到颈部胸锁乳突肌前缘的耳后C型切口,该切口便于制作带蒂颞肌筋膜瓣重建颅底。切开头皮,分离皮下组织、肌肉、肌肉筋膜,于胸锁乳突肌下部前缘游离显露颈鞘,分离显露颈内静脉、颈内动脉和舌下神经;逐层分离肿瘤周边组织至肿瘤假包膜,沿肿瘤假包膜游离肿瘤边界至寰椎前外侧和颅底;近颅底处游离切除肿瘤表面残存颈突舌骨肌、咬除颈突,充分显露肿瘤。磨钻磨除残留的乳突骨质至后颅窝硬膜和乙状窦,在椎动脉入硬膜处内侧切开硬脑膜,辨清椎动脉、小脑后下动脉后,方可开始切除肿瘤。肿瘤切除彻底后,充分止血,骨缘磨除处需用骨蜡仔细封补;用颞肌筋膜重建硬脑膜缺损,必要时可以取颞肌填塞颈静脉孔区手术死腔,以避免脑脊液漏;留置皮下引流管;分层间断缝合皮下组织和皮肤。
1.3.2 乙状窦后入路 侧卧位,采用常规乙状窦后入路,显露右侧颞顶枕部颅骨,上方暴露星点,下方暴露乳突内侧4~5 cm区域。于星点处钻骨孔,确认横窦、乙状窦夹角,分离硬脑膜与骨板的粘连,用铣刀铣下骨瓣,暴露横窦乙状窦夹角与乙状窦上段内侧缘即可,不必完全暴露乙状窦和横窦,若乳突气房开放,必须用骨蜡严密封补。以乙状窦为基底,弧形剪开硬脑膜,用脑压板牵开小脑即可探查肿瘤。肿瘤全切后术区充分止血,留置术区引流管,严密缝合硬脑膜,骨瓣复位固定,分层间断缝合颞肌、皮下组织和皮肤。
1.3.3 唇下经上颌窦内镜手术入路 仰卧位,牵开患侧上唇,距唇龈沟上方约0.5 cm处,自尖牙嵴向外做一长约2.5 cm横切口,直达骨质。沿着骨膜剥离软组织及黏膜,向上接近眶下孔,向内达梨状孔,显露上颌窦前壁骨质约2.5 cm大小。于上颌窦前壁开窗直径约2 cm大小,内镜进入上颌窦腔,清除窦腔内黏膜,探及肿瘤,于瘤周咬除上颌窦壁骨质,扩大骨窗后充分显露肿瘤。仔细分离肿瘤与周围组织相对边界,电凝切断上颌内动脉向肿瘤的供血后切除肿瘤,若肿瘤外极难以直视,可用刮圈在镜下刮除。镜下肿瘤全切后彻底止血,复位下鼻甲-膜性鼻泪管瓣膜后行下鼻道开窗术,最后双侧鼻腔填塞碘仿纱条;间断缝合上唇切口,于面部尖牙窝处加压包扎。
1.4 随访与统计学方法 随访方式包括电话和门诊复查,随访内容包括患者术后有无放疗,肿瘤有无复发转移,复发转移的时间,后续治疗,患者生存时间、死亡时间、死亡原因等。随访结果使用SPSS 25.0软件统计数据,并用Kaplan-Meier法分析总生存期(overall survival,OS)、无进展生存期(progression free survival,PFS)。
2 结 果
2.1 手术结果 肿瘤全切除9例,1例桥小脑角区SFT因部分肿瘤侵入横窦内缘,切开横窦,给予电凝处理,为次全切除。无手术死亡病例。术后1例声音嘶哑伴饮水呛咳明显好转;新出现周围性面瘫1例;出现小脑血肿1例,急诊行小脑半球血肿清除术+去骨瓣减压术,后恢复良好出院。
2.2 病理结果 HE染色显示肿瘤细胞通常呈梭形,排列于鹿角形、透明样变血管周围,常伴有宽大胶原纤维,有核分裂像,其中恶性6例,占60%。免疫组化结果显示Vimenitn全强阳性,CD34全阳性,BCL2阳性5例,CD99阳性5例,6例恶性SFT的Ki-67>5%,4例良性SFT的Ki-67<5%。
2.3 随访结果 随访时间为27~72个月。随访结果9例复发,复发时间为3~23个月,中位时间为8个月,2例复发后再次手术,2例行伽马刀治疗;1例发现肝脏、肺部转移;6例死亡。6例术后进行了辅助放疗,放疗组中位PFS为12.5个月,显著高于未放疗组5.5个月(P=0.01);3年无进展生存率为10(图3)。放疗组中位OS为42个月,显著高于未放疗组30.5个月,但P=0.50,差异无统计学意义;3年、5年生存率分别为40、10(图4)。

图3 颅底SFT的无进展生存曲线

图4 颅底SFT的生存曲线
3 讨 论
根据《2021年第五版世界卫生组织中枢神经系统肿瘤分类》,将WHO 2016年CNS分类中的“孤立性纤维性肿瘤/血管外皮细胞瘤”去除了“血管外皮细胞瘤”,修订为“孤立性纤维性肿瘤”,并根据肿瘤WHO分级分为Ⅰ、Ⅱ、Ⅲ级,以完全符合软组织病理学命名法。Ⅰ级为良性肿瘤,预后好;Ⅱ级为低度恶性肿瘤,可获得较好的预后;Ⅲ级恶性程度较高,整体预后不佳[3]。
本组颅底SFT好发部位是颈静脉孔区,女性多于男性,多发生于40~60岁。通常以头颈部包块为首发症状,颈静脉孔区颅颈沟通肿瘤常有后组颅神经受累症状;而颅内其他部位SFT多无明显特异的症状,巨大肿瘤可以引起颅内压增高并压迫脑神经,从而导致神经受损。
颅底SFT影像学表现与颅底其他肿瘤较难鉴别,但是MRI上SFT的流空效应更多是蛇形而非太阳状[4],T2WI上有特征性的等或低-高混合信号,即“阴阳征”(图2)[5-6]。另有研究发现,SFT的表观弥散系数显著高于低级别和高级别脑膜瘤[7-8]。但是这些观察结果还需要在未来更大样本量的研究中得到证实。脑膜瘤CT表现常伴邻近颅骨反应性增厚,而SFT容易引起周围骨质压迫吸收或破坏,这可与脑膜瘤相鉴别[9]。
颅底SFT的治疗首选手术切除,无论病理分级如何,肿瘤全切都应该是颅底SFT手术的目标[2]。手术可以缓解肿瘤压迫症状,并在组织学上明确诊断。文献报道手术全切能显著改善患者预后[1],术后是否需要辅助放疗,目前尚有争议。有研究发现,术后辅助放疗可减少局部肿瘤复发,延长患者PFS,但并未延长患者OS[2,10]。本研究中的6例颅底SFT术后行辅助放疗,PFS显著优于未放疗的患者,并无明显严重的放疗不良反应,这与上述文献报道的一致。另有文献报道,放疗并未改善颅底SFT患者的PFS及OS[11-12],但需要较大样本量的研究进一步明确。此外,多项研究报道了颅内SFT的中位OS从73~216个月不等[1,2,13-15],而本研究结果显示颅底SFT的中位OS(30.5个月)显著低于颅内SFT,可能原因有:(1)本研究中患者术前多为复发患者;(2)颅底SFT恶性度较高、难以根治性切除、容易复发;(3)病例数较少。
分子水平上,颅内SFT特异性最高的免疫组织化学标记物是STAT6,其次是ALDH1和CD34,波形蛋白(vimenitn,VIM)很少见[1,16],几乎100%的SFT存在SATA6-NAB2基因融合,它在诊断SFT上有很高的临床实用价值,灵敏度96.6、特异度100[16]。但是本研究的数据显示,颅底SFT中表达最高的是VIM,其次是CD34。VIM是蛋白质中间丝家族主要成员,参与上皮-间质转化(epithelial-mesenchymal transition,EMT)过程,且已被公认为EMT的标志物,VIM在高侵袭性、低分化的前列腺癌、胃癌、乳腺癌、黑色素瘤以及中枢神经系统的胶质母细胞瘤和脑膜瘤中高表达,而在高分化肿瘤细胞中低表达甚至不表达,其在癌症中过度表达与肿瘤的增殖、侵袭和预后不良密切相关,是具有很高潜力的肿瘤分子治疗靶点[17]。因此,VIM在颅底SFT中的高表达可能是颅底SFT易复发转移的原因,其分子靶向治疗有望改善颅底SFT的预后。文献报道,WNT信号通路的异常改变常常发生在颅外侵犯的颅内SFT细胞中,具体包括WNT5A在内的WNT信号通路活性下降,进而使血管内皮紧密连接标志物CLDN5的表达降低,导致血管内皮细胞生成失调和血管通透性增加,促进侵袭血管和远处转移能力[18]。另外,Kamamoto等[19]发现PD-L1在颅内SFT中高表达,且PD-L1表达可能与颅外转移的发生有关。
颅底SFT治疗困难、预后较差,即使在肿瘤全切后仍有高复发率和远处转移[20],因此需要探索新的治疗方案改善患者预后。一项小样本的Ⅱ期临床试验证实进展期SFT患者可以从Axitinib靶向治疗中获益,PFS得到延长[21]。近些年,PD1/PDL1是肿瘤免疫治疗研究中的热点分子,以其为靶点的免疫治疗在多种肿瘤中取得非常好的治疗效果。在颅底SFT中,PD1/PDL1抗体免疫治疗仍处于探索中。
综上所述,颅底SFT与颅内SFT相比,恶性度高,易复发、转移;首选手术治疗,推荐术后辅助放疗,但是总体治疗效果仍不理想,所以亟需在分子水平进行更深一步探索,寻找有效的分子靶点。
利益冲突:所有作者均声明不存在利益冲突。
