ILK-siRNA-AAV对大鼠青光眼滤过术后滤过通道瘢痕形成的抑制作用
2022-05-11邢瑶王建明范雅稚熊蕾王文菁崔丽珺
邢瑶 王建明 范雅稚 熊蕾 王文菁 崔丽珺
1西安交通大学第二附属医院眼科,西安 710004;2西安交通大学第一附属医院眼科,西安 710061
降低眼压是青光眼治疗中唯一经过多中心验证、有确切临床疗效的治疗方案。早期手术仍是主要的青光眼治疗方法,青光眼滤过手术是经典和广泛应用的手术方式,而术后滤过泡瘢痕形成阻碍房水引流,引起眼压升高,是导致手术失败的主要原因。整合素连接激酶(integrin-linked kinase,ILK)是整合素信号通路的关键激酶,参与调控创伤愈合中成纤维细胞的增生、迁移、侵袭、分化和收缩等关键步骤。本课题组前期在体外培养人Tenon囊成纤维细胞(human Tenon fibroblasts,HTFs)中转染ILK-小干扰RNA(small interfering RNA,siRNA)-慢病毒,特异性沉默ILK表达,发现ILK沉默后在转化生长因子(transforming growth factor,TGF)-β2作用下HTFs活性减弱,迁移、转分化和合成细胞外基质能力均降低,细胞凋亡增加;细胞周期中G1/G0期细胞比例升高,引起G1期阻滞,提示在离体培养的HTFs中沉默ILK可对细胞活化产生抑制作用。而在体环境更为复杂,大鼠球结膜滤过泡模型中ILK沉默是否能发挥抗瘢痕形成作用仍需要进一步探讨。本研究拟采用大鼠青光眼滤过术后滤过泡内ILK-siRNA-腺相关病毒(adeno-associated virus,AAV)注射法观察ILK
基因沉默对术区组织瘢痕形成的抑制作用。1 材料与方法
1.1 材料
1
.1
.1
实验动物 SPF级8~9周龄SD大鼠48只,体质量200~300 g,由西安交通大学医学实验动物中心提供,均排除眼部疾患,饲养于(23.0±0.5)℃、湿度为65%~66%动物房内,自由饮食进水。实验动物的使用和喂养符合实验动物伦理规范并遵循美国视觉和眼科研究协会的动物使用宣言规定。本研究方案经西安交通大学医学部医学伦理委员会审核批准(批文号:2013-772)。1
.1
.2
主要试剂及仪器 水合氯醛(上海山浦化工有限公司);多聚甲醛(天津科密欧化学试剂有限公司);O.C.T组织包埋剂(美国McCormick Scientific公司);Masson三色染色液(西安赫特生物科技有限公司);Triton X-100(美国Amresco公司);DNA上样缓冲液(D0071)、50倍TAE(ST716)、NA-red(D0128)、总RNA抽提试剂盒(上海碧云天生物技术公司);cDNA合成试剂盒(日本Takara公司);Super DNA Marker、质粒DNA小量、大量抽提试剂盒(北京康为世纪生物公司);大肠杆菌菌株DH5α(美国Invitrogen公司);限制性内切酶、T4连接酶、琼脂糖、琼脂粉(Sangon Biotech)、DNA ladder(美国Thermo Fisher公司);凝胶回收试剂盒(上海捷瑞生物工程有限公司);兔抗单克隆ILK抗体(ab52480)、小鼠抗单克隆β-actin抗体(ab6276)、山羊抗兔lgG-HRP抗体(ab6721)、山羊抗小鼠lgG-HRP抗体(ab6789)(美国Abcam公司)。组织机械粉碎仪(PT 2100,瑞士Poly Tron公司);超声破碎仪(VCX500,美国Sonics公司);超速冷冻离心机(3K30,德国Sigma公司);ND-1000核酸蛋白定量仪(美国Nano Drop公司);逆转录PCR仪(美国Thermo Fisher公司);医用耐高温高压毛细管(0.3 mm×0.8 mm,上海九华设备公司);回弹式眼压计SW-500(天津索维电子技术有限公司)。1.2 方法
1
.2
.1
带有ZsGreen荧光标记ILK-siRNA-AAV载体的构建 选用干扰载体pHBAAV-U6-ZsGreen,目的片断插入BamHI和EcoRI位点,由U6启动子调控,该载体中含有CMV启动子调控的ZsGreen基因标记。设计合成针对SD大鼠的干扰病毒载体:干扰基因为Rattus norvegicus ILK mRNA,complete cds GI为13111652;Target为GACGCTCAGCAGACATGTGGA;引物退火形成带黏性末端的双链片段,引物由上海汉恒生物公司合成;将PAGE胶纯化的oligo序列分别稀释至100 μmol/L;后续病毒包装委托上海汉恒生物公司完成。对照病毒载体上siRNA序列和shRNA序列如下:siRNA序列为5’-TTCTCCGAACGTGTCACGTAA-3’;shRNA序列正义链为5’-GATCCGTTCTCCGAACGTGT CACGTAATTCAAGAGATTACGTGACACGTTCGGAGAA TTTTTTC-3’,反义链为5’-AATTCAAAAAATTCTCCG AACGTGTCACGTAATCTCTTGAATTACGTGACACGTTC GGAGAACG-3’。干扰序列设计如下:siRNA1序列为5’-GACGCTCAGCAGACATGTGGA-3’;shRNA1序列正义链为5’-GATCCGACGCTCAGCAGACATGTGGATT CAAGAGATCCACATGTCTGCTGAGCGTCTTTTTTC-3’,反义链为5’-AATTGAAAAAAGACGCTCAGCAGACATG TGGATCTCTTGAATCCACATGTCTGCTGAGCGTCG-3’。1
.2
.2
大鼠抗青光眼滤过术 采用盐酸奥布卡因滴眼液点眼行表面麻醉,测量双侧基础眼压。大鼠腹腔内注射质量分数10%水合氯醛(320~350 mg/kg),选取左眼为手术眼,右眼无特殊处理。手术显微镜下剪开外眦部位,暴露颞上象限。12:30~2:30位沿角巩缘剪开球结膜,做以穹隆为基底的结膜瓣,向后分离结膜下及筋膜组织。于角膜缘0.2 mm处用5 ml空针针头呈45°角倾斜穿刺至前房,制作穿刺通道。将医用毛细微管剪成约3 mm、两头带斜面的房水引流管,一端沿穿刺通道插入前房,一端用10-0缝线固定于巩膜壁。结膜复位,10-0尼龙线缝合结膜囊两端,确保房水无渗漏。1
.2
.3
实验动物分组及处理 采用随机数表法将大鼠随机分为空白对照组、ILK-siRNA-AAV组、NC-siRNA-AAV组和丝裂霉素C(mitomycin C,MMC)组,每组12只。空白对照组、ILK-siRNA-AAV组和NC-siRNA-AAV组于滤过术后1 d,采用32G胰岛素针分别吸取磷酸盐缓冲液(phosphate buffered saline,PBS)、ILK特异性AAV重组体和阴性对照AAV 5 μl轻柔注入滤过泡内,MMC组术中使用含0.4 mg/ml MMC的小棉片置于结膜瓣下5 min。1
.2
.4
眼压测量及手术区组织大体观察 (1)眼压测量 术前及术后1、2、3、7、14、21和28 d,9:00~10:00大鼠腹腔内注射10%水合氯醛(320~350 mg/kg),待大鼠麻醉后,采用手持回弹式眼压计测量双眼眼压,每眼测量3次,取平均值。(2)手术区组织大体观察 术后1、2、3、7、14、21和28 d,手术显微镜下观察结膜充血,角膜混浊,前房留置管位置,虹膜、瞳孔及晶状体情况和滤过泡形态,观察是否有出血、炎症及内置管脱落等手术并发症发生,并拍照记录。采用Kaplan-Meier生存分析计算滤过泡生存天数。1
.2
.5
逆转录PCR法检测ILK mRNA表达 术后28 d,各组分别选取5只大鼠,腹腔内注射10%水合氯醛深度麻醉大鼠,采用颈椎脱臼法将其处死,手术显微镜下取各组大鼠术眼眼球,小心剥离术区结膜及结膜下组织,转移至冰上的离心管中,按照总RNA抽提试剂盒(离心柱式)说明书进行操作,提取纯化的总RNA。采用ND-1000核酸定量仪测定RNA浓度及吸光度(absorbance,A
)值。逆转录反应体系为:5倍PrimeScript RT Master Mix 4 μl,总RNA 1 000 ng(3~5 μl),RNase Free dHO加至20 μl;反应条件为:37 ℃逆转录反应15 min,85 ℃逆转录酶失活反应5 s,4 ℃保存30 min。冰上冷却至4 ℃,用于下一步PCR使用。ILK正向引物序列为5’-ACGCTGCTATGGACGACATT-3’,反向引物序列为5’-CATGATCAGCATTTCAACCACT-3’;GAPDH正向引物序列为5’-GGCACAGTCAAGGCTGAGAATG-3’,反向引物序列为5’-ATGGTGGTGAAGACGCCAGTA-3’;反应体系:2倍Master Mix 12.5 μl,cDNA 3.0~5.0 μl,引物各0.5 μl,加ddHO至总体积25.0 μl;反应条件:94 ℃变性30 s,50 ℃(ILK)或54 ℃(GAPDH)退火45 s,72 ℃延伸60 s,30个循环;72 ℃再延伸10 min。3%琼脂糖凝胶每个梳孔加入10 μl PCR扩增产物。以100 V电压、45 mA电流电泳30 min,采用GelDoc200型全自动凝胶成像分析系统观察并拍照。以GAPDH为内参,计算ILK mRNA相对表达水平。1
.2
.6
Western blot法检测ILK蛋白表达 取1.2.5部分剥离的结膜及结膜下组织转移至冰上的离心管中,分别提取细胞总蛋白。SDS-PAGE蛋白电泳:将配好胶的玻璃板固定在电泳槽中,加入电泳缓冲液。用微量加样器将样品缓慢注入加样孔中,每孔10 μl。80 V电泳40~50 min,120 V电泳90~120 min。蛋白转膜:将PVDF膜和凝胶置于半干转印电泳仪中央,转印90 min。将转印好的PVDF膜置于含有质量分数5%脱脂奶粉封闭液的孵育盒中,室温条件下在摇床上孵育1 h。将膜放入杂交袋中,加入用5%脱脂奶粉封闭液稀释的ILK(1∶ 1 000)和β-actin(1∶ 1 000),封闭杂交袋,室温下轻摇孵育1 h,4 ℃孵育过夜。采用TBST将膜漂洗15 min,共3次。加入HRP标记的二抗(1∶ 100 000),室温孵育2 h。采用TBST漂洗15 min,共3次。ECL化学发光显色并用凝胶成像分析系统拍照。采用ImageJ软件对蛋白条带进行灰度分析,以β-actin为内参,计算目的蛋白相对表达量。独立重复实验3次。1
.2
.7
苏木精-伊红染色法观察各组大鼠滤过泡组织形态学变化 术后28 d,各组分别取2只大鼠,腹腔内注射10%水合氯醛深度麻醉大鼠,采用颈椎脱臼法将其处死,左心室快速灌注4 ℃预冷0.9%氯化钠溶液200 ml和预冷质量分数4%多聚甲醛500 ml,取出完整双侧眼球,注意保护好结膜组织。将眼球置于4%多聚甲醛溶液中4 ℃固定24 h。梯度蔗糖溶液脱水。将O.C.T包埋好的组织在冰冻切片机上进行冠状连续切片,小心挑出晶状体避免破坏周围组织,以缝线为标志定位结膜瓣及结膜下组织,切片厚度为12 μm,直接贴片黏附于载玻片上,于37 ℃烘箱内干燥后,进行下一步实验。体积分数95%乙醇脱水2 min,ddHO中水化4 min,苏木素染色3~5 min,流动的自来水洗片5 min,酸乙醇中浸泡3~5 s,自来水洗蓝化3~5 min,伊红染色30 s,梯度乙醇脱水固定,二甲苯透化1 min,中性树胶封片,自然风干,光学显微镜下观察滤过通道形态并拍照。1
.2
.8
Masson染色法观察术区组织胶原纤维沉积情况 术后28 d,各组分别取5只大鼠,处死大鼠及制备完整眼球冰冻切片方法同1.2.7。取各组冰冻切片,PBS漂洗2 min;苏木素染色10 min;流动的自来水漂洗10 min;蒸馏水漂洗5 s;比布列猩红染液染色13 min;蒸馏水快速漂洗5 s,漂洗3次;用缓冲液分化13 min,直至胶原不显示红色;将切片直接转移入苯胺蓝染液中,染色8 min;蒸馏水直接漂洗5 s;体积分数1%酸乙醇分色3 min;蒸馏水漂洗5 s;95%乙醇、100%乙醇快速脱水,二甲苯透明,中性树脂封片;待切片干燥后置于显微镜下观察并拍照,巩膜组织中胶原纤维呈蓝色阳性染色。Masson染色分析胶原纤维沉积程度:400倍视野下,每张切片随机选取10个互不重叠的术区结膜组织视野,采用ImageJ软件对采集的图片结果进行分析,计算蓝色胶原纤维染色面积的A
值,根据视野中胶原纤维染色阳性面积占整个组织视野面积的百分比进行半定量分析。表1 各组大鼠行抗青光眼滤过术前后不同时间点眼压比较(x±s,mmHg)Table 1 Comparison of intraocular pressure at various time points before and after glaucoma filtering surgeryamong four groups (x±s,mmHg)组别眼数手术前后不同时间点眼压值术前术后第1天术后第2天术后第3天术后第7天术后第14天术后第21天术后第28天空白对照组1210.75±1.286.08±1.566.58±1.386.67±1.1510.33±1.309.67±1.159.17±1.119.75±0.97NC-siRNA-AAV组1211.66±1.374.75±0.87a7.17±0.837.67±0.8910.17±1.1110.50±1.0010.08±1.5610.83±1.75ILK-siRNA-AAV组1211.58±0.994.08±0.51a5.50±1.515.75±1.426.00±1.21ab7.92±0.99ab8.33±1.97b6.67±1.61abMMC组1211.21±1.445.08±1.884.33±1.49a4.58±1.68a6.42±0.67ab7.42±1.16ab8.08±1.24b7.17±1.03ab 注:F分组=76.84,P<0.001;F时间=114.49,P<0.001;F交互作用=5.48,P<0.001.与空白对照组比较,aP<0.05;与NC-siRNA-AAV组比较,bP<0.05(重复测量两因素方差分析,LSD-t检验) siRNA:小干扰RNA;AAV:腺相关病毒;ILK:整合素连接激酶;MMC:丝裂霉素 1 mmHg=0.133 kPa Note:Fgroup=76.84,P<0.001;Ftime=114.49,P<0.001;Finteraction=5.48,P<0.001.Compared with blank control group,aP<0.05;compared with NC-siRNA-AAV group,bP<0.05 (Two-way repeated measures ANOVA,LSD-t test) siRNA:small interfering RNA;AAV:adeno-associated virus;ILK:integrin-linked kinase;MMC:mitomycin C 1 mmHg=0.133 kPa
1.3 统计学方法
采用SPSS 18.0统计学软件进行统计分析,Graph Pad Prism v5.0软件作图。计量资料数据经Shapiro-Wilk检验证实呈正态分布,以表示,经Levene检验证实方差齐。各组大鼠术前及术后不同时间点眼压差异比较采用重复测量两因素方差分析,各组大鼠球结膜滤过泡术区组织ILK mRNA和蛋白相对表达量、滤过泡生存时间、胶原纤维染色面积的A
值总体差异比较采用单因素方差分析,组间两两比较采用LSD-t
检验。P
<0.05为差异有统计学意义。2 结果
2.1 各组大鼠行抗青光眼滤过术前后不同时间点眼压比较
各组大鼠手术前后不同时间点眼压总体比较差异均有统计学意义(F
=76.84,P
<0.001;F
=114.49,P
<0.001;F
=5.48,P
<0.001),其中NC-siRNA-AAV组术后第1天眼压低于空白对照组,ILK-siRNA-AAV组术后第1、7、14和28天眼压均低于空白对照组,MMC组术后第2、3、7、14和28天眼压均低于空白对照组,ILK-siRNA-AAV组和MMC组术后第7、14、21和28天眼压均低于NC-siRNA-AAV组,差异均有统计学意义(均P
<0.05)(表1)。2.2 各组大鼠行抗青光眼滤过术后滤过泡特征及生存时间比较
2
.2
.1
各组大鼠术后不同时间点术眼眼前节反应及滤过泡特征比较 术后第1天,各组手术区域均可见结膜轻度充血及弥散、较扁平的滤过泡。术后第2天,除MMC组外,其他各组结膜充血和角膜轻度混浊消失。术后第3天,各组炎症反应均消失,角膜透亮,可看到插入前房的引流微管,滤过泡隆起、透明,范围超过3个钟点。术后第7天,空白对照组和NC-siRNA-AAV组滤过泡局限消失,结膜组织、苍白增厚,与下方巩膜粘连;ILK-siRNA-AAV组和MMC组仍可见隆起的滤过泡,其中MMC组滤过泡壁菲薄、苍白。术后第14天,空白对照组和NC-siRNA-AAV组结膜增厚、苍白,包裹下方内置管;ILK-siRNA-AAV组滤过泡变扁平,MMC组仍可见薄壁、苍白滤过泡。术后第21天和第28天,空白对照组和NC-siRNA-AAV组术区无明显变化,结膜呈灰白增厚状态;ILK-siRNA-AAV组仍可见扁平滤过泡;MMC组滤过泡泡壁未见血管,呈苍白色(图1)。
图1 各组大鼠行抗青光眼滤过术后不同时间点滤过泡变化(×16) 术后第1~3天,各组手术区域均可见滤过泡隆起。术后第7天,空白对照组和NC-siRNA-AAV组滤过泡局限消失,结膜组织苍白增厚。术后第14~28天,ILK-siRNA-AAV组仍可见扁平滤过泡,MMC组滤过泡泡壁无血管,呈苍白色,空白对照组和NC-siRNA-AAV组术区结膜呈灰白增厚状态 ILK:整合素连接激酶;siRNA:小干扰RNA;AAV:腺相关病毒;MMC:丝裂霉素CFigure 1 Morphological changes of filtering blebs over time under surgical microscope (×16) Bulged filtering blebs in surgical sites were found in different groups within 1 to 3 days after operation.Seven days after operation,localized filtering blebs disappeared and the conjunctival tissue was pale and thickened in normal control group and NC-siRNA-AAV group.Fourteen to twenty-eight days after operation,flat filtering blebs were seen in ILK-siRNA-AAV group;avascular and pale filtration blebs were found in MMC group;gray and thickened filtering blebs were observed in blank control group and NC-siRNA-AAV group ILK:integrin-linked kinase;siRNA:small interfering RNA;AAV:adeno-associated virus;MMC:mitomycin C
2
.2
.2
各组滤过泡生存天数比较 Kaplan-Meier生存分析结果显示,空白对照组、NC-siRNA-AAV组、ILK-siRNA-AAV组和MMC组滤过泡生存天数分别为(3.50±1.51)、(5.00±3.41)、(31.50±3.15)和(31.33±2.46)d,总体比较差异有统计学意义(F
=395.83,P
<0.05),其中ILK-siRNA-AAV组和MMC组滤过泡生存时间均长于空白对照组和NC-siRNA-AAV组,差异均有统计学意义(均P
<0.05)(图2)。
图2 各组大鼠行抗青光眼滤过术后滤过泡Kaplan-Meier生存曲线 ILK-siRNA-AAV组和MMC组滤过泡生存时间明显长于空白对照组和NC-siRNA-AAV组 ILK:整合素连接激酶;siRNA:小干扰RNA;AAV:腺相关病毒;MMC:丝裂霉素CFigure 2 Kaplan-Meier bleb survival curves of rats in different groups The survival time of filtering bleb was longer in ILK-siRNA-AAV and MMC groups than blank control group and NC-siRNA-AAV group ILK:integrin-linked kinase;siRNA:small interfering RNA;AAV:adeno-associated virus;MMC:mitomycin C
2.3 各组大鼠球结膜滤过泡组织中ILK mRNA表达比较
逆转录PCR结果显示,ILK-siRNA-AAV组ILK mRNA表达条带较弱,空白对照组、NC-siRNA-AAV组和MMC组ILK mRNA表达条带强(图3)。空白对照组、NC-siRNA-AAV组、ILK-siRNA-AAV组和MMC组ILK mRNA相对表达量分别为0.428±0.020、0.349±0.034、0.053±0.009和0.412±0.022,总体比较差异有统计学意义(F
=222.32,P
<0.05),其中ILK-siRNA-AAV组ILK mRNA相对表达量明显少于空白对照组和NC-siRNA-AAV组,差异均有统计学意义(均P
<0.05)。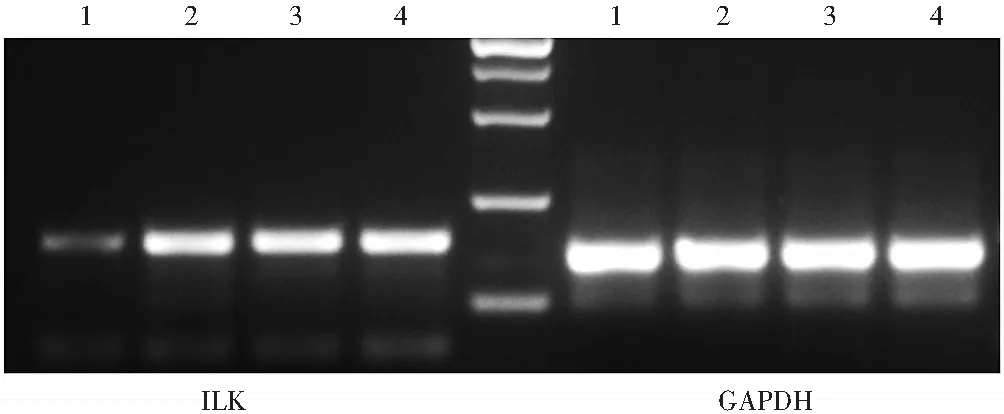
图3 逆转录PCR法检测各组大鼠ILK mRNA表达水平 ILK-siRNA-AAV组ILK mRNA表达条带较弱,空白对照组、NC-siRNA-AAV组和MMC组ILK mRNA表达条带强 1:ILK-siRNA-AAV组;2:NC-siRNA-AAV组;3:MMC组;4:空白对照组 ILK:整合素连接激酶;GAPDH:甘油醛-3-磷酸脱氢酶Figure 3 Expression levels of ILK mRNA in bleb tissue in different groups by RT-PCR Band intensity of ILK mRNA was weak in ILK-siRNA-AAV group and was strong in NC-siRNA-AAV group,MMC group and blank control group 1:ILK-siRNA-AAV group;2:NC-siRNA-AAV group;3:MMC group;4:blank control group ILK:integrin-linked kinase;GAPDH:glyceraldehyde-3-phosphate dehydrogenase
2.4 各组大鼠球结膜滤过泡组织中ILK蛋白表达比较
空白对照组、NC-siRNA-AAV组、ILK-siRNA-AAV组和MMC组ILK蛋白相对表达量分别为0.72±0.01、0.76±0.03、0.14±0.01和0.69±0.03,总体比较差异有统计学意义(F
=752.69,P
<0.05),其中ILK-siRNA-AAV组ILK蛋白相对表达量明显少于空白对照组和NC-siRNA-AAV组,差异均有统计学意义(均P
<0.05)(图4)。
图4 Western blot法检测各组大鼠球结膜滤过泡组织中ILK蛋白表达比较 A:各组ILK蛋白表达电泳图 B:各组ILK蛋白表达水平量化比较 F=752.69,P<0.05.与空白对照组比较,aP<0.05;与NC-siRNA-AAV组比较,bP<0.05(单因素方差分析,LSD-t检验,n=15) 1:ILK-siRNA-AAV组;2:NC-siRNA-AAV组;3:MMC组;4:空白对照组 ILK:整合素连接激酶;β-actin:β肌动蛋白Figure 4 Expression levels of ILK protein in bleb tissue in different groups by Western blot A:Electrophoretogram of ILK protein in different groups B:Comparison of ILK protein expression levels among four groups F=752.69,P<0.05.Compared with blank control group,aP<0.05;compared with NC-siRNA-AAV group,bP<0.05 (One-way ANOVA,LSD-t test,n=15) 1:ILK-siRNA-AAV group;2:NC-siRNA-AAV group;3:MMC group;4:blank control group ILK:integrin-linked kinase
2.5 各组大鼠滤过泡组织形态学比较
术后28 d,空白对照组和NC-siRNA-AAV组术区结膜纤维层显著增厚,纤维结缔组织增生,排列紧实,细胞大量增生,成纤维细胞密度高,呈团块状生长,排列混乱,其间可见腺体及小血管增生;ILK-siRNA-AAV转染组球结膜较薄,纤维结缔组织排列疏松,可见其间空隙,少量成纤维细胞增生,排列整齐;MMC组结膜纤维层疏松,形成空洞,细胞稀少,结膜组织菲薄(图5)。
2.6 各组术区组织胶原纤维沉积情况比较
Masson染色结果显示,空白对照组及NC-siRNA-AAV组术区组织增厚,胶原纤维沉积增多,呈致密或疏松束状排列,或见片状蓝染;ILK-siRNA-AAV组胶原纤维沉积量少,可见少量蓝色阳性染色,呈疏松排列;MMC组手术区域可见空洞形成及血细胞,胶原纤维排列疏松(图6A)。
术后28 d,空白对照组、NC-siRNA-AAV组、ILK-siRNA-AAV组和MMC组胶原纤维染色阳性面积占整个组织视野面积的百分比分别为(87.64±1.59)%、(82.43±2.51)%、(46.08±0.72)%和(51.87±1.60)%,总体比较差异有统计学意义(F
=741.66,P
<0.05);其中ILK-siRNA-AAV组和MMC组阳性染色百分比明显低于空白对照组,ILK-siRNA-AAV组阳性染色百分比明显低于NC-siRNA-AAV组,差异均有统计学意义(均P
<0.05)(图6B)。3 讨论
ILK是普遍存在于细胞中的丝/苏氨酸激酶,也是整合素信号通路的关键激酶。以往关于ILK在纤维化及瘢痕形成过程中的作用研究主要集中在肾脏和肝脏纤维化。研究发现,在肾脏纤维化过程中,ILK参与调节TGF-β1诱导的上皮间质转分化(epithelial-mesenchymal transition,EMT)过程,并诱导分泌基质金属蛋白酶。ILK可调节EMT过程的初始和关键步骤,在肝脏纤维化研究中,ILK调节肝星状细胞活化并转化为肌成纤维细胞。同时ILK是肝细胞在体内和体外生存的必要条件。已有的很多研究也证实了ILK沉默的可行性,在一项抗腹膜纤维化研究中,siRNA特异性沉默腹膜上皮细胞ILK表达,结果显示波形蛋白表达减少、E-钙黏蛋白表达增多,EMT过程被抑制。ILK沉默不仅可有效抑制TGF-β1诱导的EMT过程,而且可以抑制肿瘤细胞的增生和侵袭。在眼科疾病中,晶状体上皮细胞的增生和转分化均与ILK活化有关。ILK缺乏成纤维细胞表现为肌动蛋白细胞骨架异常,不能形成成熟的黏着斑及张力纤维,最终表现为细胞外基质不能收缩。因此,在青光眼滤过术后,ILK对抗纤维化反应和瘢痕形成研究尤为重要。本研究构建了针对ILK的特异性AAV,于术后滤过泡内注射,采用Western blot法检测ILK蛋白的相对表达量,结果显示ILK-siRNA-AAV转染可显著抑制活体内结膜及结膜下组织ILK蛋白表达;同时本研究对ILK抑制效应后大鼠眼压及滤过泡形态变化进行了动态观察,结果提示抑制ILK
基因表达可维持大鼠青光眼滤过术后低水平眼压,延长滤过泡生存时间。AAV是细小病毒科中的一类非致病性病毒,可作为有效基因治疗的载体工具。大量研究表明,AAV是一种相对稳定的病毒载体,对温度和pH值的可耐受范围较宽。AAV这种稳定的特性,使其有多种给药方式,可以做到特异性给药。同时,AAV具有安全性高、免疫源性低、宿主范围广及介导基因长期稳定表达、物理性质稳定的特点。因此,本实验选择AAV作为siRNA载体,结果表明,ILK-siRNA-AAV可有效抑制滤过术区组织中ILK的表达。抗代谢药物MMC是目前临床上常用的抗青光眼术后瘢痕形成药物,使用方法通常为术中使用浸有0.2~0.4 mg/ml MMC的棉片放置于结膜瓣下巩膜表面2~5 min。MMC在抗瘢痕形成的同时,可引起巨大或薄壁滤过泡、角结膜上皮溃疡、角膜内皮毒性、低眼压、滤过泡渗漏和眼内炎等并发症。有研究表明,MMC并非仅抑制HTFs增生,而是直接使细胞凋亡及坏死,过早地抑制了伤口愈合过程。本研究建立了大鼠球结膜滤过泡模型,为了探讨ILK沉默对滤过术后伤口愈合的影响,选用临床常用且研究较多的MMC作为对照组,以便更加客观地对比ILK沉默在此过程中的作用。
本实验实际操作中采用了麻醉大鼠后统一测量眼压,确保多只大鼠在一致状态下测量。与人类相同,大鼠眼压会有昼夜节律影响,因此本实验选择每日同一时间测定眼压。由于麻醉会使大鼠眼压下降,麻醉程度和时间均会对眼压产生影响,因此本研究在每次测量时根据大鼠体质量精准计算麻醉药物使用量,并于麻醉时间相同的情况下测量,同时测定大鼠对侧非手术眼眼压作为对照,以排除干扰因素的影响。本研究中测得对照组麻醉状态下的大鼠眼压与Morrison等使用TonoLab眼压计测得的麻醉状态下大鼠眼压基本相近。且本实验结果显示,大鼠抗青光眼术后第1天眼压比术前降低约30%,滤过泡弥散隆起,未见严重并发症发生,说明滤过手术成功。术后第7天滤过泡即扁平,眼压也恢复至术前水平,滤过功能丧失,说明大鼠组织创伤愈合能力较人类强。
结缔组织中包括胶原纤维、弹性纤维和网状纤维。胶原纤维在结缔组织分布广泛。胶原纤维和网状纤维的基本构造相似,均以胶原单位(蛋白质为主的大分子)为基本单位,主要由成纤维细胞合成。胶原纤维在苏木精-伊红染色中为红色,不能与肌纤维分别,而Masson三色染色为结缔组织染色方法之一,可将胶原纤维和肌纤维明显地区分开来;细胞质和肌肉呈红色,胶原纤维呈蓝色,细胞核呈蓝黑色。本研究采用Masson三色染色观察胶原纤维沉积情况,证实了抑制大鼠球结膜滤过泡组织中ILK表达可抑制纤维结缔组织增生,减少胶原纤维沉积。
综上所述,本研究建立了大鼠球结膜滤过泡模型,发现大鼠青光眼滤过术后瘢痕化反应强,而转染特异性ILK-siRNA-AAV抑制术区ILK表达后,可使大鼠青光眼滤过术后眼压维持在低水平,延长滤过泡生存时间,并提高滤过泡生存率。抑制ILK
基因表达可减弱大鼠青光眼滤过术后瘢痕形成反应,减少术区纤维细胞增生和胶原沉积,起到抗瘢痕形成作用。利益冲突
所有作者均声明不存在任何利益冲突作者贡献声明
崔丽珺:实验设计、项目管理与指导、数据分析、论文审核和修改;邢瑶:实验设计、实施研究、数据分析、论文撰写及修改;王建明、范雅稚:参与实验设计、论文审阅与修订;熊蕾、王文菁:参与实验设计、数据整理与管理