经导管主动脉瓣置换术与外科主动脉瓣置换术在中低危重度主动脉瓣狭窄患者中疗效的Meta 分析
2022-05-10方震纪军张晶何胜虎
方震,纪军,张晶,何胜虎
经导管主动脉瓣置换术(TAVR)是20 年前开始兴起的治疗重度主动脉瓣狭窄的有效方法,其安全性好且创伤小,逐渐成为目前临床上一线治疗方法[1]。但TAVR 还面临着能否进一步扩大适应证、解决生物瓣的耐久性、如何进一步减少并发症等问题的挑战[2-3]。我国TAVR 技术起步较慢,自2010 年葛均波院士团队完成首例,最近5 年手术量呈现快速增长的态势[4-5],个别中心甚至尝试局麻下行极简式TAVR[6],这使得TAVR 未来必将应用更为广泛。目前公布的关于TAVR 的大规模临床研究都在国外,国内尚缺乏高质量的研究。从PARTNER 2 研究及SURTAVI 研究数据来看,对于外科手术高危的重度主动脉瓣狭窄患者,由于TAVR 后不良心血管事件的发生率与外科瓣膜置换手术(SAVR)相比无显著差异,故得到欧美瓣膜病管理指南的推荐[7-8]。近年来新的研究结果逐渐拓展了TAVR 的手术适应证,如PARTNER 3 研究的主要对象是外科低危的症状性重度主动脉狭窄患者,而Evolut Low Risk 研究的主要对象是外科手术30 d 内死亡率较低的低危重度主动脉瓣狭窄患者,这两项研究结果提示TAVR 组术后复合终点事件发生率不高于甚至低于SAVR 组,这也导致欧美指南许可了在外科手术低危患者中使用SAPIEN 3 及Evolut R 两种人工瓣膜行TAVR[9-10]。Hofer 等[11]对4 项随机对照研究进行Meta 分析表明,在外科低危重度主动脉瓣狭窄患者中,TAVR与SAVR 在多个结局的比较上具备优势,但该研究并未纳入外科中危的患者,故对于包括外科中危在内的非高危重度主动脉瓣狭窄患者,TAVR 能否替代SAVR 还存在争议。目前PARTNER 3 研究已更新了2 年随访结果。本研究拟通过检索国内外主要数据库对最新研究进行Meta 分析,纳入更大样本量,评估TAVR 较SAVR 在减少术后主要终点事件及长期手术并发症方面有无优势。
1 资料与方法
1.1 文献纳入标准
纳入标准:(1)研究对象:超声心动图符合重度主动脉瓣狭窄的标准,根据美国胸外科医师协会(STS)评分或欧洲心脏手术风险评估系统(EuroSCORE)评分为中危或低危患者;(2)研究类型:随机对照研究或观察性队列研究;(3)干预措施:TAVR 及SAVR;(4)终点事件或结局:包含全因死亡、心血管死亡、致残性脑卒中、再住院等临床事件。排除标准:(1)综述、Meta 分析、述评、学位论文、学术会议摘要、病例报道;(2)缺少对照,单纯的观察性研究;(3)随访时间<1 年;(4)样本量小于100 例;(5)各种原因引起的试验中止;(6)非英文文献。
1.2 文献筛选
本研究遵守Meta 分析的标准研究规范,从PubMed、Embase、Cochrane 图书馆上通过关键词“transcatheter aortic valve replacement”、“transcatheter aortic valve implantation”、“low risk”、“intermediate risk”检索最近10 年的文献,通过检索标题、摘要、全文逐步排除。检索万方数据库、中国知网等中文数据未发现大样本的临床研究。同时阅读纳入文献的参考文献部分。两位作者独立检索文章,意见不统一时由第三位作者评估是否纳入。纳入研究的主要复合终点事件包括全因死亡、致残性脑卒中等。其他如心血管死亡、因心脏瓣膜病再住院、心肌梗死、需永久起搏器植入、需再次介入治疗均单独分析。同时根据瓣膜类型(自膨胀式或球囊扩张式)的不同进行亚组分析,分析异质性来源。
1.3 统计学方法
数据分析采用Revman 5.3 分析软件。所有事件的具体数据均直接来源于原始文献,部分数据通过原文中百分比换算。RR 及95%CI 用来评估TAVR相对SAVR 发生某事件的风险。I2检验用来评估不同研究之间的异质性,I2<25%被认为异质性小,采用固定效应模型分析;25%≤I2≤50%被认为中等异质性,I2>50%被认为异质性较大,均采用随机效应模型分析,并用敏感性分析或亚组分析寻找异质性来源。P<0.05 为差异有统计学意义。
2 结果
2.1 纳入文献情况
通过检索各数据库,共纳入临床研究58 项,经过筛选最后纳入6 项研究进行分析,其中包括5项随机对照研究和1 项观察性队列研究(图1),研究样本绝大多数来源于欧美人群(表1)。6 项研究总共纳入6 891 例中低危重度主动脉瓣狭窄患者,其中TAVR 组3 490 例,SAVR 组3 401 例。其中NOTION、SURTAVI、Evolut Low Risk、SURTAVRCAS 四项研究中使用自膨胀式瓣膜[10,12-14],而PARTNER 2、PARTNER 3 两项研究中使用球囊扩张式瓣膜[15-16]。STACCATO 研究因过多临床不良事件而提前终止[17],故未纳入。
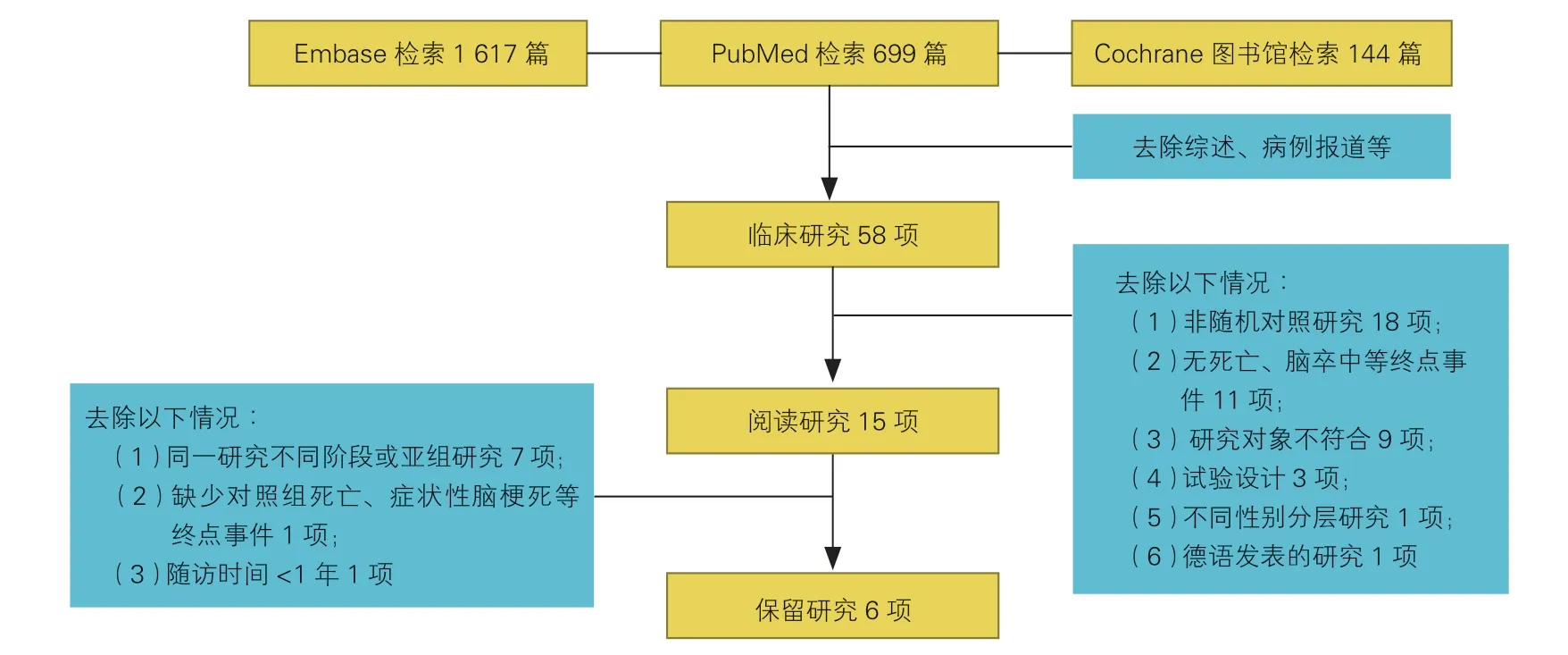
图1 文献筛选流程图

表1 纳入研究的基本信息
2.2 TAVR 组和SAVR 组随访1 年及以上复合终点事件比较(图2)

图2 TAVR 组和SAVR 组随访1 年及以上复合终点事件比较
6 项研究中,TAVR 组与SAVR 组随访1 年及以上复合终点事件(全因死亡及致残性脑卒中)的发生率差异无统计学意义(20.7% vs.20.5%,RR=0.82,95%CI:0.63~1.08,P=0.16)。结果显示异质性较大(I2=80%),但亚组分析结果显示,无论使用自膨胀式还是球囊扩张式生物瓣膜,TAVR 组与SAVR组在复合终点事件方面差异无统计学意义(自膨胀式:10.6% vs.11.9%,RR=0.75,95%CI:0.52~1.08,P=0.12;球囊扩张式:34.0% vs.31.6%,RR=0.91,95%CI:0.52~1.60,P=0.74)。敏感性分析提示,当去除Yakubov 等[14]的观察性研究后,在使用自膨胀式人工瓣膜亚组中异质性缩小(I2=21%),且研究指标稳定,不改变结果的趋势(RR=0.89,95%CI:0.70~1.14,P=0.36)。
2.3 TAVR 组和SAVR 组随访1 年及以上死亡及再住院情况的比较(表2)
6项研究中,TAVR组与SAVR 组相比,术后≥1 年全因死亡率(16.6% vs.15.6%,RR=0.95,95%CI:0.75~1.20,P=0.67)、心血管死亡率(9.9% vs.10.2%,RR=0.83,95%CI:0.62~1.12,P=0.23)差异均无统计学意义。亚组分析结果显示无论用自膨胀式还是球囊扩张式生物瓣膜,两组的全因死亡率与心血管死亡率差异均无统计学意义(P均>0.05)。
在再住院情况方面,共对5 项研究6 615 例患者进行了分析,其中TAVR组(n=3 348)例与SAVR组(n=3 267)相比,术后1 年及以上的再住院率差异无统计学意义(12.9% vs.12.3%,RR=0.94,95%CI:0.65~1.36,P=0.73)。亚组分析结果显示无论使用自膨胀式还是球囊扩张式生物瓣膜,TAVR 组和SAVR组在再住院方面差异均无统计学意义(P均>0.05),但异质性仍较大。敏感性分析提示,在去除Popma等[10]的研究后,异质性缩小,且不改变结果的趋势(RR=1.27,95%CI:0.94~1.72,P=0.12)。
2.4 TAVR 组和SAVR 组随访1 年及以上致残性脑卒中及新发心房颤动发生情况的比较(表2)

表2 TAVR 组和SAVR 组随访1 年及以上各项不良结局的效应分析及亚组分析
6 项研究中,TAVR 组与SAVR 组相比,术后1 年及以上的致残性脑卒中发生率差异无统计意义(3.5% vs.4.3%,RR=0.65,95%CI:0.41~1.04,P=0.07)。亚组分析结果显示,使用自膨胀式生物瓣膜,TAVR 组较SAVR 组致残性脑卒中发生率更低(1.8% vs.3.5%,RR=0.51,95%CI:0.34~0.76,P<0.01);使用球囊扩张式生物瓣膜,TAVR 组与SAVR 组相比差异无统计学意义(5.8% vs.5.4%,RR=1.09,95%CI:0.82~1.47,P=0.55)。
对5 项研究5 941 例患者进行的分析显示,TAVR组(n=2 994)与SAVR组(n=2 947)相比,术后1 年及以上的新发心房颤动发生率较低(13.3%vs.37.4%,RR=0.39,95%CI:0.30~0.50,P<0.01)。亚组分析显示无论使用自膨胀式还是球囊扩张式生物瓣膜,TAVR 组术后1 年及以上新发心房颤动发生率均低于SAVR组(自膨胀式:12.9% vs.42.4%,RR=0.32,95%CI:0.26~0.39,P<0.01;球囊扩张式:13.9% vs.28.5%,RR=0.49,95%CI:0.41~0.59,P<0.01)。当去除Yakubov 等[14]的观察性研究后,在使用自膨胀式人工瓣膜亚组中异质性缩小(I2=43%),且不改变结果的趋势(RR=0.30,95%CI:0.25~0.36,P<0.01)。
2.5 TAVR 组和SAVR 组随访1 年及以上再次手术率及需永久起搏器植入情况的比较(表2)
在再手术方面,共对其中4 项研究5 665 例患者进行了分析。TAVR组(n=2 852 )与SAVR组(n=2 813 )相比,术后1 年及以上的再次手术率较高(1.8% vs.0.6%,RR=2.97,95%CI:1.72~5.12,P<0.01)。亚组分析显示无论使用自膨胀式还是球囊扩张式生物瓣膜,TAVR 组的术后1 年及以上再手术率均高于SAVR组(自膨胀式:1.7% vs.0.6%,RR=2.67,95%CI:1.35~5.30,P<0.01;球囊扩张式:2.1% vs.0.6%,RR=3.53,95%CI:1.43~8.72,P<0.01)。
在永久起搏器植入方面,对其中5 项研究5 941 例患者进行了分析,其中TAVR组(n=2 994)与SAVR组(n=2 947)相比,术后1 年及以上需行永久起搏器植入率高于SAVR组(20.1% vs.8.2%,RR=2.94,95%CI:1.63~5.29,P<0.01)。亚组分析显示使用自膨胀式生物瓣膜,TAVR 组的术后1年及以上需要行永久起搏器植入率均高于SAVR组(23.4% vs.6.7%,RR=3.53,95%CI:2.34~5.33,P<0.01);使用球囊扩张式生物瓣膜,TAVR 组和SAVR 组差异无统计学意义(13.6% vs.11.1%,RR=1.23,95%CI:0.98~1.56,P=0.08)。
2.6 TAVR 组和SAVR 组随访1 年及以上心肌梗死发生情况比较(表2)
在术后心肌梗死方面,对其中5 项研究5 941例患者进行了分析,其中TAVR组(n=2 994)与SAVR组(n=2 947)相比,术后1 年及以上心肌梗死发生率差异无统计学意义(4.3% vs.3.4%,RR=1.27,95%CI:0.99~1.63,P=0.06)。异质性检验提示各研究间异质性小(I2=0%)。亚组分析显示,无论使用自膨胀式还是球囊扩张式生物瓣膜,TAVR 组和SAVR 组在术后1 年及以上心肌梗死发生率差异均无统计学意义(自膨胀式:2.3% vs.2.0%,RR=1.12,95%CI:0.73~1.70,P=0.61;球囊扩张式:8.3% vs.6.1%,RR=1.37,95%CI:1.00~1.88,P=0.05)。
3 讨论
近年来无论欧美瓣膜病管理指南还是我国专家共识都将TAVR 的适应证逐渐拓宽,强调根据患者年龄、预期寿命、自身解剖特点、人工瓣膜耐久性等方面进行个体化评估而不是以外科风险作为选择TAVR或SAVR 的绝对依据[5,18-19]。在我国愿意接受外科手术的患者比例偏低,且大多数患者惧怕外科手术创伤,内科介入治疗必将会有更广泛的应用前景,但考虑到目前国内手术数量有限,还缺乏大规模中国人群的临床研究,目前仅有回顾性研究[20],今后会有更多的证据来支持TAVR 在中低风险患者中的应用。
从本研究分析的各项临床事件和术后并发症来看,在术后1 年以上死亡率和心血管死亡这一硬终点上,TAVR 在外科中低风险患者中的应用效果基本与SAVR 相当。此外,选择TAVR 替代SAVR 在外科中低风险患者中的应用,不会增加致残性脑卒中的风险,甚至使用自膨胀式的TAVR 瓣膜可以降低致残性脑卒中的风险。而且TAVR 后心房颤动的发生风险也低于SAVR 组,也是降低脑卒中风险的主要因素。TAVR 后脑卒中的主要可能是术后瓣膜上沉积的钙化物质脱落导致脑栓塞所致[5],临床术后MRI 数据显示高达80%~90% TAVR 后患者都有缺血性脑损伤[21],但症状性脑损伤比例较低,且轻微的脑损伤一般危害不大。术后早期可能会导致5.4%~26.5%的患者出现认知功能障碍[22],但术后3~6 个月后部分患者认知功能障碍会有所缓解[23-25],而本研究中1 年以后发生严重致残性脑卒中的比例为3.4%,故总体上TAVR 术后脑缺血的风险还是能被接受的。TAVR 相关脑卒中的危险因素除患者自身因素以外主要受到手术操作因素影响,具体体现在球囊预扩张、瓣膜输送、快速起搏、瓣膜回收这些手术过程[26]。故术者的熟练程度也关系到TAVR 相关脑卒中的发生。另外脑卒中高危患者可以选用脑保护装置来进一步降低风险。TAVR 后出现传导阻滞甚至需要植入永久起搏器是常见的并发症[5],尽管目前瓣膜产品已经更新换代,但最新一代的瓣膜结构及材料的改良依然未降低传导阻滞的风险[27]。在本研究中,接受TAVR 治疗的患者1 年以后需要植入永久起搏器的比例达到20.7%,远远高于接受SAVR 的患者(8.2%)。这主要与主动脉瓣与传导系统的解剖结构毗邻有关,His 束穿行与室间隔膜部,紧邻主动脉瓣,左束支邻近于右冠瓣和无冠瓣之间的三角区域更易受到影响。患者自身的危险因素包括合并有右束支传导阻滞、冠状动脉旁路移植术后、糖尿病等,而手术操作过程的机械损伤造成局部炎症水肿及瓣膜型号过大、释放过深也是导致术后传导阻滞的重要原因[28-29]。TAVR 术后发生传导阻滞的数据主要源于国外人群及进口瓣膜,目前还缺乏基于国产瓣膜和中国人群的研究数据,希望国内类似的研究也能尽快开展。不管怎样,TAVR 术后传导阻滞甚至需要植入永久起搏器是阻碍其在外科中低危患者中广泛应用的重要障碍,其发生机制和对策还需进一步探索。TAVR 术后需要再次手术的风险高于SAVR 术后,主要与人工瓣膜出现衰败导致严重再狭窄或者反流有关。不过TAVR 术后再次手术可选择行瓣中瓣手术,而SAVR 术后出现二次手术则多由于感染性心内膜炎往往需要开胸,死亡率高[15]。且本研究显示,TAVR 术后二次手术总体发生的比例很低(1.8%),故不会对TAVR 在中低危患者中的应用产生太多负面作用。
本研究存在一定的局限性:纳入研究并非都是随机对照研究,各研究的复合终点事件不完全一致,纳入研究来源于国外,尚缺乏基于中国人群的数据,纳入研究中使用早期瓣膜产品,不能完全反映临床中的真实情况。随着人工瓣膜工艺及术者操作技术的提升,期待今后的临床研究提供更有利的证据。
本项Meta 分析证实,TAVR 在外科中低危重度主动脉瓣狭窄患者中的远期治疗效果与SAVR 相当,不会增加患者的全因死亡、心血管死亡、再住院、心肌梗死发生风险,而且可以减少术后心房颤动的发生,在减少致残性脑卒中方面自膨胀式TAVR瓣膜更具优势。TAVR 术后二次手术的风险虽高于SAVR,但总体发生率低且二次介入手术安全性高,但TAVR 术后传导阻滞导致的永久起搏器植入风险较高,是影响TAVR 未来在中低危重度主动脉瓣狭窄患者应用的主要因素,亟需改进。
利益冲突:所有作者均声明不存在利益冲突
