电针“百会”“涌泉”对6月龄APP/PS1双转基因小鼠行为学及海马Dynein、CTSD水平影响的研究
2022-05-10谭韵湘高誉珊杨晓坤栗晨璐薛卫国
张 洋,谭韵湘,高誉珊,杨晓坤,栗晨璐,薛卫国
(北京中医药大学,北京 100029)
阿尔茨海默病(Alzheimer’s disease,AD)是一种原因不明并且起病隐匿的渐进性中枢神经系统退行性疾病,以记忆力和认知能力障碍为主要临床表现。细胞外β-淀粉样蛋白(β-Amyloid,Aβ)沉积所形成的老年斑(Senile plaques,SP)以及细胞内的神经原纤维缠结是其两大主要的病理特征。Aβ级联假说认为Aβ处于AD发病的核心位置,Aβ产生或者清除失衡会造成大量Aβ堆积,产生神经毒性、诱导神经系统炎症反应以及导致神经元凋亡等一系列的AD病理特征[1-2]。神经元内Aβ一直是AD发病机制及治疗的热点,目前认为神经元内Aβ可能是造成突触功能及认知功能损害的主要原因[3-4]。有研究发现,细胞内内体-自噬溶酶体途径同时是重要的Aβ产生及清除途径。细胞内Aβ被自噬囊泡包裹形成自噬小体,由线粒体提供能量,动力蛋白(Dynein)将其逆向转运至胞体,然后与溶酶体结合形成自噬溶酶体,在溶酶体各种蛋白水解酶的作用下降解。Nixon等[5]研究发现神经营养不良性突起及神经元内存在大量自噬体和自噬溶酶体,说明AD患者自噬功能障碍,Aβ逆向转运和降解受阻,同时自噬体、自噬溶酶体的大量存在导致细胞内Aβ大量产生及细胞外分泌。本课题组前期研究发现,针刺干预可以降低APP/PS1双转基因小鼠海马Aβ水平[6-9],改善小鼠空间学习和记忆能力,其机制可能是通过自噬溶酶体途径[10-13]。但是针刺降低小鼠海马Aβ水平相关机制并不明确。本实验选取AD病理初期的6月龄APP/PS1双转基因小鼠作为动物模型,针刺“百会”“涌泉”二穴,观察研究逆向转运动力蛋白Dynein和自噬溶酶体的降解相关蛋白组织蛋白酶D(Cathepsin D, CTSD)变化水平以及电针对其表达水平的影响,旨在阐明针刺是否通过调节机体的自噬水平而改善AD患者的学习和记忆能力,以期为临床电针治疗AD患者提供理论依据。
1 材料与方法
1.1 动物模型与分组
1.1.1 实验动物 6月龄健康SPF级雄性APP/PS1双转基因小鼠20只,购于北京华阜康生物科技股份有限公司[动物许可证号:SCXK(京)2019-0008];同月龄雄性健康野生型C57BL/6小鼠10只,购于斯贝福(北京)生物技术有限公司[动物许可证号:SCXK(京)2019-0010]。小鼠均饲养在北京中医药大学动物中心,采用自然节律光照,自由进食、饮水,温度(23±1)℃,湿度40%~70%。本实验经北京中医药大学实验动物伦理委员会批准。
1.1.2 实验分组 转基因小鼠满6月龄时称重排序,体质量约为(28.10±1.58)g,利用随机数法将转基因小鼠分为模型组(M)和电针组(E),10 只/组,野生C57BL/6小鼠10只为空白对照组(C),体质量约为(29.05±2.27)g。
1.2 干预方法
1.2.1 电针组 将小鼠用自制鼠袋俯卧位固定于实验操作台上,“百会”“涌泉”二穴参照第9版《实验针灸学》及比较解剖学取穴定位。75%酒精常规消毒后,针刺深度为2~3 mm,“百会”穴行手针平刺留针,双“涌泉”穴直刺后接入韩式电针仪,采用疏密波,频率1/50 Hz,强度1 mA,以小鼠保持安静不挣扎嘶叫为度。留针15 min/次,隔日1次。共治疗6周。
1.2.2 模型组、空白对照组 以相同方法固定于实验操作台上,15 min/次,隔日1次,共束缚6周。
1.3 主要试剂与仪器
1.3.1 试剂 兔源Dynein抗体(美国,Abcam,ab171964);兔源Cathepsin D抗体(美国,Abcam,ab75852);Aβ(4G8)(美国,Biolegend,800701);鼠源GAPDH(proteintech,60004-1);鼠源辣根过氧化物标记生物素(北京中杉金桥,ZB-2305);羊源辣根过氧化物标记生物素(proteintech,SA00001-2);山羊抗小鼠荧光二抗(美国,Abcam,ab150115);山羊抗兔荧光二抗(美国,Abcam,ab150077);BCA蛋白定量试剂盒(北京普利莱有限公司)。
1.3.2 仪器 一次性针灸针(北京中研太和医药公司,0.25 mm×13 mm);LH202H型韩氏电针仪(北京华卫产业开发公司);冰冻切片机(德国,Leica);酶标仪(美国,Bio-Rad);电泳仪、垂直电泳槽、转膜仪(美国,Bio-Rad);曝光机(美国,Bio-Rad)。
1.4 观察指标及取材、检测方法
1.4.1 Morris水迷宫检测小鼠空间学习记忆能力 各组小鼠干预6周后进行Morris水迷宫行为学检测。Morris水迷宫为一圆形水池,池壁内有不同几何图形,分为4个不同象限,平台置于第3象限中央,水温在22 ℃左右,接入图像采集系统记录小鼠到达平台时间和游泳路径。实验前1 d小鼠进行适应性训练。
1.4.1.1 定位航行实验 注水高于平台1 cm,并倒入奶粉隐藏平台,于1、2、4象限水池中点随机面壁放入小鼠,若小鼠在60 s内找到并爬上平台,记录其实际时间并在平台上停留15 s;若小鼠60 s内未找到平台,引导小鼠至平台上,并停留15 s,记录小鼠找到平台时间为60 s。每天训练3次,每次间隔20 min,连续训练4 d,记录逃避潜伏期及游泳轨迹。
1.4.1.2 空间探索实验 实验第5天,撤掉平台,第1象限中点面壁放入小鼠,记录60 s内小鼠穿越原平台次数以及在第3象限游泳路程。
1.4.2 取材方法 小鼠满8月龄时取材,用10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉。两只小鼠用2%多聚甲醛+2.5%戊二醛心脏灌注后断头取脑,并置于2%多聚甲醛+2.5%戊二醛溶液中,4 ℃固定48 h,用于透射电镜观察。3只小鼠用4%多聚甲醛心脏灌注后断头取脑,4%多聚甲醛4 ℃固定72 h,梯度蔗糖脱水,OCT包埋,冠状位冰冻切片,厚度为10 μm,-20 ℃冰箱保存,用于免疫荧光实验。剩余5只小鼠断头取脑后,于冰上剥离小鼠海马组织并迅速置于冻存管中,-80 ℃冰箱保存,用于Western blot检测。
1.4.3 透射电镜观察海马中自噬体、自噬溶酶体情况 取海马CA1区大小约1 mm×1 mm×1 mm的组织块,梯度丙酮脱水,纯树脂包埋,切片,2%醋酸双氧铀染色,2%柠檬酸铅染色5~6 min,蒸馏水洗净;H-7560型透射电镜观察自噬体及自噬溶酶体情况并拍照。
1.4.4 海马Aβ及CTSD免疫荧光双标 取出冰冻切片,室温复温30 min;PBS冲洗;枸橼酸盐缓冲液热修复15 min;PBS冲洗;山羊血清室温封闭10 min;甩掉山羊血清封闭液,加入一抗(CTSD和4G8抗体等体积混匀),4 ℃孵育过夜;次日,PBS冲洗;加入荧光二抗,室温避光孵育1 h;PBS冲洗;DAPI封片。激光共聚焦显微镜下观察拍照。
1.4.5 Western blot检测小鼠海马CTSD与Dynein蛋白的相对表达量 称取小鼠海马组织,加入RIPA 裂解液和PMSF(RIPA:PMSF=100∶1),于冰上用超声仪充分研磨,4 ℃,12 000 r/min,离心20 min,提取上清液,BCA法测定蛋白浓度。加入上样Buffer,95 ℃加热5 min,每孔上样量为2.5 μL,SDS-PAGE分离电泳完成后,转膜至0.45 μM PVDF膜,5%脱脂奶粉室温封闭2 h,TBST清洗,裁膜,加入一抗(CTSD,1∶10 000;DIC,1∶2 000;GAPDH,1∶50 000),4 ℃孵育过夜,TBST清洗,加入二抗(山羊抗兔HRP-IgG,1∶5 000;山羊抗鼠HRP-IgG,1∶50 000),室温下置于摇床孵育1 h,TBST清洗后滴加ECL发光液显色,曝光,显影。用Image J软件分析各个条带的灰度值,以GAPDH的灰度值为基准线计算出各目标条带的相对表达量。
1.5 统计学处理
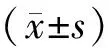
2 结果
2.1 各组小鼠Morris水迷宫空间学习记忆能力比较
采用Morris水迷宫实验检测小鼠空间学习记忆能力,各组小鼠的空间学习记忆能力代表性路线轨迹图如图1所示。在定位航行实验中,与空白对照组小鼠比较,模型组小鼠平均逃避潜伏期增加,差异有统计学意义(P<0.05);与模型组小鼠比较,电针组小鼠平均逃避潜伏期减少,差异有统计学意义(P<0.05)。如图2、表1所示。在空间探索实验中,与空白对照组比较,模型组小鼠平均穿越平台次数及平台象限游泳路程减少,差异均有统计学意义(P<0.05);与模型组小鼠比较,电针组小鼠平均穿越平台次数及平台象限游泳路程增加,差异均有统计学意义(P<0.05)。如表2所示。
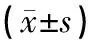
表1 各组小鼠Morris水迷宫定位航行实验逃避潜伏期时间比较
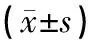
表2 各组小鼠Morris水迷宫空间探索实验穿越平台次数、平台象限游泳路程比较
2.2 各组小鼠海马自噬体、自噬溶酶体比较
采用透射电镜观察各组小鼠海马自噬体、自噬溶酶体情况,如图3所示:空白对照组小鼠海马中可观察到少量的自噬溶酶体,未观察到明显营养不良性突起(图A、B);模型组APP/PS1双转基因小鼠海马中有大量的自噬体堆积,主要是在神经元轴突末端(营养不良性突起)(图D),胞浆内可见许多自噬溶酶体(图C);电针组小鼠海马神经元轴突中也可以观察到部分自噬体堆积,但明显少于模型组(图F),胞体核周可见部分自噬溶酶体(图E)。
2.3 CTSD和Aβ在小鼠海马的免疫荧光共表达比较
自噬作为Aβ的一种重要降解方式,自噬泡包裹Aβ形成的自噬体,只有与溶酶体结合之后形成自噬溶酶体,在溶酶体中各种蛋白酶的作用下,才能发挥其生物学功能。CTSD作为溶酶体中一种重要的蛋白水解酶,在Aβ的降解中发挥着重要的作用。为了进一步说明CTSD和Aβ的相关情况,笔者标记了二者在海马中共表达情况,如图4所示。CTSD为绿色荧光标记,主要在核周(胞质)中表达;Aβ为红色荧光标记,表达位置并不局限于核周(胞质),并且二者存在共表达关系,说明被转运至溶酶体的Aβ,可能是通过CTSD进行降解。
2.4 各组小鼠海马逆行轴突转运动力蛋白中间链(DIC)及CTSD表达量比较
在神经元自噬过程中,轴突末端形成的自噬体在动力蛋白的协助下沿微管逆行转运至胞体,然后与溶酶体结合形成自噬溶酶体,在溶酶体中各种水解酶的作用下发生降解。可见动力蛋白和组织蛋白酶(组织蛋白酶D)在神经元自噬过程中发挥着重要的作用。所以检测了动力蛋白中间链(DIC)和CTSD(组织蛋白酶D)的表达水平,以反映自噬流的运输及降解状态,见图5。Western Blot检测显示:与空白对照组比较,模型组DIC表达量降低,CTSD表达量增加,差异均有统计学意义(P<0.05);与模型组比较,电针组DIC表达量增加,CTSD表达量降低,差异均有统计学意义(P<0.05)。见表3。
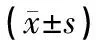
表3 各组小鼠海马DIC和CTSD相对表达量比较
3 讨论
作为AD的典型病理特征之一,老年斑由脑神经细胞外的β淀粉样蛋白沉积所形成。Aβ级联假说认为Aβ在AD的致病级联反应中处于核心位置,机体生成的Aβ如果不能及时有效地清除,具有神经毒性作用的Aβ就可能造成神经元及突触损伤,从而造成AD患者认知功能障碍。APP/PS1双转基因小鼠脑内Aβ生成、聚集以及认知功能障碍,能在一定程度上模拟AD患者的病理发展过程,是目前国际上较为公认的研究Aβ水平变化及机制的有效AD评价模型[14]。6月龄APP/PS1双转基因小鼠脑内已出现老年斑,并出现自噬溶酶体功能紊乱,所以本实验采用6月龄APP/PS1双转基因小鼠为研究对象,从自噬溶酶体途径角度探讨电针降低AD患者脑内Aβ水平的可能机制。
自噬通常被认为是机体的一种自我保护机制,自噬可以清除机体错误的蛋白质,维持神经元细胞结构的内稳态[15]。在AD患者脑中,自噬可以清除机体产生过多的Aβ,但同时自噬可能是一把双刃剑[16]。在AD早期,自噬功能的增强会加快Aβ的清除,防止其毒性作用,保护神经元,但随着毒性蛋白的不断增加,机体自噬溶酶体系统被破坏,增强机体自噬功能不但不能加快Aβ清除,反而可能会产生更多的Aβ,促使神经元变性。自噬溶酶体途径又称为自噬流,包括自噬启动、自噬形成、自噬体溶酶体融合以及蛋白质降解4个阶段,其中任何一个阶段出现问题都会使Aβ不能被有效地清除,造成Aβ的堆积。神经元突起中存在驱动蛋白(kinesin)介导的顺向运输以及动力蛋白(Dynein)介导的逆向运输,并且动力蛋白作为自噬体沿微管系统逆向转运至胞体的唯一蛋白,动力蛋白中间链(Dynein intermediate chain, DIC)作为动力蛋白的重要组成部分,参与自噬底物的结合,并且对于自噬体与溶酶体的结合也有着非常重要的作用。有研究发现[17],Aβ参与Dynein竞争性结合,从而减少Dynein与自噬体结合,导致自噬体不能被及时转运至胞体完成降解。与正常人比较,AD患者脑内DIC表达量同样下降[18]。对于AD患者而言,本就不足的Dynein,还有部分自噬体不能与其有效结合,造成神经元突起中大量自噬体堆积。而作为溶酶体中重要水解酶的CTSD,参与机体错误蛋白质的降解,有研究发现,CTSD参与神经元中许多蛋白质(包括APP)降解[19-20],所以对于自噬-溶酶体系统,CTSD同样非常重要。
本实验选取6月龄APP/PS1双转基因小鼠电针干预6周,8月龄时取材。此时,APP/PS1双转基因小鼠脑内已经有大量老年斑,小鼠的空间学习和记忆能力下降,机体的自噬功能处于紊乱状态,造成部分Aβ堆积形成老年斑。Morris水迷宫结果显示模型组小鼠空间学习和记忆能力下降。本研究关注的是细胞内Aβ及自噬转运、降解状态。透射电镜观察到其海马中有大量的自噬体堆积,主要是在神经元轴突末端,以及胞体许多自噬溶酶体堆积,说明双转基因小鼠自噬体逆向转运、自噬体溶酶体融合以及蛋白质降解发生障碍。免疫荧光结果显示CTSD和Aβ在小鼠海马CA1区神经元胞体存在共表达,说明CTSD作为溶酶体中一种重要的水解酶可能参与细胞内Aβ降解;由于自噬是Aβ一种重要的降解途径,被自噬泡包裹的Aβ(突起上)经动力蛋白逆向转运到胞体完成降解。Western Blot结果表明,与空白对照组比较,模型组动力蛋白中间链(DIC)表达量降低,进一步验证了双转基因小鼠自噬体逆向转运障碍的观点;由于过多的自噬体在神经元轴突末端堆积,机体为了加快自噬体的降解而产生更多的组织蛋白酶助其降解,故较空白对照组,模型组CTSD表达量反而增加,形成胞体的许多自噬溶酶体堆积。所以,在AD病理中期,可以通过调节机体紊乱的自噬状态,以达到保护机体治疗AD患者的目的。
针对AD患者“肾气亏虚,痰浊蒙窍”的病机特点,笔者选用“百会”“涌泉”二穴“益肾祛浊,开窍醒神”。Morris水迷宫结果显示,电针组逃避潜伏期和目标象限游泳路程优于模型组,说明电针可有效改善APP/PS1转基因鼠的空间学习记忆能力。电针作为非药物疗法,可能通过调节自噬,降解细胞内代谢产物,防治有害蛋白的体内堆积,保持神经系统的功能。自噬体的运输以及自噬溶酶体的降解作为自噬的重要组成部分,同样也应该受到电针的影响。本实验Western Blot结果表明:双转基因小鼠海马区中Dynein表达量降低,CTSD表达量升高;而电针能升高Dynein水平,降低CTSD表达量,表明针刺“百会”“涌泉”二穴治疗AD的生物学机制可能是提高海马神经元逆向转运能力,平衡溶酶体中CTSD的水平,从而达到调整机体紊乱的自噬状态,降低AD患者脑内Aβ等有害蛋白的堆积,改善其学习和记忆能力,达到预防和治疗AD的目的。但电针调节机体自噬的确切机制尚需要进一步研究,以明确其确切的途径及作用靶点,为临床应用提供基础研究证据。
