远安黄茶啤酒抗氧化物质的分离与鉴定
2022-05-09杨丽霞吴殿辉鲁振东
杨丽霞,吴殿辉,鲁振东,陆 健*
(工业生物技术教育部重点实验室,粮食发酵工艺与技术国家工程实验室,江南大学生物工程学院,江苏 无锡 214122)
啤酒是以麦芽、酒花、水为主要原料,经酵母发酵作用酿制而成的饱含二氧化碳的低乙醇含量酒,被称为“液体面包”,是世界上历史最悠久、普及范围最广的乙醇饮料之一。大量文献报道,啤酒具有抗氧化性,且酚类化合物是啤酒中最主要的内源性抗氧化物质,具有较强的自由基清除能力[1-3]。确定啤酒中酚类物质的含量和组成与内源性抗氧化力之间的关系一直是国内外学者的研究重点。Piazzon等[4]研究表明,不同种类的啤酒之间,总酚含量和各种酚酸含量有较大的差别,丁香酸、芥子酸、咖啡酸和阿魏酸是对啤酒抗氧化力起主要贡献的酚酸。Zhao Haifeng等[5]证实了原儿茶酸、儿茶素、咖啡酸以及丁香酸和5种抗氧化力评价指标之间显著正相关,且酚类物质对啤酒内源性抗氧化力的贡献在60%以上。
另一方面,茶叶作为人类最佳的天然保健饮料,在我国历史上有着源远流长的饮用纪录,且备受人们的青睐。茶叶的抗氧化活性是其功能开发方面的重要内容之一,研究表明茶叶中起抗氧化作用的成分主要有茶多酚及其衍生产物、茶多糖、生物碱、维生素以及微量元素锌、锰、铜和硒等[6-8]。茶多酚是茶叶抗氧化能力的主要影响因素,其中以儿茶素为主体的黄烷醇类占茶多酚总量的60%~80%,包括表儿茶素(epicatechin,EC)、 表没食子儿茶素((-)-epigallocatechin,EGC)、表儿茶素没食子酸酯((-)-epicatechin gallate,ECG)、表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate,EGCG)[9]。罗冬兰等[10]比较了贵州5种茶叶的抗氧化性成分和抗氧化活性,相关性分析表明,茶多酚与抗氧化性指标呈显著正相关(P<0.05)。周金伟等[11]分析了不同类型茶叶体外抗氧化能力,结果也表明抗氧化能力均与茶多酚及儿茶素含量呈显著相关(P<0.05),证实了酚类物质对茶叶抗氧化能力的影响。因此,在啤酒酿造过程中添加茶叶,可以有效浸取茶叶中的酚类物质,提高成品啤酒的抗氧化活性。
目前对啤酒中抗氧化物质的研究,大多是基于文献报道的已知化合物,缺乏对其抗氧化物质确切组成的深入研究。茶叶和啤酒中的抗氧化物质较多,在明确起主要抗氧化作用的化合物方面存在一定的困难。因此,对茶啤酒的单体抗氧化物质进行分离鉴定具有一定的理论指导意义。前期实验通过在啤酒中添加31种不同类型的茶叶,并对成品啤酒的抗氧化活性进行比较,发现远安黄茶啤酒的抗氧化活性最强。因此,本实验以远安黄茶啤酒为研究对象,基于体外抗氧化活性为导向的策略[12],以1,1-二苯基-2-三硝基苯肼自由基清除活性(1,1-diphenyl-2-picrylhydrazyl radical-scavenging activity,DSA)为评价指标,采用溶剂萃取、树脂吸附、半制备高效液相色谱法对啤酒中的抗氧化物质进行分离制备,结合超高效液相色谱-四极杆飞行时间质谱(ultra-high performance liquid chromatography-quadrupoletime-of-flight-mass spectrometry,UPLC-Q-TOF-MS)鉴定,以明确影响远安黄茶啤酒抗氧化活性的关键单体化合物。本研究结果将有助于深入了解茶啤酒抗氧化物质的来源,并促进茶叶加工,对选择性提高茶啤酒抗氧化活性具有借鉴意义。
1 材料与方法
1.1 材料与试剂
远安黄茶为市售茶样,2020年产,于-20 ℃贮藏备用;大孔树脂 西安蓝晓科技新材料股份有限公司;加麦Metcalf 江苏海越麦芽有限公司;澳麦Scope 中粮麦芽有限公司;马格努门啤酒花、卡斯卡特啤酒花 美国雅基玛酒花公司;干酵母S-189弗曼迪斯公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、奎诺二甲基丙烯酸酯(水溶性VE)(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox) 上海麦克林生化科技有限公司;EC、EGC、EGCG、ECG、柯里拉京(corilagin,Cor)、色氨酸(Trp) 美国Sigma公司;甲醇、乙腈均为色谱纯,水为超纯水;其他试剂均为市售分析纯级。
1.2 仪器与设备
YQ-PJ-6B型自动糖化仪 西安轻机所光电公司;WFZ UV-2100紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;IKA RV10旋转蒸发仪 苏州赛恩斯仪器有限公司;SCIENTZ-10N普通型冷冻干燥机宁波新芝超声设备有限公司;1260高效液相色谱仪、1260半制备型高效液相色谱仪 美国Agilent公司;UPLC-Q-TOF-MS仪 美国Waters公司。
1.3 方法
1.3.1 远安黄茶啤酒发酵
称取大麦麦芽粉碎过2 目筛后,以料水比1∶3.5(g/mL)注入纯净的自来水,待液化完全后,置于糖化仪中45 ℃糖化30 min,接着于63 ℃糖化70 min,再于72 ℃条件下糖化,直到碘试无反应为止,最后于78 ℃保持10 min终止反应,糖化结束,过滤。麦汁煮沸60 min,酒花采用两次添加法。煮沸开始10 min后,加0.25‰的马格努门啤酒花;煮沸结束10 min前,加0.15‰的卡斯卡特啤酒花。定型麦汁浓度控制在12 °P。向冷却后的麦汁中接入下面啤酒酵母S189,接种量1‰。添加2 g/L的远安黄茶后,加发酵栓于12 ℃发酵,待日质量损失小于0.2 g时,主发酵完成。于4 ℃贮存7 d。过滤后备用。
1.3.2 DSA测定
参照严敏等[13]的方法,略作修改。
茶啤酒稀释80 倍(蒸馏水稀释)后取2 mL,与2 mL 0.1 mmol/L的DPPH-乙醇溶液加入同一10 mL棕色离心管,摇匀,室温避光静置30 min,以无水乙醇为空白于517 nm测其吸光度,按式(1)计算清除率:
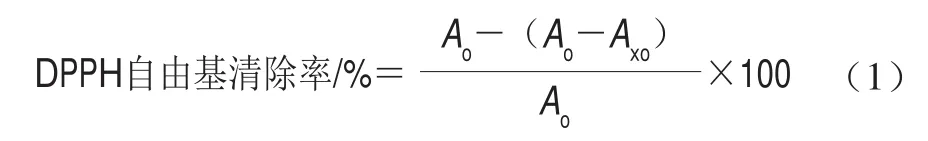
式中:Ao为2.0 mL无水乙醇溶液+2.0 mL DPPH-乙醇溶液的吸光度;Ax为2.0 mL啤酒+2.0 mL DPPH-乙醇溶液的吸光度;Axo为2.0 mL啤酒+2.0 mL无水乙醇溶液的吸光度。
以水溶性VE为标准品,得到标准曲线Y=974.81X-5.694 4,R2=0.999(X为VE浓度,Y为相应的清除率)。啤酒的DSA以Trolox当量计算,单位为mmol/L。
1.3.3 啤酒前处理
取1 L除气啤酒,加入4 倍体积的无水乙醇,于4 ℃静置24 h抽取上清液,将乙醇相(I)和沉淀相(II)在40 ℃真空旋转蒸发,并冷冻干燥48 h,计算各组分得率。冻干组分用100 mL乙醇-水(5∶95,V/V)复溶后,测定DSA。
1.3.4 有机溶剂萃取
乙醇相(I)用乙酸乙酯(3h100 mL)萃取。将合并的乙酸乙酯相(组分I-1)和水相(组分I-2)在40 ℃真空旋转蒸发,去除有机溶剂,并冷冻干燥48 h,计算各组分得率。冻干组分用10 mL体积分数50%乙醇溶液复溶后,测定DSA。
1.3.5 大孔树脂吸附
为提高组分I-2的分离纯化效果,利用大孔树脂进一步分离。通过静态实验,从常用的大孔树脂中选出最佳大孔树脂,然后用不同浓度的乙醇进行洗脱分离。
1.3.5.1 树脂的预处理
使用95%乙醇溶液浸泡大孔树脂24 h后,使用蒸馏水清洗大孔树脂,直至流出液无明显乙醇气味、清澈透明、无浑浊物。再经1 mol/L的HCl和4%的NaOH溶液重复处理2次,以去除树脂在合成过程中的杂质,避免对样品的吸附造成影响,然后用蒸馏水洗至中性备用。
1.3.5.2 树脂的筛选
选取6种不同型号的大孔树脂,根据各种大孔树脂的物理参数和静态吸附实验的比较,选出最适合的大孔树脂来分离纯化啤酒中的抗氧化物质。将预处理好的不同类型的树脂称取3 g,置于锥形瓶中,分别向每个锥形瓶中加入10 mL待吸附液,振荡2 h,使树脂能充分吸附,最后将吸附后的树脂过滤出来,测定其DSA,并按照式(2)计算大孔树脂的吸附率:
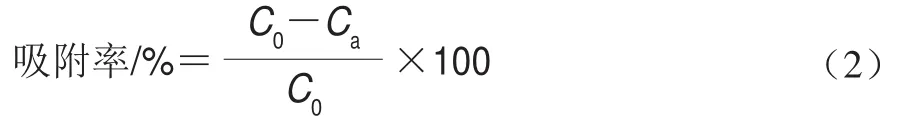
式中:C0为溶液的初始DSA/(mmol/L);Ca为大孔树脂达到吸附平衡时溶液的DSA/(mmol/L)。
在已吸附饱和的树脂中,加入10 mL 95%乙醇溶液,振荡2 h,然后过滤出洗脱液,测定DSA并按式(3)计算大孔树脂解吸率:

式中:Cr为洗脱液的DSA/(mmol/L);V0、Vr分别为上样液和洗脱液的体积/mL。
1.3.5.3 大孔树脂洗脱
通过静态吸附实验筛选出的大孔树脂经预处理后采用湿法装入16 mmh500 mm的层析柱中。将冻干后的I-2组分用蒸馏水分配成质量浓度为14.55 mg/mL的溶液,上样。分别加入体积分数为25%、50%、75%、100%的乙醇溶液,按照3 mL/min的流速洗脱,然后将同一梯度的流出液合并浓缩,最后经过真空干燥得到I-2-1(不保留相)、I-2-2、I-2-3、I-2-4、I-2-5组分,分别溶解于10 mL 50%乙醇溶液中,测定DSA。
1.3.6 半制备液相色谱分离
组分I-1、I-2-2、I-2-3经微孔滤膜(0.45 μm)过滤后,使用半制备液相色谱仪进行分离。Waters 2998紫外检测器;Xbridge Prep C18色谱柱(10 mmh250 mm,5 μm);流动相:A为水(含0.1%甲酸);B为甲醇(含0.1%甲酸)。流速:3 mL/min;检测波长:280 nm;进样量:500 μL。
梯度洗脱程序:I-1组分:0~5 min,95% A、5% B;5~20 min,95%~75% A、5%~25% B;20~25 min,75% A、25% B;25~40 min,75%~40% A、25%~60% B;40~45 min,40% A、60% B;45~50 min,40%~0% A、60%~100% B;I-2-2组分:0~5 min,95% A、5% B;5~20 min,95%~85% A、5%~15% B;20~25 min,85% A、15% B;25~30 min,85%~70% A、15%~30% B;30~35 min,70% A、30% B;35~40 min,70%~50% A、30%~50% B;40~50 min,50%~0% A、50%~100% B;I-2-3组分:0~5 min,85% A、15% B;5~20 min,85%~70% A、15%~30% B;20~25 min,70% A、30% B;25~45 min,70%~40% A、30%~60% B;45~50 min,40%~0% A、60%~100% B。
每2 min收集一次,将组分I-1、I-2-2、I-2-3各分成 25个组分,分别命名为I-1-1~I-1-25、I-2-2-1~I-2-2-25、I-2-3-1~I-2-3-25。收集20个循环后,将这些组分旋转蒸发去除溶剂并冻干。冻干组分用4 mL 50%乙醇溶液复溶后,测定DSA。
1.3.7 组分I-1-16的二级半制备液相色谱分离
组分I-1-16经微孔滤膜(0.45 μm)过滤后,使用Waters苯基柱(10 mmh250 mm,5 μm)进行二级液相色谱分离。流动相、流速、检测波长与进样量同1.3.5节。
洗脱条件:0~5 min,80% A、20% B;5~25 min,80%~40% A、20%~60% B;25~30 min,40%~0% A、60%~100% B。按照色谱峰将组分I-1-16分成两个组分,命名为I-1-16-1和I-1-16-2。收集5个循环,经减压蒸馏、冻干,用2 mL 50%乙醇溶液溶解后,测定DSA。
1.3.8 化合物鉴定
将选定组分经微孔滤膜(0.45 μm)过滤后,利用UPLC-Q-TOF-MS进行化合物鉴定,采用MassLynx V4.1软件对质谱信息进行分析,通过MSFinder与质谱数据库中的样本进行指纹区和碎片化的比对,再根据文献进一步确认。
色谱条件:Waters ACQUITY UPLC色谱仪;Waters ACQUITY PDA检测器;BEH C18反向色谱柱(2.1 mmh150 mm,1.7 μm);流速0.3 mL/min;检测波长200~400 nm;进样量2 μL;柱温45 ℃。流动相:A为乙腈,B为水(0.1%甲酸)。梯度洗脱程序:0~5 min,0%~20% A、100%~80% B;5~25 min,20%~40% A、80%~60% B;25~30 min,40%~60% A、60%~40% B;30~32 min,60%~100% A、40%~0% B;32~35 min,100%~0% A、0%~100% B。
质谱条件:电喷雾离子源;毛细管电压3 000 V;锥孔电压20 V;离子源温度100 ℃;脱溶剂温度400 ℃;脱溶剂气流速700 L/h;锥孔气流速50 L/h;碰撞能量6/20 eV;离子扫描范围m/z20~2 000。
1.3.9 化合物定量
取100 mL啤酒经1.3.2、1.3.3节处理后,分别将乙酸乙酯相和水相注入液相色谱仪进行测定,采用外标法进行定量。
液相色谱条件:紫外吸收检测器;Zorbax Eclipse XDB-C18色谱柱(250 mmh4.6 mm,5 μm);流速:0.8 mL/min;检测波长:280 nm;进样量:20 μL;柱温:20 ℃。流动相:A为水(0.1%甲酸);B为甲醇(0.1%甲酸)。梯度洗脱程序:0~15 min,95%~80% A、5%~20% B;15~45 min,80%~40% A、20%~60% B;45~50 min,40%~20% A、60%~80% B;50~52 min,20%~95% A、80%~5% B;52~60 min,95% A、5% B。
建立的标准曲线如下(X为标准品浓度,Y为对应的峰面积):EGC:Y=2.589 6X+20.658,R2=0.999 6;EGCG:Y=20.054X+174.95,R2=0.999 2;EC:Y=10.162X+206.45,R2=0.999 4;ECG:Y=25.856X+545.33,R2=0.999 7;Cor:Y=31.344X-179.93,R2=0.999 2。回收率在89.5%~94.8%之间,检测结果稳定,能满足高效液相色谱检测要求。
1.4 数据处理
使用IBM SPSS Statistics 20分析数据,并利用Origin 2018作图。
2 结果与分析
2.1 大孔树脂的筛选
通过静态实验得到6种树脂对茶啤酒抗氧化物质的吸附和解吸率,结果如表1所示。X-5型树脂对茶啤酒中抗氧化物质的吸附效果最好,吸附率达84.42%,其次是LX-158、LX-17、D101、AB-8、LX-8型。比较各树脂的解吸率可知,X-5型树脂的解吸率同样高于另外5种树脂。结合吸附率和解吸率的结果可知,X-5型树脂更适用于茶啤酒抗氧化物质的分离纯化,所以选择X-5型树脂用于后续实验。
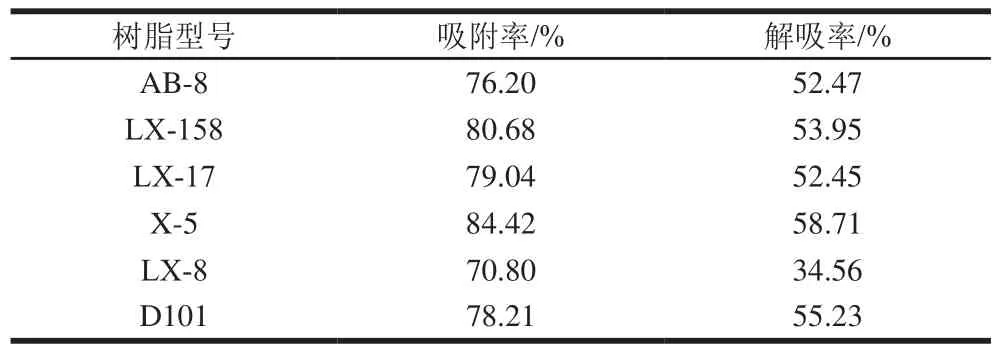
表1 大孔树脂的吸附率与解吸率Table 1 Adsorption and desorption rates of different macroporous resins
2.2 茶啤酒抗氧化物质的初步分离
根据物质的理化性质特征和不同的分离纯化原理,可采用不同形式的方法以达到分离纯化效果,常见的方法有溶剂法[14]、膜分离法[15]、大孔树脂层析法[16]、柱色谱法[17-18]和高速逆流色谱法[19-20]等。本实验通过乙醇沉淀、乙酸乙酯萃取和大孔树脂吸附,对茶啤酒的抗氧化物质进行初步分离,具体实验流程见图1。各分离组分的得率和DSA结果见表2。

表2 各分离组分的得率和DSATable 2 Yields and DPPH radical-scavenging activity of each extract

图1 实验流程图Fig.1 Experimental scheme for this study
茶啤酒经醇沉后,得到乙醇相(I)和沉淀相(II),冻干后的得率为15.66 g/L和19.68 g/L,其DAS分别为4.51 mmol/L和0.19 mmol/L。表明茶啤酒的抗氧化物质主要存在于组分I,而组分II多为蛋白质、多糖和无机盐类物质,不作进一步研究。对组分I采用乙酸乙酯萃取,得到乙酸乙酯相(I-1)和水相(I-2),DSA分别为2.82 mmol/L和1.78 mmol/L,表明疏水性化合物比水溶性化合物具有更高的抗氧化活性。然而,考虑到组分I-2的得率很高(14.55 g/L),对茶啤酒抗氧化活性的贡献不可忽视,后续将对这2个组分分别进行研究。组分I-2通过X-5型大孔树脂进一步分离纯化后,得到5个组分,其中组分I-2-3的DSA最高,为0.79 mmol/L,其次是组分I-2-2,为0.49 mmol/L,采用半制备液相色谱继续分离。
2.3 抗氧化物质的半制备液相色谱分离
半制备液相色谱分离是应用较为广泛的分离制备方法[21-22],本实验利用半制备液相色谱仪对组分I-1、I-2-2、I-2-3进行一级分离并对各收集组分进行DSA分析,结果如图2所示。共计得到75个组分,以DSA≥0.1 mmol/L为依据,筛选得到I-1-12、I-1-15~I-1-19和I-2-3-8这7个抗氧化活性较高的组分。其中,组分I-1-16的DSA最高,为1.056 mmol/L,是茶啤酒中的关键抗氧化组分,但使用UPLC-Q-TOF-MS分析后发现该组分含有2个化合物,为了确定起抗氧化作用的最关键化合物,利用苯基柱进行二级分离,得到2个组分,命名为I-1-16-1和I-1-16-2。对这2个组分进行分析,DSA依次为0.924 mmol/L和0.132 mmol/L,表明组分I-1-16-1为影响茶啤酒抗氧化活性的最主要成分。下一步将对各组分中所含的主要化合物进行鉴定。


图2 组分I-1(A)、I-2-2(B)、I-2-3(C)、I-1-16(D)的半制备色谱图和对应的DSAFig.2 Semi-preparative RP- HPLC separation and DPPH radicalscavenging activity of fraction I-1 (A), I-2-2 (B), I-2-3 (C), and sub-fraction I-1-16 (D)
2.4 物质的鉴定
采用UPLC-Q-TOF-MS对DSA较高的组分I-1-12、I-1-15、I-1-16-1、I-1-16-2、I-1-17~I-1-19和I-2-3-8进行分析,按照提取离子色谱图、确定母离子大小、查看质谱碎片信息、MSFinder搜库等步骤对物质进行鉴定。以组分I-1-12为例对鉴定过程进行说明,利用MassLynx软件分析,其色谱图及总离子流图如图3A、B所示。该组分在负离子模式下具有很强的响应,提取m/z305离子后的总离子流图呈单峰,且峰形对称(图3C)。对2种碰撞能量(6 eV和20 eV)下该离子的质谱信息(图4)进行比较发现,碰撞能量越高,碎片离子越丰富,因此以20 eV碰撞能量下的质谱信息为判断依据。由图4B可看出,有2个离子峰[M-H]-和[2M-H]-存在,m/z分别为305.060 4和611.138 4。易判定m/z305.060 4为母离子。此外,该化合物还含有m/z125.023 3、179.033 9、261.076 8的碎片离子。利用MSFinder进行比对发现,该化合物与EGC的分子质量和质谱信息能够完全匹配(图5)。因此,可确定母离子m/z305.060 4的化合物是EGC。

图3 组分I-1-12的色谱图及离子流图Fig.3 Chromatogram and ion current chromatogram of fraction I-1-12
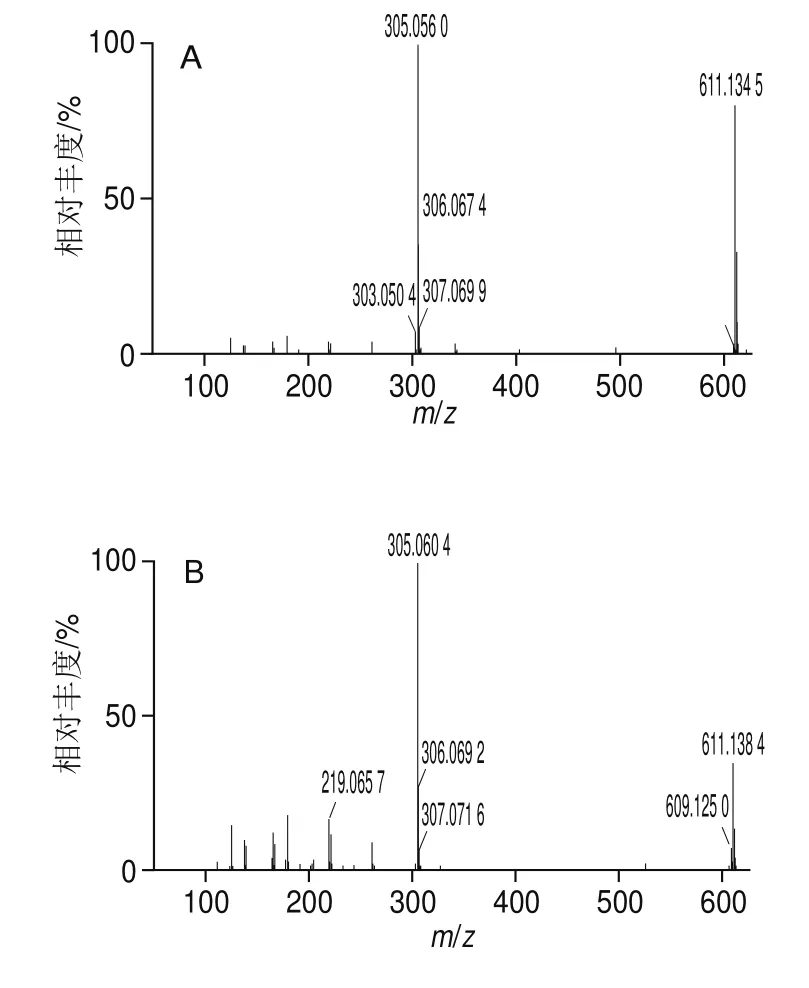
图4 m/z305.060 4的母离子质谱图Fig.4 Parent ion mass spectra of m/z 305.060 4
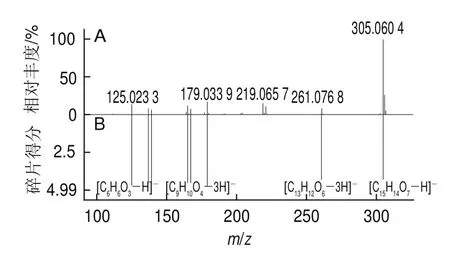
图5 碎片离子比对结果Fig.5 Comparative results of fragment ions
其他化合物的分析参照上述步骤,鉴定得到另外7个化合物,结果见表3,图6为各化合物的质谱图。EGCG、EC和ECG同样为黄烷醇类化合物,是茶叶中的主要抗氧化成分[23]。咖啡因、黄嘌呤生物碱化合物,是茶叶的主要呈味物质和生理活性成分,具有祛除疲劳、兴奋神经、强心、促进新陈代谢、利尿解毒等功效[24]以及潜在的抗氧化能力[25]。物质5初步鉴定为1,2,6-三没食子酰-β-D-葡萄糖(1,2,6-tri-O-galloyl-β-D-glucopyranose,1,2,6-TGGP),属于天然水解单宁类物质,是茶叶中的特异成分,在消炎、抑制耐药性病原菌等方面具有明显作用[26]。关于1,2,6-TGGP抗氧化活性的研究鲜见报道,但其结构类似物1,4,6-三-O-没食子酰-β-D-葡萄糖的抗氧化活性已被证实[27]。物质7、8经鉴定分别为Cor和Trp,均在云南凤庆“大山茶”里有过报道[28]。
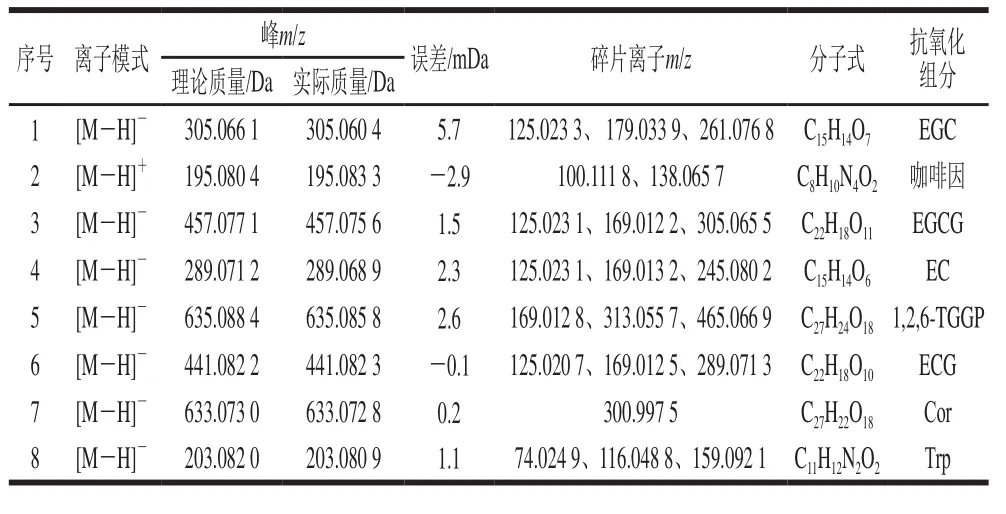
表3 茶啤酒抗氧化组分的UPLC-Q-TOF-MS分析Table 3 UPLC-Q-TOF-MS analysis of antioxidant fractions extracted from beer with tea
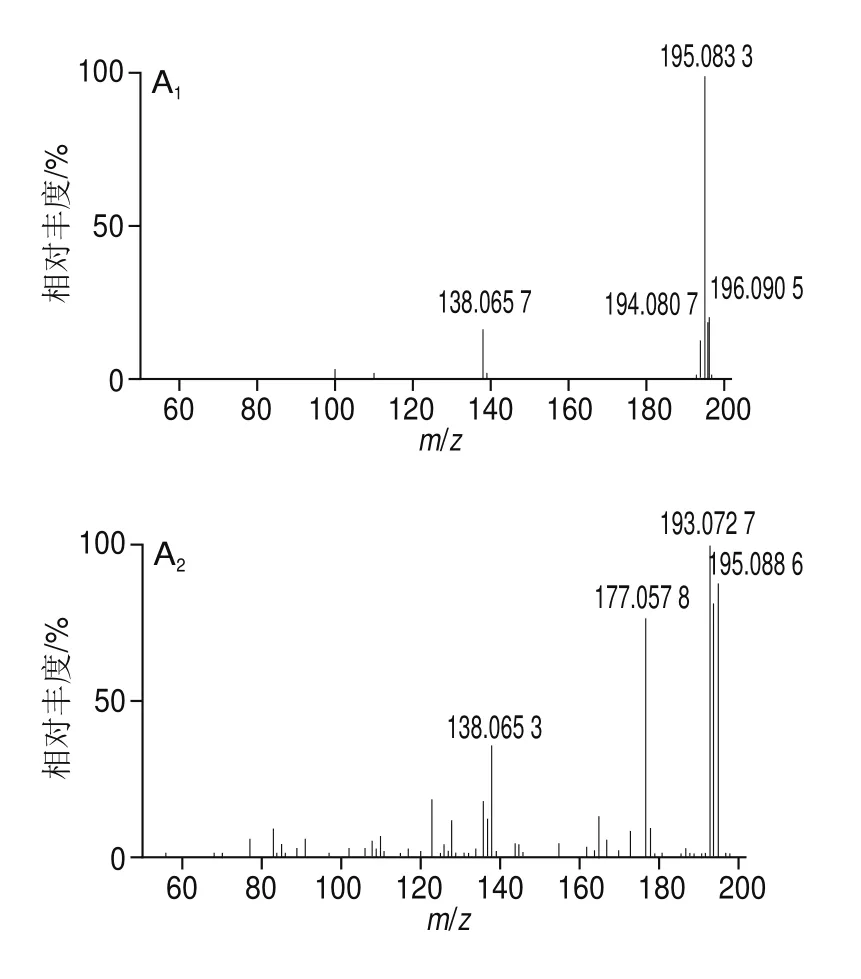


图6 各个峰提取离子后的质谱图Fig.6 Mass spectra of each peak after ion extraction
2.5 单体化合物的抗氧化活性贡献
鉴于上述得到的8种化合物中,咖啡因为管制品,1,2,6-三没食子酰-β-D-葡萄糖无标样在售,因此对其余6种化合物的抗氧化活性做实践评价。将6种化合物溶于甲醇-水(50∶50,V/V)中配成1 mg/mL的溶液,然后同无茶啤酒和远安黄茶啤酒测定DSA,结果见表4。远安黄茶啤酒具有很强的抗氧化活性,其DSA为4.78 mmol/L,明显高于无茶啤酒(1.97 mmol/L)。除Trp外,EGC、EGCG、EC、ECG和Cor都具有自由基清除活性。在相同浓度下,不同化合物对DPPH自由基的响应不同,其中,EGCG显示了最高的DSA,而Cor显示了最低的DSA。对儿茶素类化合物进行比较发现,它们清除DPPH自由基的能力顺序为EGCG>ECG>EGC>EC,这主要源于酚羟基之间的相对位置对自由基清除速率的影响,酚羟基处于邻位的化合物与自由基的反应速率要高于处于间位的[29]。
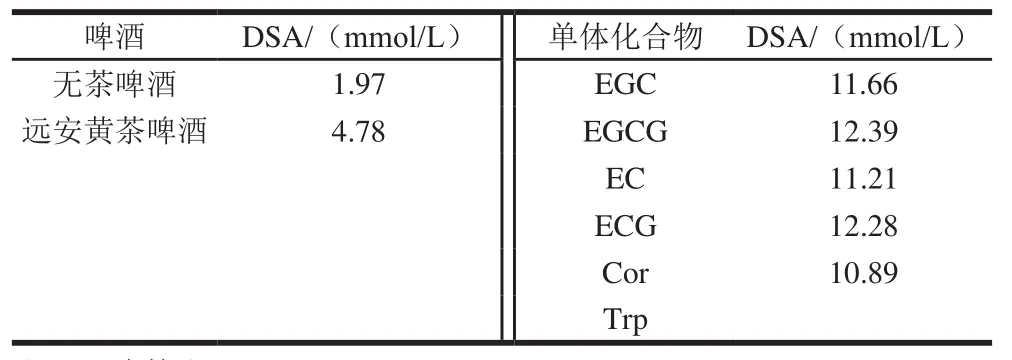
表4 啤酒和6种单体化合物的DSATable 4 DPPH radical-scavenging activity of different beers and six compounds
为进一步说明EGC、EGCG、EC、ECG和Cor对啤酒抗氧化活性的贡献,对其在啤酒中的含量进行研究,结果如表5所示。远安黄茶啤酒中的EGC、EGCG、EC和ECG含量均明显高于无茶啤酒,分别为(按含量降序):EGCG(108.636 mg/L)、EGC(68.66 mg/L)、ECG(24.51 mg/L)和EC(14.05 mg/L),与Zhao Caining等[30]得到的茶叶中的儿茶素类化合物含量排序结果一致。此外,无茶啤酒中未检测到ECG和Cor,说明这5种物质全部或者绝大部分源于茶叶原料。结合表4单体化合物的DSA,可以得到EGC、EGCG、EC、ECG和Cor在远安黄茶啤酒中的理论DSA依次为0.80、1.34、0.16、0.30 mmol/L和0.01 mmol/L,对远安黄茶啤酒的抗氧化活性贡献值分别为16.74%、28.03%、3.35%、6.28%和0.21%,总贡献值为54.61%,可说明这5种单体化合物是影响远安黄茶啤酒抗氧化活性的主要物质。

表5 啤酒中5种单体化合物的抗氧化活性贡献Table 5 Contributions of five compounds in different beers to their antioxidant activity
3 结 论
抗氧化活性对茶啤酒的功能性及风味稳定性具有重要的影响,本研究基于抗氧化活性为导向的策略对远安黄茶啤酒的抗氧化组分进行分离,利用UPLC-Q-TOF-MS共鉴定到8个化合物,其中4个黄烷醇类化合物(1、3、4、6)、1个嘌呤碱类化合物(2)、1个单宁类化合物(5)、1个酚酸类化合物(7)以及1个氨基酸类化合物(8)。对部分化合物进行了单体抗氧化活性和定量研究,结果表明EGC、EGCG、EC、ECG和Cor均具有显著的抗氧化活性,其中,ECG和Cor仅存在于远安黄茶啤酒,且远安黄茶啤酒中EGC、EGCG和EC的含量分别是无茶啤酒中的15.29、722.40 倍和10.48 倍,说明远安黄茶啤酒的抗氧化活性在很大程度上由茶叶的内源性抗氧化物质决定。此外,5种物质对远安黄茶啤酒抗氧化活性的贡献为:EGCG>EGC>ECG>EC>Cor。EGCG是影响茶啤酒抗氧化活性的最主要物质,这与EGCG是茶叶中最主要的儿茶素,约占儿茶素总量的50%~80%,且具有比VE和VC更强的抗氧化作用的结果一致[30-31]。本实验可以为开发远安黄茶深加工产品提供理论依据,为啤酒产业选择性生产具有高抗氧化活性的茶啤酒产品提供指导。然而,这5种物质并不能代表远安黄茶啤酒抗氧化活性的全部,因此,有必要对其他分离组分进行鉴定,以更深入地了解抗氧化物质及其对茶啤酒抗氧化活性的影响。
