高通量测序分析沙棘酵素自然发酵过程中细菌多样性
2022-05-09牛广财颜飞翔魏文毅王思溥
张 琪,朱 丹,牛广财,3,*,颜飞翔,魏文毅,3,朱 磊,3,王思溥
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163319;3.黑龙江省农产品加工工程技术研究中心,黑龙江 大庆 163319)
沙棘(Hippophae rhamnoidesL.)又名醋柳、酸刺,是胡颓子科沙棘属落叶灌木或小乔木,其果实为球形或近卵形小浆果,为橘黄色或橘红色[1],素“长寿果”、“神果”和“圣果”之美誉,也是珍贵的药食同源植物,收录于《中国药典》[2]。沙棘果实含有黄酮类、多酚类、多糖类、维生素类、不饱和脂肪酸、氨基酸、5-羟色胺等多种营养成分和生物活性物质[3-5],广泛应用于食品和保健品等领域,具有增强人体免疫力,抗疲劳、抗氧化、抗衰老、抗肿瘤、抗辐射、预防心脑血管疾病等多种生理功能[6-8]。
高通量测序技术代替了传统上微生物分析所采用的分离培养方法,该过程无需分离纯化,就可一次性对样品中的几十万到几百万条DNA分子进行序列测定,可快速确定其中微生物的种类和丰度[9],具有测定速度快、结果精准、利用微量样品即可实现所有微生物的检测等优点,能够更精确分析样品中微生物群落多样性和相应的功能分析。该技术应用范围较广泛,主要在人类疾病与健康、海洋、植物多样性、发酵食品、环境检测等多个领域[10-15]。近年来,利用该技术研究微生物分子生态学已成首选方法,可以全面揭示样本微生物种群组成及其多样性[16]。吴进菊等[17]对襄阳大头菜发酵过程中细菌的多样性进行了研究,结果显示绝对优势菌门为变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),相对丰度分别为26.14%~78.12%和8.33%~70.12%,而在属水平上,优势菌属分别为盐厌氧菌(Halanaerobium)、弧菌(Vibrio)、盐单胞菌(Halomonas)、乳杆菌(Lactobacillus)和色盐杆菌(Chromohalobacter)。高庆超等[18]采用高通量测序技术研究黑果枸杞酵素在自然发酵过程中微生物的动态变化,共检测出26种已知的细菌门,48种已知的细菌属,其中0 d优势菌门为Proteobacteria,占比约为99%,主要菌属为泛菌(Pantoea)71.35%、假单胞菌(Pseudomonas)14%、欧文氏菌(Erwinia)6.61%;发酵第10、20、30、40、50、60天Firmicutes为优势菌门,占比为96.9%~99.1%。
食用植物酵素以植物为原料,经微生物发酵制得的含有特定生物活性成分(多糖类、寡糖类、蛋白质及多肽、氨基酸类、维生素类等)可食用的酵素产品[19]。目前,国内酵素产业多以天然发酵为主。但该种方式受环境条件影响较大,发酵过程中微生物的菌群比较复杂,产品质量较难控制。因此,研究自然发酵食用酵素中微生物菌群的变化规律,是筛选酵素优良与优势菌种的基础。截至目前,鲜见有关沙棘酵素自然发酵过程中微生物群落结构多样性方面研究报道。本实验基于高通量测序技术,对不同发酵阶段的沙棘酵素中细菌种群组成及多样性进行研究,以期开发和应用酵素优良菌种,为沙棘酵素的可控发酵、安全高效生产和品质提升提供理论依据。
1 材料与方法
1.1 材料与试剂
冷冻大果沙棘,黑龙江省孙吴县宝江大果沙棘展销中心提供。
Pectinex BEXXL果胶酶(酶活力10 000 U/mL)诺维信(中国)生物技术有限公司;FastDNA®Spin Kit for Soil型号DNA抽提试剂盒 美国MP Biomedicals公司;琼脂糖 西班牙Biowest公司;FastPfuPolymerase北京TransGen公司;AxyPrep DNA Gel Extraction Kit美国Axygen公司;NEXTFLEX®Rapid DNA-Seq Kit建库试剂盒 美国Bioo Scientific公司;MiSeq Reagent Kit v3测序试剂盒 美国Illumina公司。
1.2 仪器与设备
N13462C移液器、5424R高速台式冷冻离心机德国Eppendorf公司;ELx800酶标仪 美国BioTek公司;Quantus™ Fluorometer微型荧光计 美国Promega公司;DYY-6C电泳仪 北京市六一仪器厂;GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 采集流程
沙棘酵素自然发酵法制备:首先将-20 ℃冷冻的大果沙棘在常温下解冻,用打浆机进行打浆,用Pectinex BEXXL果胶酶进行酶解,酶解条件为2.0 mL/kg的添加量,于45 ℃酶解4 h[20];用白砂糖调整糖度至21 °Brix[21]后,在22 ℃恒温条件下进行自然发酵。
沙棘酵素样品的采集:在发酵72~1 584 h期间,根据其还原糖、体积分数和pH值等指标进行分阶段取样,发酵第72小时第1次取样,命名为发酵前期(F22_Q),发酵第624小时第2次取样,命名为发酵中期(F22_Z),发酵1 584小时第3次取样,命名为发酵后期(F22_H)。取样方法是将发酵液在锥形瓶中混合均匀,然后取15 mL于离心管中,置-80 ℃冰箱中冷冻,用于微生物测序。
1.3.2 理化指标的测定
还原糖含量:采用3,5-二硝基水杨酸比色法测定[22];乙醇:参照GB 5009.225ü2016《酒中乙醇浓度的测定》酒精计法测定[23];pH值:采用酸度计法测定。
1.3.3 琼脂糖凝胶电泳
检测前将样品在冰上融化后,充分混匀并离心,取3 µL上样检测。检测条件为2%琼脂糖胶、电压5 V/cm、时间20 min。
1.3.4 DNA抽提和PCR扩增
根据说明书进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度;使用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA基因V3-V4可变区进行PCR扩增。扩增程序如下:95 ℃预变性3 min,30个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),然后72 ℃稳定延伸10 min,最后在10 ℃进行保存。PCR体系为:5hFastPfuBuffer缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,FastPfuPolymerase DNA聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL。每个样本3个重复。
1.3.5 Illumina MiSeq测序
利用Illumina公司的MiSeq PE300平台进行测序,该部分送至上海美吉生物医药科技有限公司进行操作。
1.4 数据处理
使用Trimmomatic软件原始测序序列进行质控,使用FLASH软件进行拼接;然后使用UPARSE软件,根据97%的相似度对序列进行OTU聚类并剔除嵌合体。利用RDP classifier对每条序列进行物种分类注释,细菌比对采用Silva数据库(SSU128);根据OTU聚类分析结果,采用Mothur计算分析样品的α多样性,包括Sobs指数、Shannon指数、Simpson指数、ACE指数、Chao指数和覆盖率;利用R语言进行菌群多样性分析,并绘制柱状图、Venn图和热图[24],结合基于Bary-Curtis距离算法的主成分分析(principal component analysis,PCA)图分析微生物结构组成差异。
2 结果与分析
2.1 沙棘酵素发酵过程中主要理化指标的变化
由图1可知,还原糖质量分数由初始值21.1%呈现持续下降趋势,至发酵后期还原糖质量分数降为10.3%;乙醇体积分数的变化正好与之相反,在发酵前期增长较快,在624 h之后保持稳定,在1 584 h达到4.24%;还原糖含量下降速度比较均匀,说明在发酵过程中,发酵液中的微生物能够充分利用糖类物质,消耗糖类而产生乙醇或者其他物质;pH值在整个发酵中呈先上升后下降的趋势,这可能与一些微生物将有机酸作为替代碳源被部分消耗有关[25]。

图1 沙棘酵素发酵过程中的还原糖含量、乙醇体积分数和pH值的变化Fig.1 Changes in the contents of reducing sugar and alcohol and pH during the fermentation of sea buckthorn jiaosu
2.2 琼脂凝胶电泳鉴定
沙棘酵素自然发酵过程中不同发酵阶段的发酵液中细菌16S rRNA PCR扩增产物琼脂凝胶电泳结果如图2所示,沙棘酵素自然发酵共分为3个阶段(F22_Q、F22_Z、F22_H)9个样本的PCR扩增产物条带在500 bp左右,与设计引物扩增长度接近,特异性和亮度均较好,可满足下一步的测序要求。

图2 沙棘酵素发酵液细菌PCR扩增结果电泳图Fig.2 Electrophoresis images of PCR amplified products of bacterial 16S rRNA gene from sea buckthorn jiaosu
2.3 高通量测序结果分析
2.3.1 测序样本数据分析
沙棘酵素自然发酵过程中的3个不同发酵阶段样品,经测序后对数据进行分析,根据序列扩增区域338F_806R,可得到原始序列信息,经优化后得到的序列信息如表1所示。通过Illumina MiSeq高通量测序平台整理原始数据,并进行统计优化,沙棘酵素自然发酵样品优化序列范围为38 917~70 982 条,平均长度范围为403.10~418.10 bp,与设计引物扩增长度接近。由于平行样本之间存在误差,但是误差较小,在允许误差范围内,所以数据样本具有有效性,质控合格。

表1 样本测序结果Table 1 Results of bacterial 16S rRNA gene sequencing
2.3.2 测序样本结果分析
稀释曲线主要利用各沙棘酵素样品在不同测序深度时的微生物α多样性指数构建曲线,以此反映各样品在不同测序数量时的微生物多样性。图3、4为沙棘酵素自然发酵过程中不同发酵阶段细菌的稀释曲线图。如图3所示,在测序深度小于20 000时,随着序列数不断增加,Sobs指数显著增加,但是当序列数介于20 000~40 000时,Sobs指数缓慢增加,最终曲线趋向平坦,说明测序数据量合理。如图4所示,在测序数据量0~40 000范围内,Shannon指数曲线趋向平坦,说明测序数据量足够大,可以反映样本中绝大多数的微生物多样性信息。

图3 Sobs指数稀释曲线Fig.3 Rarefaction curves of Sobs index

图4 Shannon指数稀释曲线Fig.4 Rarefaction curves of Shannon index
2.3.3α多样性分析
为保证测序序列的均一性,按照最小样本进行抽平后,根据分类单元个数统计,得到1个域,1个界,25个门,57个纲,149个目,239个科,422个属,601个种,744个OTU。α多样性分析可以反映样本中微生物群落的丰富度和多样性,α多样性中包含能够估计环境群落的物种丰度和多样性的相关指数。由表2可知,细菌中覆盖率均不小于99.97%,菌落的覆盖率很高,说明本次测序的样品数据能够覆盖当前沙棘酵素发酵液中细菌的种类,完全能够代表样本中细菌的真实情况。在整个发酵阶段,Shannon指数呈现逐渐升高的趋势,而Simpson指数变化趋势正好与其相反,说明随着发酵的进行,群落的细菌多样性逐渐丰富,在发酵后期达到最高;ACE指数和Chao指数反映的是群落的丰富度,这两个指数也是逐渐增加,说明随着发酵的进行,沙棘酵素酵液中物种的种类逐渐增多。

表2 细菌α多样性指数Table 2 Bacterial α diversity indexes
2.3.4 细菌OTU分布
根据不同的相似度水平,对所有序列进行OTU划分,对97%相似水平下的OTU进行生物信息统计分析。由图5可知,前期(F22_Q)、中期(F22_Z)和后期(F22_H)含有OTU数分别为99、280、325,其中特有的OTU数分别为8、85、124。由此可见,随着沙棘酵素自然发酵的进行,OTU数呈现显著增加的趋势,说明细菌菌群的丰富度和多样性在逐渐提高,这与多样性指数的分析结果一致,说明沙棘酵素在其自然发酵的整个过程中细菌群落变化较大。

图5 沙棘酵素自然发酵过程中细菌OTU Venn图Fig.5 Venn diagram showing unique and shared bacterial OTU between three fermentation stages of sea buckthorn jiaosu
2.3.5 基于门水平细菌群落结构差异性分析
在门水平上沙棘酵素在自然发酵过程中细菌群落结构如图6所示,在沙棘酵素自然发酵过程中共检出744个OTU,25个门,422个细菌属,其相对丰度大于1%的细菌门共5种,分别为蓝藻细菌门(Cyanobacteria)、Proteobacteria、未知细菌门(unclassified_k__norank_d__Bacteria)、酸杆菌门(Acidobacteriota)、Firmicutes。由图6可知,Cyanobacteria是沙棘酵素整个发酵过程中的第一大绝对优势菌门,占据主导作用,是沙棘酵素前期(F22_Q)、中期(F22_Z)和后期(F22_H)3个不同发酵阶段的绝对优势菌门,其相对丰度分别为93.28%、66.59%和35.40%;Proteobacteria为第2大优势菌门,相对丰度为6.60%~33.29%,该菌门在植物土壤中较为常见[26-27],可能是沙棘果在采摘过程中携带环境微生物所致。随着发酵的进行,在中期(F22_H)和后期(F22_Z)阶段,该Proteobacteria呈增加趋势,由此也可以看出,沙棘酵素自然发酵过程中细菌群落结构的不均一性。
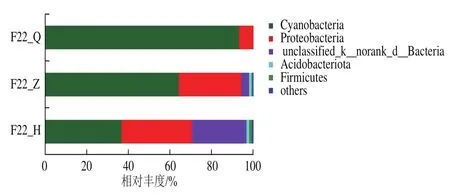
图6 细菌群落在门水平上的相对丰度Fig.6 Relative abundance of bacterial communities at the phylum level
2.3.6 基于属水平细菌群落结构差异性分析
在属水平上沙棘酵素在自然发酵过程中细菌群落结构如图7所示,其相对丰度大于1%的细菌属共有5种,分别为:norank_f__norank_o__Chloroplast、雷尔氏菌(Ralstonia)、unclassified_k__norank_d__Bacteria、norank_f__Mitochondria、Burkholderia-Caballeronia-Paraburkholderia。在发酵前期(F22_Q),norank_f__norank_o__Chloroplast为主要优势菌属,相对丰度达到93.28%,虽然在整个发酵过程中,该菌属丰度逐渐减少,尽管在后期(F22_H)减少至35.39%。但是,该菌属在整个发酵过程占比却始终处于优势地位,为绝对优势菌属。随着发酵的进行,Ralstonia也属于优势菌属,在沙棘酵素自然发酵各阶段相对丰度依次为1.43%(F22_Q)<21.45%(F22_Z)<29.37%(F22_H);另一种优势菌属为unclassified_k__norank_d__Bacteria,在各阶段的相对丰度依次为0%(F22_Q)<4.02%(F22_Z)<27.98%(F22_H)。
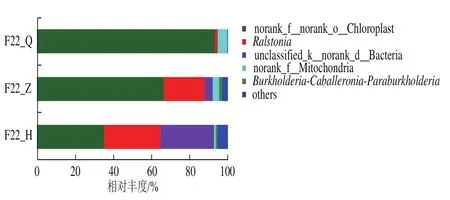
图7 细菌群落在属水平上的相对丰度Fig.7 Relative abundance of bacterial communities at the genus level
2.3.7 基于属水平不同发酵阶段热图分析
热图是以颜色梯度表征二维矩阵或表格中的数据大小,并呈现群落物种组成及物种的丰度信息,通过色块颜色梯度展示样本中不同物种的丰度变化情况[28]。由图8可知,沙棘酵素自然发酵的3个不同阶段的样本有所差异,其中,分类水平总相对丰度排在前10 位的菌属分别为norank_f__norank_o__Chloroplast、Ralstonia、unclassified_k__norank_d__Bacteria、norank_f__Mitochondria、Burkholderia-Caballeronia-Paraburkholderia、Rhodococcus、Pelomonas、Anaerocolumna、Acinetobacter、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium。3个发酵阶段的主要优势菌属相同,均为norank_f__norank_o__Chloroplast属,在发酵前期、中期和后期3个阶段占比分别为93.55%、67.67%和36.46%;除发酵后期(F22_H)第2优势菌属为norank_f__Mitochondria外,其他两个阶段(F22_Q、F22_Z)的第2大菌属均为Ralstonia。不同发酵阶段细菌群落结构组成具有一定差异性,虽然有些菌属结构类似,但是含量却均有不同,说明沙棘酵素发酵液中细菌群落结构的多样性,这与细菌群落在属水平上占比的分析结果一致。

图8 细菌属水平群落结构热图Fig.8 Heatmap of bacterial community structure at the genus level
2.3.8β多样性分析
2.3.8.1 样本层级聚类分析
为研究沙棘酵素自然发酵不同阶段群落结构的相似性或差异关系,对3个发酵阶段群落距离矩阵进行聚类分析。如图9所示,3个发酵阶段可聚为两类,即F22_Q和F22_Z聚为一类,F22_H聚为一类,其中发酵前期(F22_Q)的优势菌属为:norank_f__norank_o__Chloroplast、norank_f__Mitochondria、Ralstonia,相对丰度依次为93.28%、4.90%和1.43%;中期(F22_Z)为norank_f__norank_o__Chloroplast、Ralstonia、unclassified_k__norank_d__Bacteria、norank_f__Mitochondria、Burkholderia-Caballeronia-Paraburkholderia,相对丰度依次为:66.59%、21.45%、4.02%、3.30%和1.41%;后期(F22_H)为norank_f__norank_o__Chloroplast、Ralstonia、unclassified_k__norank_d__Bacteria、norank_f__Mitochondria、Burkholderia-Caballeronia-Paraburkholderia,相对丰度依次为35.39%、29.37%、27.98%、0.88%和0.95%。总体而言,在前期和中期发酵的细菌群落结构较为相似,原因可能是这两个时期溶液的渗透压比较大,而后期随着微生物的生长和代谢,使其环境发生变化[29],从而细菌的丰度产生差异。
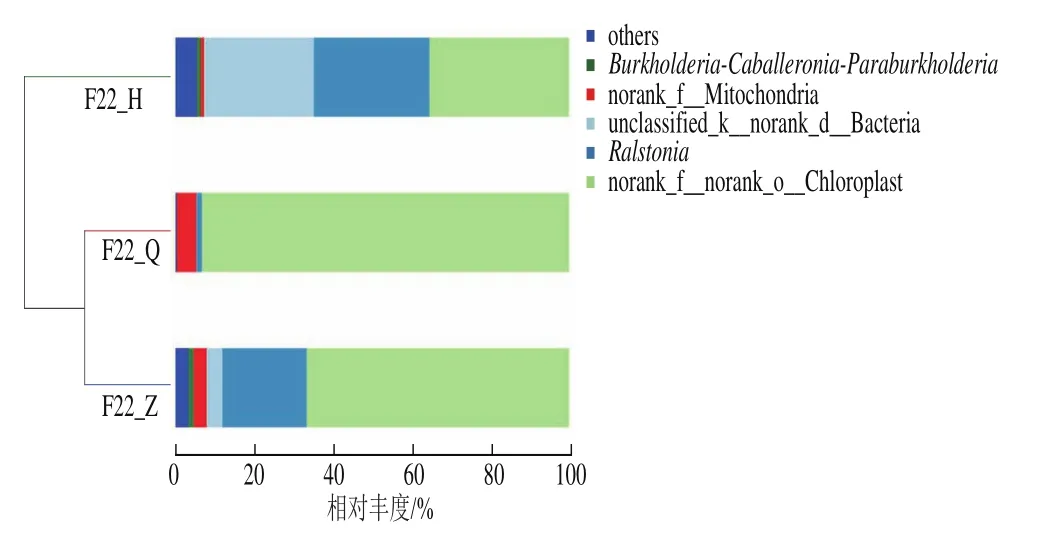
图9 基于聚类分析和属水平沙棘酵素发酵样品中的细菌群落结构分析Fig.9 Analysis of bacterial community structure at the genus level in sea buckthorn jiaosu samples based on cluster analysis
2.3.8.2 沙棘酵素自然发酵液中细菌群落PCA
基于属水平,对沙棘酵素发酵液中菌属进行PCA,结果如图10所示,PC1的贡献率为28.68%,PC2的贡献率为20.43%。在PCA中,各个点之间的距离越大,表明它们之间的菌群差异越大[30]。反之,样本点越接近,表明两样本物种组成则越相似[31]。在3个平行样本中,F22_Q的样本之间距离非常小,表明发酵初始阶段组内的差异非常小,而F22_Z和F22_H组内距离较大,说明这两个样本的组内差异较大,原因是中后期沙棘酵素发酵液的环境较复杂,菌属分布不均匀所致;从整体看,这3个发酵阶段组间差异较大,说明沙棘酵素不同发酵阶段的细菌群落结构差异性比较大。根据图10分组可知,发酵前期(F22_Q)和中期(F22_Z)聚为一类,发酵后期(F22_H)聚为一类,这与样本层级聚类分析结果相同。

图10 细菌群落PCAFig.10 PCA plot of bacterial community
2.3.9 沙棘酵素发酵中还原糖、乙醇和pH值与优势菌属间的相关性
由图11可知,细菌的群落结构中相对丰度大于1%的优势菌属与发酵过程中还原糖含量、乙醇体积分数和pH值指标间具有一定的相关性。其中,沙棘酵素发酵前期的norank_f__norank_o__Chloroplast和norank_f__Mitochondria与还原糖含量呈显著正相关(P<0.05),与乙醇体积分数和pH值呈显著负相关(P<0.05),而发酵中后期的Ralstonia和unclassified_k__norank_d__Bacteria则正好相反,即与还原糖含量的变化呈显著负相关(P<0.05),与乙醇体积分数和pH值则呈显著正相关(P<0.05)。说明沙棘酵素自然发酵中norank_f__norank_o__Chloroplast、norank_f__Mitochondria、Ralstonia和unclassified_k__norank_d__Bacteria对发酵液中还原糖、乙醇和pH值的影响显著。

图11 沙棘酵素发酵过程中还原糖、乙醇和pH值与优势菌属间的相关性热图Fig.11 Heatmap of the correlation between reducing sugar content,alcohol content, pH and dominant bacteria during the fermentation of sea buckthorn jiaosu
3 讨 论
通过Illumina高通量测序方法,分析了沙棘酵素自然发酵过程中细菌结构及多样性变化。结果显示,随着发酵的进行,细菌群落结构越来越复杂,菌株种类越来越多。在发酵前期、中期和后期独有OTU数分别为8、85和124,细菌菌群的丰富度和多样性在逐渐提高。其中,norank_f__norank_o__Chloroplast在整个发酵过程中是绝对优势菌属,虽然随着发酵进行,该菌属呈现逐渐下降的趋势,相对丰度由前期的93.28%降至中期的66.59%和后期的35.40%,而Ralstonia属和unclassified_k__norank_d__Bacteria在中后期的相对丰度则持续升高。说明该温度下,这几种菌属较适宜此发酵液中的环境,特别是沙棘果较高的酸性条件,也可能是发酵前期,由于发酵液中的含糖量较高,导致微生物所处环境的渗透压较高,而norank_f__norank_o__Chloroplast和norank_f__Mitochondria发酵前期丰富度较高的菌属,能够在此环境下较好利用糖类物质,但是随着糖类物质的消耗,发酵液中渗透压的降低,发酵环境发生改变,其他微生物开始生长繁殖,导致微生物的结构及多样性变得丰富起来。由相关性分析可知,本研究中norank_f__norank_o__Chloroplast、norank_f__Mitochondria、Ralstonia和unclassified_k__norank_d__Bacteria等菌属与沙棘酵素中还原糖、乙醇和pH值的相关性显著。
沙棘酵素发酵中细菌群落来源可能与沙棘果在采摘时接触土壤、树体而带来的生长环境中微生物有关。此外,由于沙棘果浆在自然发酵前,尚未经过灭菌处理,在解冻和打浆过程中也会有周围环境中微生物的参与。在发酵前期(F22_Q),细菌群落结构比较单一,以norank_f__norank_o__Chloroplast为绝对优势菌属,其次有少量的norank_f__Mitochondria和Ralstonia;在发酵中后期,细菌群落结构具有一定的差异性;而通过细菌OTUVenn图可知,细菌菌群的丰富度和多样性均呈现升高的趋势,从而更有力的展示了沙棘酵素自然发酵过程中细菌群落结构的演替规律。很多植物类酵素在自然发酵中,其微生物的结构和丰度都会有非常明显的变化,例如,黑果枸杞酵素自然发酵过程中,在发酵0~20 d细菌群落多样性和丰富度相对较高,在发酵30~50 d真菌群落多样性和丰富度相对较高,在其自然发酵中主要优势细菌为Lactobacillus[27];苹果自然发酵酵素中的细菌多样性前期最高,呈先降低后升高的趋势,细菌主要有Lactobacillus、葡萄糖酸杆菌(Gluconobacter)、乳酸乳球菌(Lactococcus)、魏斯氏菌(Weissella)、明串珠菌(Leuconostoc)和醋酸菌(Acetobacter)[32];在大头菜发酵过程中,Proteobacteria和Firmicutes占据了绝对的优势,在发酵前期,Vibrio为优势菌属,而随着发酵的进行,弧菌属相对丰度急剧下降,Halanaerobium成为相对丰度最高的优势菌属,而Halomonas、Chromohalobacter和norank_f_TBZ33也是发酵后期的优势菌属[17]。由此可见,植物酵素在自然发酵过程中,由于原料不同,发酵条件差异较大,所涉及的微生物种类多,在不同发酵阶段各种微生物的作用以及作用机制还有待进一步研究。
4 结 论
通过Illumina MiSeq测序对沙棘酵素自然发酵前期(F22_Q)、中期(F22_Z)和后期(F22_H)3个时期样本进行分析,根据分类单元个数统计得744个OTU,25个门,42个细菌属。在门水平上共有5种优势菌门,分别为Cyanobacteria、Proteobacteria、unclassified_k__norank_d__Bacteria、Acidobacteriota、Firmicutes,其中,Cyanobacteria为绝对优势菌门,在3个发酵阶段的相对丰度分别为93.28%、66.59%和35.40%;在属水平上共有5种优势菌,分别为norank_f__norank_o__Chloroplast、Ralstonia、unclassified_k__norank_d__Bacteria、norank_f__Mitochondria、Burkholderia-Caballeronia-Paraburkholderia,其中,norank_f__norank_o__Chloroplast菌属在整个发酵过程相对丰度均处于领先地位,其相对丰度范围为35.39%~93.28%;通过β多样性中的样本层级聚类分析和PCA得出,3个发酵阶段可聚为两类,F22_Q和F22_Z聚为一类,F22_H为一类。这为后续沙棘酵素的发酵提供重要理论基础,同时对沙棘酵素的生产工艺等具有深远影响。本研究揭示了沙棘酵素自然发酵过程中细菌群落的动态演替,为研制高效酵素发酵剂,提高沙棘酵素产品质量提供了的理论基础。
