酸笋中具有抗炎活性乳酸菌的筛选及鉴定
2022-05-09秦雅莉赵笑颍沈圆圆于福田刘小玲
秦雅莉,赵笑颍,沈圆圆,于福田,刘小玲,2,*
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.广西水牛乳工程技术研究中心,广西 南宁 530004)
酸笋是广西及周边地区的传统发酵食品,历史悠久,因其特殊气味和风味深受本地人喜爱。酸笋是经过浸泡于山泉水或低盐水,通过自然发酵后具有酸味的特色发酵食品。竹笋富含大量营养物质如游离氨基酸、蛋白质、糖[1],是微生物生长的理想培养基。在以自然发酵为主的生产方式中,发酵酸笋品质变化的主要因素是微生物作用。乳酸菌作为自然发酵过程中主要的发酵微生物,其在发酵过程中的生长代谢不仅丰富了营养物质[2],还参与特殊风味的形成[3]、抑制杂菌生长[4],且改善人体肠道不适及增强结肠功能与稳定性,是筛选益生菌的来源之一[5]。
目前,针对酸笋的研究主要集中在营养成分与风味及加工工艺方面[1-3],对其乳酸菌资源研究较少。有研究报道,酸笋发酵液中具有丰富的乳酸菌资源,优势菌群主要集中于乳杆菌属、乳球菌属、魏斯氏菌属和明串珠菌属[6],但国内外研究功能性乳酸菌主要来源于发酵乳制品、蔬菜制品、肉制品[7-9],而酸笋作为一种以乳酸菌发酵为主的发酵蔬菜制品鲜有报道,特别是有关酸笋中具有良好抗炎活性的乳酸菌。乳酸菌是健康人群肠道微生物中的重要菌群,具有维持肠道微生态稳定[10]、增强机体免疫力[11]、修复受损屏障[12]、抑制致病菌过度繁殖以及预防治疗炎症等功效[12];李少慧[7]从新疆奶酒与青海发酵酸奶中分离筛选得到乳酸杆菌M5-L与Q8-L,Zhou Xianrong等[14]从泡菜中筛选得到发酵乳杆菌CQPC04,Jin Junhua等[9]从发酵肉制品中得到植物乳杆菌Zhang-LL;以上研究均证实乳酸菌对肠道炎症具有调节作用。
柳州螺蛳粉风靡全国,酸笋作为其必不可少的配料之一,加速对酸笋资源深入研究和开发利用具有重要经济价值,并有助于开发乳酸菌资源应用于本地特色功能性食品。因此本研究以广西柳州酸笋发酵液为原料,采用传统方法对乳酸菌进行分离纯化,对乳酸菌的基本益生特性进行筛选和鉴定,最后初步评价该菌株的抗炎活性,以期进一步开发柳州本地酸笋中乳酸菌资源,为酸笋源乳酸菌应用于功能性食品的研究提供理论基础。
1 材料与方法
1.1 材料与试剂
酸笋发酵液采集于柳州阿亮酸笋、之味螺食品科技公司以及柳州石山脚农业科技有限公司;对照菌株鼠李糖乳杆菌(Lactobacillus rhamnosus)LGG由皇氏乳业集团提供;人结肠癌细胞系HT-29细胞株 生工生物工程(上海)股份有限公司;小鼠巨噬细胞RAW264.7中国科学院上海细胞库。
MRS培养基 北京陆桥技术股份公司;牛胆盐 青岛海洋化工厂;一氧化氮(NO)测试盒(硝酸还原酶法) 南京建成生物工程研究所;白细胞介素1β(interleukin-1β,IL-1β)、IL-6检测试剂盒 武汉伊莱瑞特生物科技股份有限公司;胎牛血清 上海逍鹏生物科技公司;RPMI-1640培养基、高糖DMEM培养基美国Gibco公司;氯化钠、氢氧化钠、氯化镁、碳酸铵、磷酸二氢钾、碳酸氢钠均为分析纯。
1.2 仪器与设备
TC-512聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Biometra公司;凝胶成像系统 法国Vilber公司;GI80TW立式自动压力蒸汽灭菌器 致微(厦门)仪器有限公司;DZKW-D-1电热恒温水浴锅北京光明医疗仪器有限公司;SW-CJ-2F洁净工作台苏州安泰空气技术有限公司;酶标仪 奥地利TECAN公司。
1.3 方法
1.3.1 菌株的分离纯化
将酸笋发酵液以2%接种量接种于无菌MRS培养基中,于37 ℃恒温培养箱中静置富集培养24 h,取1.0 mL菌液用无菌生理盐水进行梯度稀释,然后选择合适的2~3个梯度,并分别取100 μL菌液涂布于MRS固体培养基,37 ℃恒温培养48 h,观察并记录菌落颜色、形状、光滑程度等特征[15]。挑取不同形态的单菌落划线纯化3次,对革兰氏染色为紫色、接触酶实验为阴性的单菌落初步判定为乳酸菌,用50%甘油保存于-80 ℃冰箱备用。
1.3.2 耐酸性实验
参考张娜[16]的方法,将实验菌株于37 ℃培养箱中培养活化至3 代,以0.1%接种量接种于10 mL pH 3.0无菌MRS液体培养基中,置于37 ℃培养箱中培养24 h,以菌株在24 h与0 h的OD600nm之差ΔOD600nm为指标,进行初步耐酸菌株筛选。
1.3.3 耐胆盐实验
参考刘璐等[17]的方法并加以修改,将实验菌株于37 ℃培养箱中培养活化至3 代,4 ℃、4 000 r/min离心10 min,用无菌生理水洗涤菌液,并调节菌液浓度为1h109CFU/mL。以2%接种量接种于含0.1%牛胆盐的MRS培养基中,分别取0 h和3 h菌液进行稀释涂布测定活菌数,存活率按式(1)计算:

1.3.4 模拟人工胃肠液实验
人工胃液的配制:氯化钾0.514 395 g、磷酸二氢钾0.108 872 g、碳酸氢钠7.644 91 g、氯化钠2.244 096 g、六水氯化镁0.067 089 g、二水氯化钙0.088 212 g、胰蛋白酶(1 500 U/mg)66.67 mg、牛胆酸钠5.376 9 g、蒸馏水1 L,用1 mol/L HCl溶液调节pH值至3.0,用0.22 μm过滤器除菌备用。
人工肠液的配制:氯化钾0.506 94 g、磷酸二氢钾0.122 481 g、碳酸氢钠2.100 25 g、氯化钠2.758 368 g、六水氯化镁0.024 396 g、碳酸铵0.048 045 g、二水氯化钙0.022 053 g、胃蛋白酶(3 200 U/mg)625 mg、蒸馏水1 L,用1 mol/L HCl溶液调节pH值至7.0,用0.22 μm过滤器除菌备用。
参考Brodkorb等[18]方法并加以修改,将实验菌株于37 ℃培养箱中培养活化至3 代,在4 ℃、4 000 r/min下离心10 min,用无菌生理盐水洗涤菌液,并调节菌液浓度为1h109CFU/mL。取1 mL菌液于9 mL人工胃液中,37 ℃、90 r/min培养2 h,利用平板计数法分别测定0、2 h活菌数。按式(2)计算存活率:

取上述模拟消化后的溶液1 mL于9 mL人工肠液中,37 ℃、90 r/min培养2 h,利用平板计数法分别测定0、2 h活菌数,按式(3)计算存活率:

1.3.5 黏附实验
参考Celebioglu等[19]方法并加以修改,采用荧光标记法。取50 mL已活化菌液,在4 000hg、4 ℃离心10 min,磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤3次,并调整菌液浓度OD600nm为0.5f0.05。在37 ℃用100 mmol/L 5(6)-羧荧光素二乙酸酯染色30 min,PBS洗涤2次,用RPMI-1640培养基重悬,以激发波长485 nm、发射波长538 nm于酶标仪下测定荧光强度。
HT-29细胞经胰酶消化后,利用血球计数板进行细胞计数,并稀释调节细胞浓度至2.5h105cells/mL,均匀接种于24 孔板,每孔500 μL。37 ℃、5% CO2培养箱中培养至融合态,加入500 μL上述已荧光标记的菌悬液,同时用鼠李糖乳杆菌LGG作对照,37 ℃培养1 h后,PBS洗涤3次,加入500 μL含1 g/100 mL SDS的0.1 mol/L NaOH溶液溶解黏附的乳酸菌,以激发波长485 nm、发射波长538 nm测定荧光强度。细胞黏附率按式(4)计算:

1.3.6 细胞活力检测
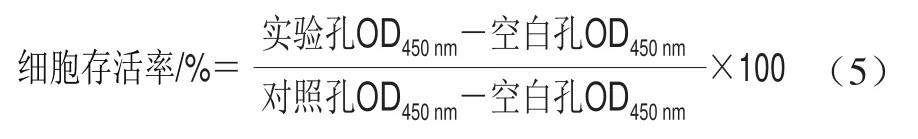
参考Zhao Xiaohong等[20]方法并加以修改。将胰酶消化后的RAW264.7细胞浓度调整到5.0h104cell/mL,均匀接种于96 孔板,37 ℃、5% CO2培养箱中培养至融合态。加入10 μL浓度为1.0h108CFU/mL菌液孵育3 h,同时用鼠李糖乳杆菌LGG作对照孔,以未加菌液为空白孔,加入10 μL CCK-8试剂,孵育1 h后,测定每孔OD450nm。存活率按式(5)计算:
1.3.7 NO释放水平测定
参考Emam等[21]方法并加以修改。将胰酶消化后的RAW264.7细胞悬液,通过血细胞计数法将浓度调整为2.5h105cells/mL,均匀接种于24 孔板,37 ℃、5% CO2培养箱中培养至融合态。加入1 μg/mL脂多糖(lipopolysaccharide,LPS)刺激24 h,然后加入50 μL已活化浓度为1h108CFU/mL的菌液培养3 h,收集上清液。根据NO检测试剂盒说明书操作,按式(6)计算NO浓度。同时用鼠李糖乳杆菌LGG作阳性对照,以未处理正常细胞作空白。

式中:c为亚硝酸钠标准溶液浓度,20 μmol/L;n为稀释倍数(n=4)。
1.3.8 IL-6、IL-1β细胞因子水平测定
按1.3.7节方法进行处理得到上清液,然后按照试剂盒说明书测定上清液中炎症因子IL-6、IL-1β水平。
1.3.9 16 S rRNA基因序列分析
菌株活化至3 代后,于MRS固体培养基划线培养48 h,挑取单菌落进行PCR。16S rRNA基因采用反向引物1492R(5’-AGAGTTTGA TTTGATCCTGGCTAG-3’)、正向引物27F(5’-GGTTACCTTGTTACGACTT-3’)进行扩增,以25 μL反应体系,94 ℃预变性5 min,94 ℃变性1 min、64 ℃退火1 min、72 ℃延伸2 min,35个循环;72 ℃末端延伸10 min,4 ℃保存。扩增结束后取4 μL PCR产物进行1%琼脂糖凝胶电泳,测序,测序结果在NCBI的GenBank序列数据库进行BLAST分析,在基因库选取参考菌株进行同源性比较,鉴定到种。选取适宜的参考菌株序列,采用MEGA 7.0软件进行构建系统发育树[22]。
1.4 数据处理与统计分析
2 结果与分析
2.1 酸笋发酵液中乳酸菌的分离纯化
根据革兰氏染色为紫色和接触酶实验为阴性,从3 份样品中共筛选得到46 株疑似乳酸菌,均为乳白色单菌落,呈杆状或短杆状,并且伴有酸味。乳酸菌SS-31菌落形态与革兰氏染色图如图1所示。

图1 乳酸菌SS-31菌落(A)与革兰氏染色镜检形态(B)Fig.1 Colony morphology (A) and cell morphology (B) of strain SS-31
2.2 酸笋发酵液中乳酸菌的耐酸能力

表146 株分离菌株在pH 3.0 MRS培养基中24 h的生长情况Table 1 Growth status of isolated strains cultured for 24 hours in MRS medium at pH 3.0
益生菌发挥益生作用的前提是存活于人体胃肠道中,需具有一定耐酸、碱能力。胃液酸性环境中胃蛋白酶原被激活,杀死随食物进入胃内的微生物[23]。从表1可以看出,菌株SS-4、SS-10、SS-13、SS-14、SS-17、SS-20、SS-21、SS-22、SS-28、SS-30、SS-31、SS-33、SS-37、SS-42、SS-44、SS-45 ΔOD600nm为0.20~0.44,表现出较强耐酸能力。这是由于乳酸菌在生长代谢过程中产生各种有机酸,使其环境pH值降低,具有较强耐受能力。窦芳娇等[24]从福建长杆白菜泡菜中筛选得到的植物乳杆菌RPC21、鼠李糖乳杆菌RCQ4在pH 2.5环境下培养18 h的ΔOD600nm分别为0.075、0.025,说明本实验筛选得到的乳酸菌具有较强的耐酸能力,在胃部低pH值环境下具有一定生存能力。
2.3 酸笋发酵液中乳酸菌的耐胆盐能力
人体小肠中的胆盐浓度一般为0.03%~0.3%。胆盐耐受能力也是衡量优良菌株的重要指标[25]。由表2可以看出,上述筛选得出的耐酸菌株在含0.1%牛胆盐MRS培养基中的存活率为8.64%~139.77%,所有菌株活菌数均在106CFU/mL以上,其中存活率达80%以上的菌株为SS-10、SS-14、SS-17、SS-31、SS-32、SS-37、SS-44、SS-45,表现出较高的胆盐耐受性。据报道植物乳杆菌200655和KCTC 3108也具有较高的胆盐耐受水平,在0.3%牛胆盐MRS培养基中培养24 h后的存活率分别为102.48%和100.76%[26]。有研究表明,胆盐通过破坏细菌细胞膜的完整性导致细胞死亡,细胞膜中的多种脂质对菌株的胆盐耐受能力具有影响[27]。
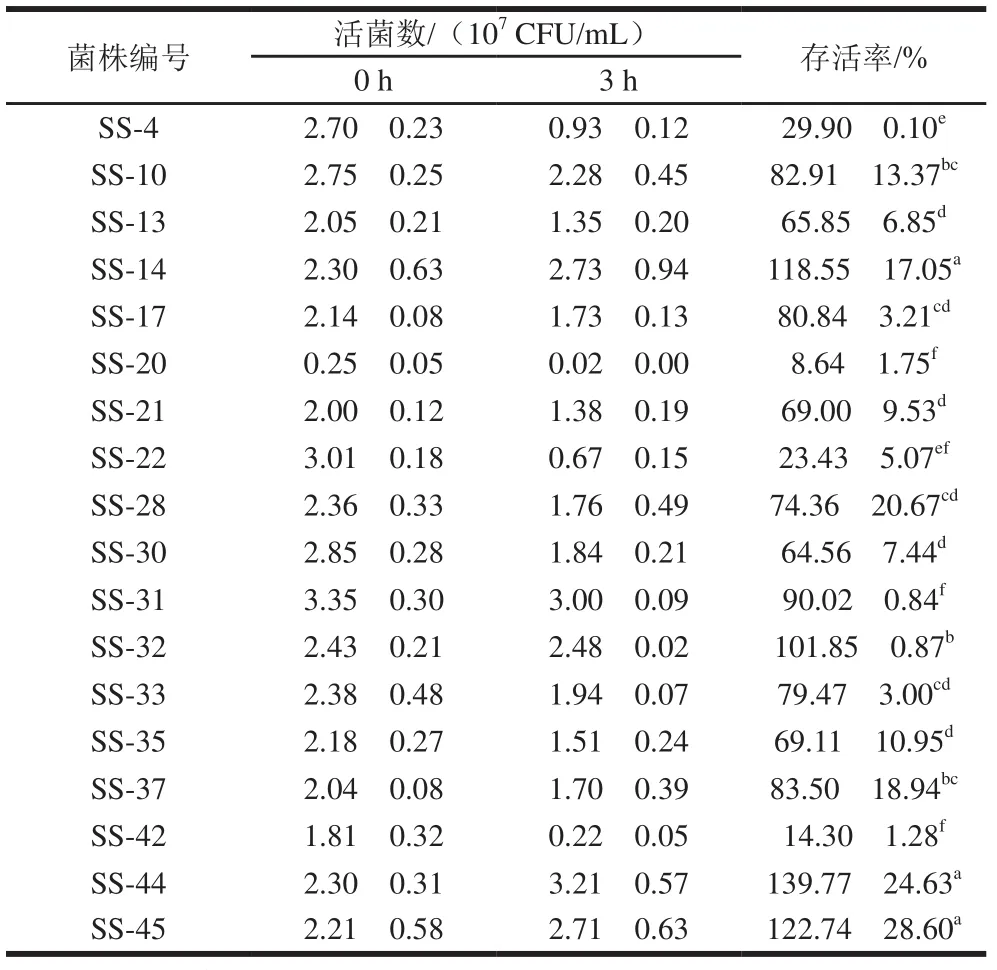
表2 乳酸菌的耐胆盐能力Table 2 Bile salt tolerance of the tested strains
2.4 酸笋发酵液中乳酸菌的耐胃肠道消化能力
胃肠道消化环境复杂,含胃蛋白酶、胰蛋白酶等,能够分解菌体蛋白质,抑制甚至杀死外来微生物。对耐酸、耐胆盐能力较强的8 株乳酸菌通过连续培养方式进行模拟胃肠道消化实验。由表3可以看出,经过2 h人工胃液消化后,所有菌株活菌数均呈下降趋势,但活菌数均保持在107CFU/mL以上,存活率在65%以上,其中SS-32、SS-37、SS-45菌株存活率超过85%,SS-37存活率高达90.59%,表现出较强的耐受能力。
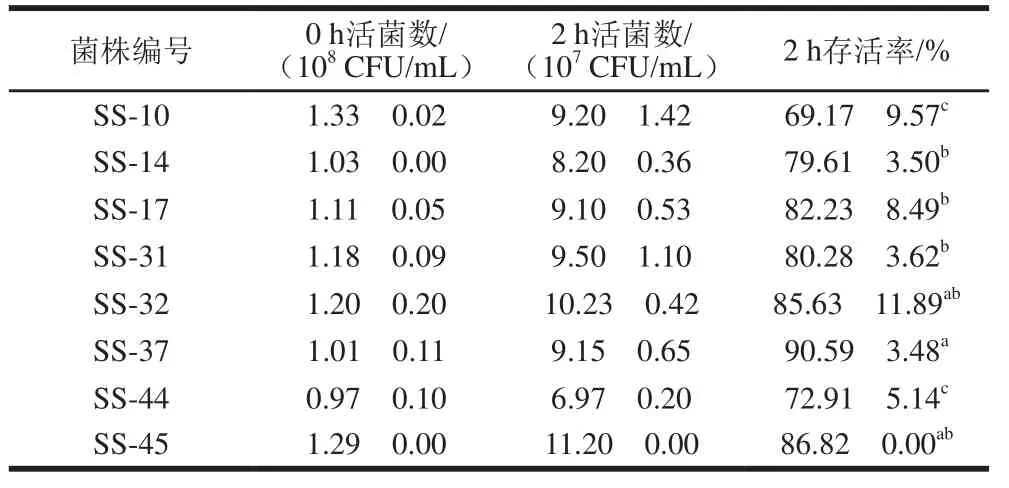
表3 乳酸菌在人工胃液中的耐受性Table 3 Tolerance of LAB in artificial gastric juice
相比于人工胃液消化,人工肠液消化影响更为显著(表4),经过2 h肠液处理后,所有菌株活菌数均较大程度降低,存活率为0.56%~36.67%。SS-17菌株表现出较高的肠道消化耐受能力,而SS-14、SS-37、SS-44存活率均不超过1%。综合分析,筛选得到SS-10、SS-17、SS-31、SS-32、SS-45 5 株菌进入后续实验。
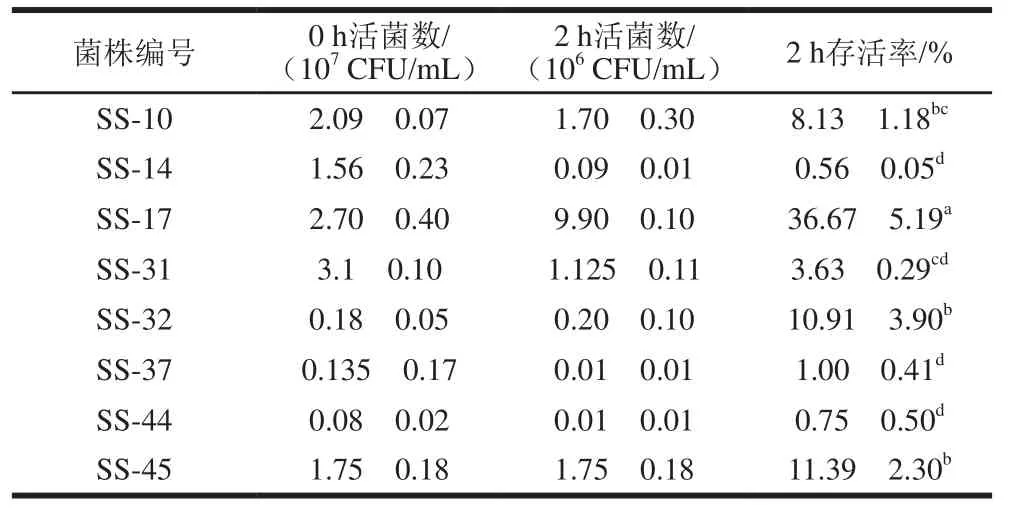
表4 乳酸菌在人工肠液中的耐受性Table 4 Tolerance of LAB in artificial intestinal fluid
不同来源及种类的乳酸菌对胃酸和胆盐的耐受能力不同。杜兰兰等[28]发现类植物乳杆菌L-ZS9经模拟胃肠道消化后,活菌数由109CFU/mL降低至107CFU/mL,而本实验研究中SS-17活菌数由108CFU/mL降低至106CFU/mL。有研究通过细菌微胶囊化保证通过胃肠道过程中的菌体完整性,从而保持其益生活性,充分发挥益生特性[29]。
2.5 乳酸菌的黏附能力分析
益生菌通过黏附肠道细胞定植,竞争性地抑制致病菌与肠壁黏附,从而调节肠道菌群和发挥益生特性[19,30]。由图2可知,不同菌株对HT-29细胞的黏附率在2.21%~4.95%之间,其中SS-45黏附率(4.69%)最高,与鼠李糖乳杆菌LGG(4.95%)无显著差异(P>0.05),其次是SS-31(4.47%)。据报道,短乳杆菌KU15153、植物乳杆菌Ln1、短乳杆菌B13-2对HT-29细胞黏附率分别为5.62%、2.69%、6.11%[31-33]。因此选择SS-17、SS-31、SS-45进行后续实验。

图2 乳酸菌对HT-29细胞的黏附作用Fig.2 Adhesion of LAB to HT-29 cells
2.6 乳酸菌对LPS诱导RAW264.7巨噬细胞释放NO的抑制作用
抑制NO释放是治疗多种炎症性疾病的重要途径。由图3可知,所测菌株在浓度1.0h108CFU/mL时均对RAW264.7细胞无毒性作用,且均能抑制LPS诱导RAW264.7巨噬细胞中NO的产生。阳性对照LGG组NO浓度为7.35 μmol/L,LPS组NO浓度为41.49 μmol/L,与模型组相比,SS-17、SS-31、SS-45组NO浓度分别为11.50、6.11、13.44 μmol/L,表明这3 株菌株均能显著下调LPS诱导RAW264.7巨噬细胞的NO释放量。与LGG相比,菌株SS-31治疗效果更显著(P<0.05)。据报道,从新疆奶酒与青海发酵酸奶中分离筛选得到的乳酸杆菌M5-L与Q8-L对LPS诱导HT-29细胞具有抗炎效果;M5-L与Q8-L活菌体及灭活菌体作用均能显著降低NO分泌水平,其原因可能是活菌体与灭活菌体与LPS结合,导致诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)不能被激活[34]。LPS是革兰氏阴性菌的主要致病成分。当机体受到多种细胞因子或LPS等刺激时,核因子κB(nuclear factor κB,NF-κB)活化,NF-κB抑制因子(inhibitor of NF-κB,IκB)激酶被激活,IκBα/β磷酸化,磷酸化IκB进一步被泛素化,然后被蛋白酶降解,使NF-κB从NF-κB-IκBs复合物中解离并转位入细胞核中进行转录翻译,释放促炎因子及次级炎症介质,从而导致炎症恶性循环,加重炎症反应[35]。
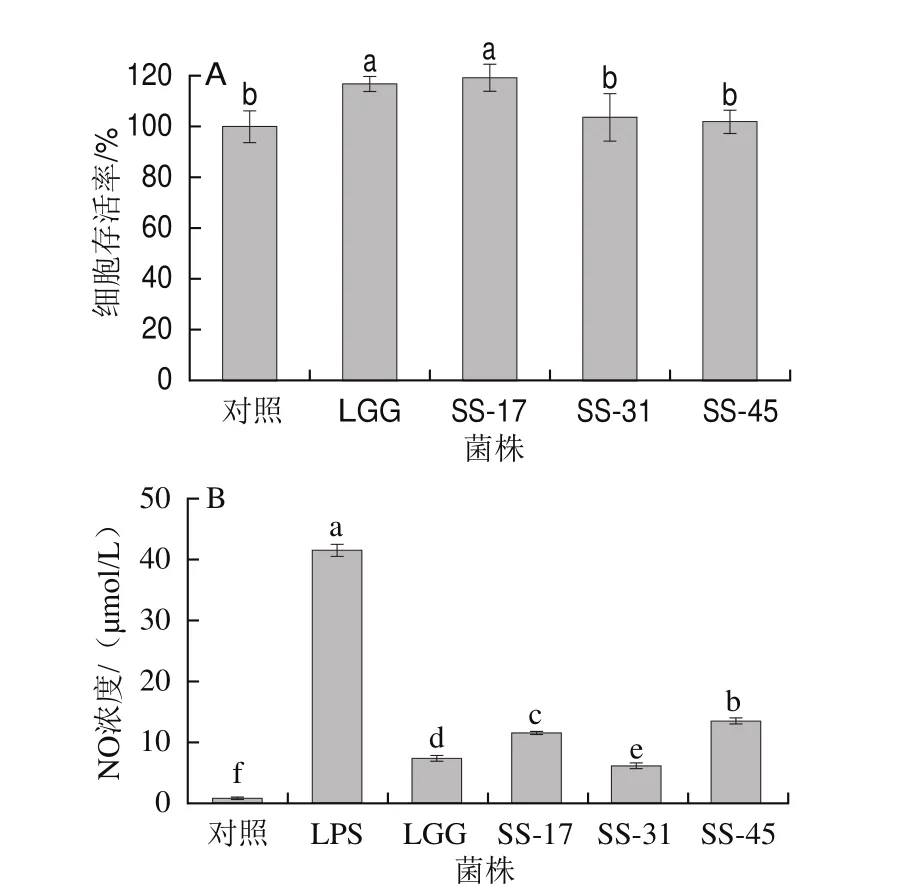
图3 乳酸菌对RAW264.7细胞的细胞毒性(A)及其对LPS诱导释放NO的影响(B)Fig.3 Effect of LAB on the survival rate (A) and NO secretion level (B) of LPS-treated RAW264.7 cells
2.7 SS-31对LPS诱导RAW264.7巨噬细胞释放炎症因子的抑制作用
为进一步研究菌株SS-31对LPS诱导RAW264.7细胞免疫应答的干预作用,本实验检测LPS诱导RAW264.7细胞上清液中炎症因子水平。
如图4所示,LPS诱导RAW264.7细胞分泌大量促炎因子IL-1β和IL-6,乳酸菌SS-31能够显著抑制IL-1β、IL-6分泌(P<0.05),抑制率分别为49.21%、14.12%,且SS-31对IL-1β的抑制效果优于对照组LGG(20.40%),但对IL-6的抑制效果与LGG(13.79%)无显著差异。据报道,发酵乳杆菌CQPC04能有效缓解葡聚糖硫酸钠诱导小鼠结肠炎症状,抑制促炎因子IL-1β、IL-6、肿瘤坏死因子α(tumor necrosis factor,TNF-α)、干扰素γ(interferon-γ,IFN-γ)和IL-12的释放,增加血清中抗炎因子IL-10的释放[14],这与本实验研究结果一致。

图4 乳酸菌SS-31对RAW264.7细胞分泌炎症因子的调节作用Fig.4 Regulation of strain SS-31 on the secretion of inflammatory factors in RAW264.7 cells
2.8 SS-31的16S rRNA基因序列分析
如图5所示,SS-31与Lactobacillus fermentum亲缘性最高,同源性在99%以上,且序列相似性达100%。同时菌株SS-17、SS-45经鉴定也均为L.fermentum,相似性均达100%。

图5 基于16S rRNA 基因序列的乳酸菌系统发育树Fig.5 Phylogenetic tree of strain SS-31 based on 16S rRNA gene sequence
宿主免疫系统第一道防线的中心为巨噬细胞和单核细胞,乳酸菌可刺激巨噬细胞诱导相关细胞因子产生,调节细胞内信号转导,从而调节炎症反应。李川[11]建立2,4,6-三硝基苯磺酸诱导结肠炎小鼠模型发现,从泡菜中筛选得到的植物乳杆菌NCU116通过调整肠道菌群平衡,预防氧化应激对肠道损伤,调节IL-6、IL-12、TNF-α、IFN-γ的释放缓解炎症作用。Zhou Xianrong等[14]发现发酵乳杆菌CQPC04下调促炎因子TNF-α、IFN-γ、IL-1β、IL-6和iNOS的表达,上调促炎因子IL-10,通过抑制NF-κB信号通路从而缓解炎症。Jin Junhua等[9]发现活和热灭活植物乳杆菌Zhang-LL通过保护肠道屏障通透性,维持肠道菌群稳定性减轻大鼠溃疡性结肠炎症状。此外,双歧杆菌BCM、嗜酸乳杆菌LCM[36]也均具有抗炎活性。由于不同地区、来源的乳酸菌所处环境不同,且同属不同种菌株间也存在特异性,所发挥益生特性也不尽相同,因此从酸笋发酵液筛选得到的发酵乳杆菌SS-31的具体抗炎机制还需进一步探究。
3 结 论
发酵食品中乳酸菌资源丰富,安全性高,广泛应用于食品行业,但酸笋发酵液中的乳酸菌资源报道较少。本研究结合传统乳酸菌分离鉴定方法,从柳州采集的3 份酸笋发酵液中共筛选得到46 株革兰氏染色阳性、接触酶阴性的疑似乳酸菌。耐酸、耐胆盐、耐胃肠道以及黏附性实验结果显示,菌株SS-17、SS-31、SS-45在肠道内具有较强存活能力,充分保证了乳酸菌在肠道内定植并发挥益生作用。通过LPS刺激RAW264.7细胞建立炎症模型,3 株菌均不同程度降低细胞上清液中NO水平,但菌株SS-31效果更为显著,且与模型组相比,显著下调促炎因子IL-6、IL-1β水平,并通过16S rRNA测序鉴定为发酵乳杆菌。但其免疫调节的作用机制尚未明确,有待深入研究。本实验结果表明酸笋发酵液可作为筛选具有益生活性乳酸菌的优良来源,发酵乳杆菌SS-31具有作为益生菌的潜力,为后续开发具有广西特色发酵食品提供了菌株资源和理论基础。
