1 株金黄色葡萄球菌烈性噬菌体的生物学特性及其裂解效果
2022-05-09侯忠余李传友朱成林于基成唐俊妮
侯忠余,李传友,朱成林,于基成,唐俊妮,,*
(1.西南民族大学青藏高原研究院,青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;2.西南民族大学食品科学与技术学院,四川 成都 610041;3.大连民族大学 生物技术与资源利用教育部重点实验室,辽宁 大连 116600)
金黄色葡萄球菌(Staphylococcus aureus)属于革兰氏阳性菌,是一种常见的食源性和医院感染的病原菌,会引起轻微皮肤损伤及严重感染,如肺炎、静脉炎、脑膜炎、乳腺炎、泌尿道感染,以及深度感染,如骨髓炎和心内膜炎[1]。耐甲氧西林金黄色葡萄球菌(methicillinresistantStaphylococcus aureus,MRSA)是金黄色葡萄球菌的一种,对半合成青霉素(甲氧西林、苯唑西林等)具有抗药性[1]。自1961年首次分离发现后便在世界各地蔓延,造成巨大经济损失[2]。据报道,全球MRSA携带人数约200~5 300万 人[2]。中国细菌耐药监测网CHINET数据分析显示,仅2019年期间,我国MRSA的平均检出率高达31.40%。由此可见,MRSA感染已经变得愈来愈常见[3-4]。食品工业生产中也存在检出MRSA的案例,涉及的食物有鸡肉[5]、猪肉[6]、牛奶[7]、鱼肉[8]、即食食品[9]等。利用万古霉素可有效治疗MRSA引起的感染,但是随着细菌耐药性日益严重,耐万古霉素的菌株也不断被发现。因此,亟需探寻有效且不易引起细菌耐药性的新型防控方法。
噬菌体是地球上数量可观的一类生物体,具有特异性强、不易引起细菌抗性等特点[10]。近年来,由于细菌耐药性日渐严重,噬菌体在抗菌方面的研究备受关注。金黄色葡萄球菌噬菌体不断被分离出,其中已测序的金黄色葡萄球菌噬菌体就多达390余种[11]。Hsieh[12]和Kishor[13]等在动物实验中证实了金黄色葡萄球菌噬菌体的安全性;Curtin等[14]证实噬菌体可有效抑制细菌生物被膜;Alves等[15]研究也发现,金黄色葡萄球菌噬菌体处理细菌被膜4 h后,被膜清除率为50%以上,处理48 h后生物被膜基本可除净;阮红日等[16]研究表明,在含金黄色葡萄球菌的脱脂牛乳中加入噬菌体,处理24 h后菌落数减少了5.42(lg(CFU/mL)),抗菌效果明显;龙门等[17]研究发现,金黄色葡萄球菌噬菌体JS25处理火腿后,在2 d内金黄色葡萄球菌菌落数直接减少至少2(lg(CFU/mL))。可见,噬菌体是一种可有效替代抗生素治疗的新型抗菌方法。因此,本研究旨在分离可裂解MRSA的噬菌体,探究噬菌体对MRSA生物被膜的影响以及在食品中的初步应用,以期为食品中MRSA的生物防控提供理论依据。
1 材料与方法
1.1 材料与试剂
MRSA菌株ATCC 43300、MRSA 2、MRSA 29[18]、其他受试16 株MRSA菌株[18]和8 株普通金黄色葡萄球菌菌株[19]均为本实验室保存菌株。污水样品采集自四川某奶牛养殖场;脱脂牛奶与牛肉 市售。
BP(Baird-Parker)琼脂培养基、1%亚碲酸钾、LB营养琼脂、营养肉汤培养基 青岛海博生物技术有限公司;胰蛋白胨、酵母粉 英国Oxoid公司;氢氧化钠、浓盐酸、二甲基亚砜、结晶紫、甲醇 天津致远化学试剂有限公司。
SM缓冲液:2 g MgSO4·7H2O、5.89 g NaCl、50 mL pH 7.5 Tris-HCl、2%明胶;磷酸盐缓冲液(phosphate buffered saline,PBS):8 g NaCl、0.2 g KCl、3.58 g Na2HPO4·12H2O、0.245 g K2H2PO4。
1.2 仪器与设备
SW-CJ-2FD超净工作台、pHS-4C pH计 宁波新芝生物科技股份有限公司;UV-6100分光光度计 上海美普达仪器有限公司;Coster 96 孔平底细胞培养板 美国Bio-Rad公司;HZQ-X160恒温振荡培养箱 苏州培英实验设备有限公司;318C+酶标仪 上海沛欧分析仪器有限公司。
1.3 方法
1.3.1 噬菌体初筛菌株的鉴定
以参考菌株ATCC 43300作为质控菌株,mecA基因作为判断MRSA依据,参考王琼等[20]方法提取DNA,对ATCC 43300、MRSA 2 和MRSA 29菌株进行PCR扩增。
扩增引物:上游引物:5’-GTGAAGATATACCAAGTGATT-3’;下游引物:5’-ATGGGGTATAGATTGAAAGGA-3’,理论长度174 bp[21];扩增体系:上、下游引物各1 μL,DNA模板1 μL,1.1hT3 Super PCR Mix 17 μL;扩增程序:98 ℃预变性2 min、98 ℃变性20 s、59 ℃退火10 s、72 ℃延伸30 s,35个循环;72 ℃延伸2 min。
1.3.2 噬菌体的分离纯化
参考文献[22]的分离方法,将采自四川成都某奶牛养殖场不同环境(采奶环境、饲养环境及周边沟渠)污水混合后除杂,采用0.22 μm滤器过滤。取3 株已活化好的MRSA菌液2 mL(OD600nm0.3~0.6)分别与100 mL无菌LB培养基混匀,静置0.5 h后,加入到100 mL污水中,混合液于37 ℃、160 r/min恒温振荡培养箱中振荡过夜,8 000 r/min离心10 min,用0.22 μm滤器过滤除掉细菌,得到噬菌体液。
取100 μL噬菌体液与100 μL对数生长期菌液混合,静置10 min后于EP管中加入5 mL半固体培养基,充分混匀后倒入到LB固体培养基上,冷却后放置于37 ℃恒温培养箱中培养,直至出现噬菌斑。用接种环挑取平板上大而透明的单个噬菌斑于1 mL SM缓冲液中,在37 ℃、160 r/min摇床中过夜,次日将SM缓冲液8 000 r/min离心10 min,10 倍比稀释制双层平板,37 ℃过夜培养后于板上挑出单个噬菌斑,重复上述操作3~5次,可得到大小均一且较纯的噬菌体。双层平板法按式(1)计算初始效价:

1.3.3 噬菌体理化性质的测定
1.3.3.1 噬菌体透射电镜观察
噬菌体样品送至成都里来医学实验中心进行透射电镜观察。
1.3.3.2 噬菌体裂解谱的测定
将16 株MRSA菌株和8 株金黄色葡萄球菌菌液于LB固体平板上均匀涂布,取效价约为108PFU/mL的噬菌体液5 μL点样于涂满菌液的LB平板上[23],待平板晾干后移入恒温培养箱中培养,观察裂解效果。以超纯水点样的LB平板为空白对照。
1.3.3.3 噬菌体最佳感染复数(multiplicity of infection,MOI)的测定
参考Lu等[24]的方法,调整噬菌体效价并固定为106PFU/mL,调节宿主菌浓度使最终MOI分别为10、1、0.1、0.01、0.001,取100 μL噬菌体液和100 μL宿主菌液混合,静置10 min后加入1 mL LB液体培养基,37 ℃恒温振荡培养箱中振荡6 h。采用双层平板法计算效价,效价最高的为最佳MOI。
1.3.3.4 噬菌体一步生长曲线的测定
参考高明明等[25]的方法,按照最佳MOI=0.01,将1 mL噬菌体裂解液和1 mL宿主菌液混合,37 ℃恒温培养箱中静置孵育15 min后,8 000 r/min离心10 min,弃上清液,此时沉淀已有噬菌体吸附,再用LB液体培养基洗涤1~2次,洗去未吸附的游离噬菌体,加入15 mL LB液体培养基,在0~150 min内每隔10 min取样,双层平板法计算噬菌体效价。裂解量按式(2)计算:

1.3.3.5 pH值对噬菌体效价的影响
参考阮红日等[16]的方法,调节SM缓冲液pH值分别为2、4、6、7、8、10、12,取1 mL效价约106PFU/mL噬菌体液分别加入不同pH值SM缓冲溶液中,在37 ℃恒温培养箱中孵育1 h。通过双层平板法测定噬菌体效价。
1.3.3.6 不同温度对噬菌体效价的影响
参考聂若男等[26]的方法,取1 mL效价约108PFU/mL噬菌体裂解液分别于25、30、35、40、45、50、55、60、65、70 ℃水浴1 h,取出处理液,用SM缓冲液作10 倍比稀释后,通过双层平板法测定噬菌体效价。
1.3.3.7 紫外光照射对噬菌体效价的影响
取8 mL效价约108PFU/mL噬菌体液于一次性无菌培养皿中,将培养皿放置于紫外灯下10~20 cm处,分别于照射0、10、20、30、40、50、60、70 min取样1 mL,双层平板法测定噬菌体效价,评价噬菌体对紫外线的敏感性[27]。
1.3.4 噬菌体的应用效果分析
1.3.4.1 不同MOI噬菌体对宿主菌的裂解效果
参考文献[26]的方法,分别按照MOI为10、1、0.1、0.01、0.001,取100 μL噬菌体液、100 μL麦氏浊度0.5的MRSA 2菌悬液加入96 孔板中(总体系200 μL);阴性对照组为不加菌悬液的LB液体培养基200 μL;阳性对照为100 μL菌悬液加100 μL LB液体培养基。加样完成后,将96 孔板移至37 ℃恒温培养箱中培养10 h,每隔1 h在酶标仪中测定OD600nm。
1.3.4.2 噬菌体对细菌被膜清除作用
参考唐俊妮等[28]的被膜形成测定方法,以裂解谱实验中被裂解的菌株为研究对象,选出2 株成膜能力较强的菌株进行研究。生物被膜培养成熟后,将96 孔板取出,用灭菌PBS洗涤2~3次,除去游离菌和菌沉淀。取效价108PFU/mL噬菌体液220 μL加入到96 孔板中,对照组为220 μL胰酪大豆胨液体培养基,将其移至恒温培养箱中继续培养。结晶紫染色法于第0、4、8、12、24、36、48小时测定OD630nm[19]。
1.3.4.3 噬菌体在食品中的初步应用
噬菌体对牛乳中MRSA的抑制作用:根据贾静静[29]及预实验的抗菌效果,将脱脂牛乳中接入MRSA 2菌液,接种量4.57(lg(CFU/mL)),按照最终MOI分别为10 000、1 000、100、0加入噬菌体液,混合液放置于25 ℃恒温振荡培养箱中振荡培养,在第0、2、4、6、8、10、12、24小时分别取1 mL样品溶液加入到9 mL 0.9 g/100 mL生理盐水中,作10 倍稀释,按照GB 4789.10ü2016《食品微生物学检验 金黄色葡萄球菌检验》[30]的计数方法,选择适宜稀释梯度进行BP平板菌落计数。
噬菌体对牛肉中MRSA的抑制作用:参考Huang Chenxi等[31]的方法,将牛肉切成约1 cmh1 cm小块,经高压蒸汽灭菌后,取出肉块于一次性无菌培养皿中冷却、晾干;将牛肉分装到100 mL灭菌锥形瓶中;实验组加入100 μL 103CFU/mL菌液和100 μL效价为107、106、105PFU/mL的噬菌体液,最终MOI分别为10 000、1 000、100;对照组加入100 μL菌液和100 μL SM缓冲液,25 ℃恒温振荡培养箱中振荡培养并于第0、2、4、6、8、10、12、24小时取出锥形瓶,加10 mL生理盐水,充分摇匀后吸取1 mL液体样品作10 倍比稀释,在适宜稀释度进行BP平板计数。
1.4 数据处理
每组实验均重复3次,结果取平均值。采用Excel2016软件进行数据整理,SPSS 2019软件进行方差分析,Origin 2018软件进行图形绘制。
2 结果与分析
2.1 噬菌体初筛菌株的鉴定
如图1所示,菌株ATCC 43300、MRSA 2和MRSA 29 3 株菌均可在174 bp附近形成特异性mecA条带,确认3 株菌均为MRSA菌株。以MRSA 2和MRSA 29作为后续噬菌体初筛菌株。
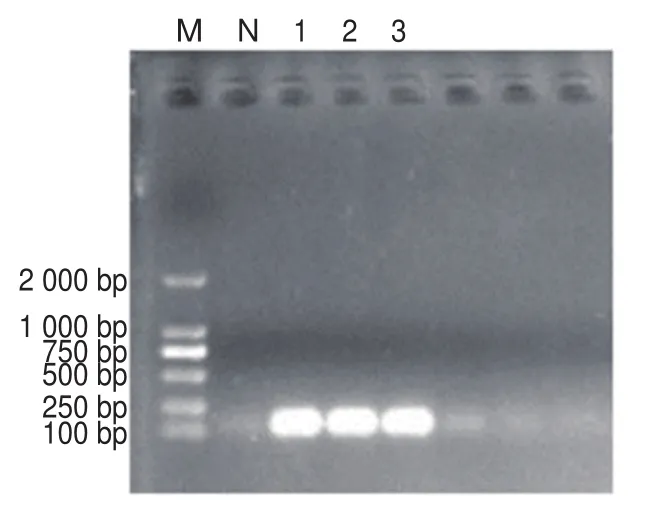
图1 mecA基因的PCR扩增Fig.1 PCR amplification of mecA gene
2.2 噬菌体的分离纯化
从奶牛养殖场采集的污水在经过3次富集后,利用双层平板法观察发现,初筛菌株中在MRSA 2菌株对应的平板上形成了明显、密集且呈圆形透明的噬菌斑(图2A)。进一步将分离得到的噬菌体经过3~5次纯化后,得到斑块透亮、边缘整齐、大小均一、形态一致、纯度较高的噬菌体(图2B),将其命名为P65。经测定,分离的噬菌体效价为1.11h105PFU/mL,进一步增殖后其效价可达1.14h108PFU/mL。

图2 噬菌体在双层平板上形成的噬菌斑Fig.2 Phage plaque formation on a double-layer plate
2.3 噬菌体P65的理化性质
2.3.1 噬菌体透射电镜观察
如图3所示,噬菌体P65头部呈多面体结构,具有非收缩性细长、柔软的尾部,整体长度(236f5)nm、头部直径(71f2)nm、尾部长(165f5)nm。根据冯烨等[32]对噬菌体的分类标准,本实验所分离的噬菌体属于有尾噬菌体目长尾噬菌体科(Siphoviridae)。
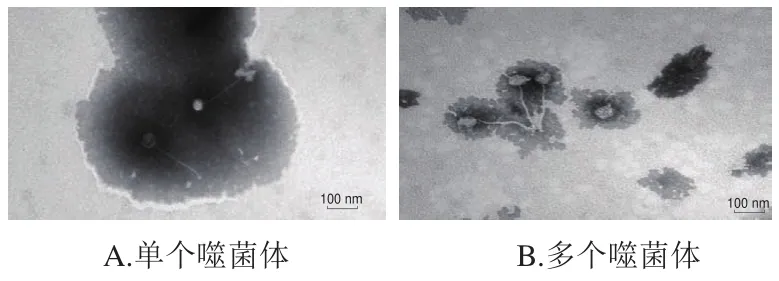
图3 噬菌体P65的形态Fig.3 Morphology of P65
2.3.2 噬菌体P65的裂解谱
对本实验室保存的其他16 株MRSA和8 株普通金黄色葡萄球菌进行宿主范围测定时,发现噬菌体P65除对宿主菌MRSA 2可裂解外,还对MRSA 24和8 株普通金黄色葡萄球菌具有裂解效果,具体裂解情况如表1所示。
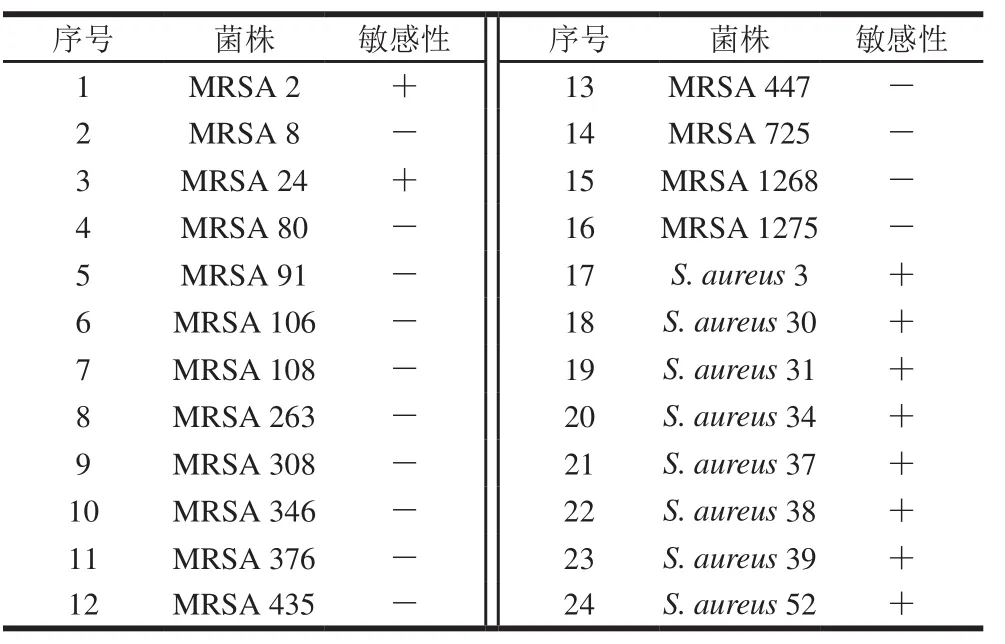
表1 噬菌体P65的裂解谱Table 1 Lysis profile of phage P65
2.3.3 噬菌体P65的最佳MOI
如图4所示,当MOI=1时,噬菌体P65效价最低,当MOI=0.01时,其效价最高,经计算为2.52h108PFU/mL,因此,MOI=0.01为噬菌体P65的最佳MOI。

图4 噬菌体P65的MOIFig.4 Determination of MOI
2.3.4 噬菌体P65的一步生长曲线
如图5所示,噬菌体和宿主菌混合后侵染0~10 min内,噬菌体增殖不明显,可判断噬菌体P65的潜伏期为10 min;在10 min后噬菌体开始大量增殖,80 min后开始趋于平缓,100 min时达到最大值,此时噬菌体效价为3.83h109PFU/mL。可见,噬菌体P65的裂解周期为90 min;裂解量为35.46 PFU/cell。
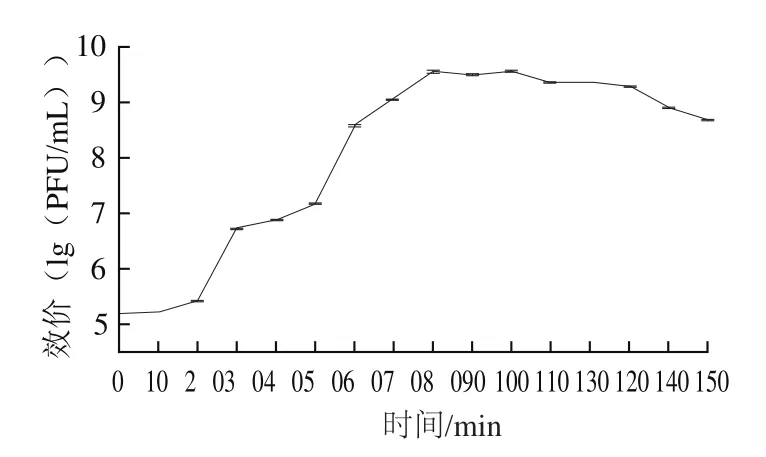
图5 噬菌体P65的一步生长曲线Fig.5 One-step growth curve of phage P65
2.3.5 pH值对噬菌体P65效价的影响
如图6所示,在pH 2时噬菌体P65全部失活;当pH 4、6、7、8、10时噬菌体P65耐受性变化较小,在pH 12时其活性受到明显抑制。本实验分离的噬菌体P65具有一定的耐酸碱性,且最适pH值为8。

图6 pH值对噬菌体效价的影响Fig.6 Effect of pH on phage titer
2.3.6 温度对噬菌体P65效价的影响
如图7所示,噬菌体P65在不同温度水浴中处理1 h后,其活性受温度影响显著。噬菌体P65的最适生长温度为30~45 ℃,当温度高于45 ℃时,噬菌体活性开始下降;当温度为70 ℃时,噬菌体失活。本实验分离到的噬菌体P65耐高温性一般,耐受温度为65 ℃。

图7 温度对噬菌体效价的影响Fig.7 Effect of temperature on phage titer
2.3.7 紫外线照射对噬菌体P65效价的影响
如图8所示,噬菌体P65在紫外线照射处理后,其活性逐渐呈下降趋势,紫外线照射处理70 min后,噬菌体P65效价由0 min的1.91h108PFU/mL降至2.65h104PFU/mL。

图8 紫外线照射对噬菌体效价的影响Fig.8 Effect of ultraviolet radiation on phage titer
2.4 噬菌体P65的应用效果探索
2.4.1 不同MOI噬菌体对宿主菌的裂解效果
如图9A所示,阳性对照曲线10 h内一直保持上升趋势;与阳性对照相比,不同MOI噬菌体均可很好地抑制宿主菌MRSA 2的生长。0~2 h内,由于噬菌体数量较少,实验组与阳性对照组差异不明显;但3 h后实验组OD600nm明显下降,与阳性对照组差异显著(P<0.01),说明期间噬菌体抑菌效果好。如图9B所示,噬菌体对宿主菌控制效果较好,细菌培养液澄清。

图9 不同MOI噬菌体对宿主菌MRSA 2的裂解曲线(A)和裂解效果(B)Fig.9 Influence of MOI on the lytic effect of phage P65 on the host MRSA 2
2.4.2 噬菌体对细菌被膜的清除效果
如图10所示,噬菌体P65对宿主菌MRSA 2和MRSA 24的生物被膜形成均有较好的清除作用。生物被膜经噬菌体处理培养4 h后,MRSA 2和MRSA 24的OD630nm分别由0 h的0.935、0.966降低至0.364、0.340,此时被膜清除率分别为61.0%、64.8%,随培养时间延长,OD630nm逐渐降低,培养48 h,MRSA 2和MRSA 24的被膜清除率分别达91.3%和92.2%,清除效果非常明显。

图10 噬菌体P65对细菌生物被膜的清除效果Fig.10 Effect of phage treatment on the removal of bacterial biofilms at different culture times
2.4.3 噬菌体在食品中的初步应用效果
2.4.3.1 噬菌体对脱脂牛乳中MRSA 2的抑制效果
如图11所示,随时间的延长,对照组MRSA 2菌落数不断上升,在第24小时菌落数达9.25(lg(CFU/mL));MOI=100组的抑菌效果和对照组无显著差异(P>0.05);MOI=10 000、MOI=1 000组在0~6 h内,菌落数呈下降趋势,在第6小时菌落数较对照组分别减少了2.68、1.99(lg(CFU/mL));6 h后所有实验组菌落数均呈上升趋势。可见,噬菌体在牛乳贮藏前期具有较明显的抑菌作用,且噬菌体浓度越高,抑菌效果越好,但随时间延长噬菌体的抑菌效果可能受牛乳中成分的影响而减弱。
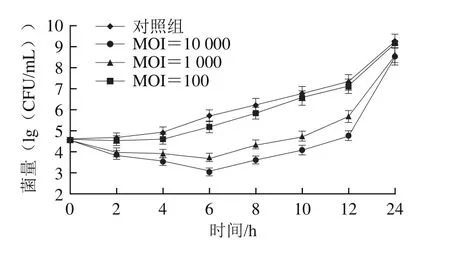
图11 噬菌体在脱脂牛乳中的抑菌效果Fig.11 Antibacterial effect of phage P65 in skimmed milk contaminated with MRSA 2
2.4.3.2 噬菌体对牛肉中MRSA 2的抑制作用
如图12所示,在0~24 h内,对照组菌落数由3.32(lg(CFU/mL))增至7.05 (lg(CFU/mL));MOI=10 000组抑菌效果比较明显,第12小时菌落数较对照组(6.75(lg(CFU/mL)))减少了2.60(lg(CFU/mL))。MOI=1 000组在第12小时较对照组减少了2.08(lg(CFU/mL));MOI=100组抑菌效果相对最差。

图12 牛肉中噬菌体的抑菌效果Fig.12 Antibacterial effect of phage P65 in beef contaminated with MRSA 2
3 讨 论
噬菌体在养殖业、食品工业、检测技术、医疗业等领域都有较好的应用前景[21-22]。2006年,美国食品药品管理局允许在食品加工过程中使用一定数量的噬菌体,开启了噬菌体在食品应用中的关键一步[33];在后续噬菌体研究中,科研人员发现噬菌体在乳、肉、蔬菜等方面均具有较好的抗菌效果[34],表明未来噬菌体在食品生产加工中应用潜力巨大。
本研究分离1 株能够裂解MRSA的噬菌体P65,通过透射电镜观察发现P65属于有尾噬菌体目长尾噬菌体科;其初始效价为1.1h105PFU/mL,与涂尊方[35]和范锦戴[36]等分离的噬菌体相比效价较低,可能是由于菌株间存在差异性;经进一步优化增殖后,噬菌体P65效价提高到1.14h108PFU/mL。裂解谱测定发现噬菌体P65可裂解2 株MRSA和8 株金黄色葡萄球菌,裂解谱相对较窄。噬菌体P65的最佳MOI为0.01,与鞠磊等[37]分离噬菌体qdsa002的MOI一致,与阮红日等[16]分离噬菌体vB_SauM_RS MOI有差异,分析原因可能与不同宿主菌株差异有关。由一步生长曲线可知噬菌体P65潜伏期为10 min、裂解周期为90 min、裂解量为35.46 PFU/cell,与Xu Yue[38]和Wang Zhaofei[39]等分离的噬菌体裂解特性相似。温度和pH值是影响噬菌体活性的关键因素,本研究中噬菌体P65与葛志毅等[40]分离的噬菌体vB_SauS_SAP3对pH值和温度的耐受性相似。噬菌体P65最适温度为30~45 ℃,在70 ℃基本失活;pH 4~10时噬菌体活性较稳定,pH 2时噬菌体基本失活,说明噬菌体P65耐酸性不强。因此,可考虑将噬菌体与碱性消毒剂联合使用效果更好。噬菌体P65随着紫外线照射时间延长,其活性逐渐下降,照射70 min后,P65效价由初始1.91h108PFU/mL降低至2.65h104PFU/mL,对比于龙等[27]对大肠杆菌噬菌体研究结果,发现噬菌体P65对紫外线耐受性较强,可能与噬菌体自身特性有关。钱新杰等[41]分离的噬菌体PNJ1809-13、PNJ1809-13对细菌生物被膜的清除率为78%和30%,本研究中成熟生物被膜经P65(108PFU/mL)处理,仅处理4 h,MRSA 2、MRSA 24的被膜清除率分别为61.0%和64.8%,处理48 h清除率分别高达91.3%和92.2%,说明本研究分离的噬菌体P65对MRSA的生物被膜清除率高、效果好。贾静静[29]报道提高牛奶中噬菌体的效价可有效杀灭致病菌。本研究中,噬菌体P65并不能完全杀灭牛奶中MRSA,在0~6 h内,MOI=10 000组和MOI=1 000组的MRSA菌落数均减少,且效价越高,抑菌效果越好;但6 h后对MRSA的清除效果不明显,分析原因可能是牛乳中的成分对细菌起到保护作用,影响了噬菌体的裂解效果。在牛肉抑菌实验中, MOI=10 000、MOI=1000组抑菌效果较明显,在第12小时菌落数比对照组分别减少了2.60、2.08(lg(CFU/mL)),而MOI=100组效果相对较差。尽管噬菌体对牛肉和脱脂牛乳中MRSA均具一定的抑菌效果,但并未能彻底杀灭致病菌,原因可能与食物基质有关,牛肉中的脂肪[42]或牛乳中的乳清蛋白、抗病毒活性成分干扰噬菌体[43]。未来还需进一步探索P65对不同食物基质中MRSA的清除效果。
噬菌体作为一种天然抗菌剂,在自然界中广泛存在,具有裂解周期短、不易引起耐药性、特异性强等许多优势,在抗菌方面应用潜力巨大。但噬菌体宿主范围窄是噬菌体应用的一大难题。目前,解决噬菌体宿主范围窄的问题通常是由多种宿主范围不同的噬菌体混合制成“噬菌体鸡尾酒”治疗细菌感染。但宿主受体类型的鉴定耗时、耗力,会增加噬菌体制剂选配的成本和时间。因此噬菌体库的建立将有利于加速宿主受体的鉴定,促进噬菌体宿主受体在“噬菌体鸡尾酒”选配和噬菌体治疗中发挥更大作用。目前,已有部分噬菌体库陆续建立[44],但仍需要完善。此外,对噬菌体尾丝或尾针上的受体结合蛋白可变区域进行突变,可以获得宿主范围更广的突变噬菌体,感染更多种类的细菌,而不会影响它们的裂解活性[45],因此基因工程噬菌体是未来噬菌体治疗的重要研究方向。联合应用其他抗菌剂也一定程度弥补了噬菌体的不足,但不是所有复合法都优于噬菌体的单独使用,因此一种合理的复合减菌方式仍有待探索[46]。此外,我国缺乏噬菌体产品生产和制造的标准和相关法规,需建立一套完善的噬菌体应用安全评价体系以保证噬菌体生产应用中每个环节的安全性。
本研究以MASR菌株为宿主菌,从奶牛养殖场不同环境污水中成功分离到的烈性噬菌体P65,可裂解MASR和其他金黄色葡萄球菌,为噬菌体作为天然抗菌剂的应用奠定一定基础。
