基于转录组揭示底酸促进巴氏醋杆菌产酸的分子机制
2022-05-09葛正凯苏聪燕徐晓裕史学伟
李 甜,葛正凯,陈 宇,苏聪燕,徐晓裕,史学伟,王 斌*
(石河子大学食品学院,新疆 石河子 832001)
醋酸菌是一类能将乙醇转化为醋酸的专性好氧革兰氏阴性菌,广泛分布于含糖和含乙醇的酸性环境中,是酿造食醋的主要菌种[1]。醋酸发酵过程中,醋酸菌在乙醇脱氢酶(alcohol dehydrogenase,ADH)的催化下将乙醇氧化为乙醛,进一步在乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)的催化作用下将乙醛氧化为乙酸,积累大量醋酸[2]。到目前为止,醋酸菌已被鉴定出19个属和92个种,其中,用于酿造食醋的醋酸菌主要来自醋酸杆菌属和驹形杆菌属[3]。醋酸杆菌主要用于酿造酸度较低的米醋和果醋,而驹形杆菌则用于酿造酸度较高的酒精醋[3-4]。巴氏醋杆菌是我国醋制品酿造过程中的主要微生物之一,尤其是巴氏醋杆菌CICC 20001广泛应用于食醋和各类果醋饮料发酵,如葡萄醋、山楂醋和荔枝蜜醋等[5-7]。
醋酸是一种高效的抗菌化合物,可防止发酵食品中腐败性和致病性微生物的生长[8]。当细胞中醋酸的体积分数达到0.5%时会产生细胞毒性,破坏细胞膜的生理功能,不利于菌株的生长及代谢活动,而醋酸菌则能生产和耐受较高浓度醋酸,表现出较强的耐酸特性[9]。醋酸菌耐酸分子机制成为醋酸菌代谢研究热点之一。研究表明,醋酸菌能通过细胞膜保护机制[10]、醋酸同化[11],ABC转运蛋白系统[12]和分子伴侣[13]等途径抵抗醋酸对醋酸菌的毒害性作用。原核生物对酸变化的应答体现在从基因水平到表型水平的多个层次上,而转录水平是其中关键的一环。转录组是不同类型细胞或组织在不同条件下所包含的不同基因表达谱,即全部转录本的序列信息[14]。目前,转录组学已广泛应用于全面探究生物体的复杂生命活动。Sakurai等[15-16]采用转录组学方法探讨了醋酸菌在不同碳源和含乙醇培养基上生长过程中基因表达谱的变化。Xia Kai等[17]利用转录组学方法研究了巴氏醋杆菌Ab3在高酸胁迫下的响应机制。
尽管醋酸菌能生产醋酸,发酵过程中产生的醋酸对醋酸菌仍会产生一定毒性,导致醋酸菌的生长和产酸效率低下。因此,实现醋酸菌细胞适应度与醋酸合成之间的平衡是提高醋酸产率的关键挑战。食醋发酵过程中,添加一定量底物醋酸能提高醋酸菌产酸速率,缩减生产成本[18]。研究表明添加0.5%底物醋酸能提高巴氏醋杆菌产酸效率,但底物醋酸促进巴氏醋杆菌产酸的分子机制仍不清晰[19]。本实验选择体积分数0.5%底物醋酸并采用转录组学方法,通过筛选差异表达基因和代谢通路分析,探讨添加底物醋酸促进巴氏醋杆菌产酸的分子机制,旨在为提高醋酸菌发酵产酸速度提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
所用菌株为巴氏醋杆菌CICC 20001,购自中国工业微生物菌种保藏管理中心。
1.1.2 培养基与试剂
GYPE培养基:1 g/L葡萄糖、2 g/L蛋白胨、5 g/L酵母浸粉、6%无水乙醇;GYPA培养基:1 g/L葡萄糖、2 g/L蛋白胨、5 g/L酵母浸粉、6%无水乙醇、0.5%无水乙酸。pH值自然,121 ℃灭菌20 min。
葡萄糖、蛋白胨、酵母浸粉 天津盛奥化学试剂有限公司;无水乙醇、无水乙酸 天津风船化学试剂科技有限公司;RNAprep Pure培养细胞/细菌总RNA提取试剂盒、TIANGEN®试剂盒 北京天根生化科技有限公司;Ribo-zeroTM试剂盒 美国Epicentre公司。
1.2 仪器与设备
XFH-50CA全自动高压灭菌锅 浙江新丰医疗器械有限公司;BCM-1000/1300/1600A超净工作台 苏州安泰空气技术有限公司;BSD-YX3400立式双层智能精密型摇床 杭州俊升科学器材有限公司;GL-20G-II型高速冷冻离心机、Nanodrop 2000C核酸蛋白检测仪 赛默飞世尔科技(中国)有限公司;UV-1750型紫外-可见分光光度计 日本岛津公司;2100生物分析仪 安捷伦科技(中国)有限公司;GeI Doc XR+凝胶成像系统 美国伯乐公司。
1.3 方法
1.3.1 种子液的制备
将保藏在甘油管中的菌株接种在100 mL GYPA培养基中进行活化。当培养液发酵到达对数期(OD660nm>0.5)时,取5 mL培养液接种至100 mL新鲜的GYPA培养基中。当新转接的GYPA培养基发酵达到对数期时,将培养液倒入50 mL离心管中,4 ℃、8 000 r/min离心10 min,去除上清液,并加入50 mL GYPE培养基构成种子液。此实验培养液均在170 r/min、30 ℃摇床中培养,实验中所用的无水乙醇及无水乙酸均用0.22 μm有机滤膜进行过滤处理。
1.3.2 添加底物醋酸启动醋酸发酵生长曲线和产酸曲线的测定
向100 mL的GYPE培养基中分别加入不同体积分数(0%和0.5%)醋酸溶液,取5 mL种子液于上述培养基中进行发酵,每隔24 h取样。在波长660 nm处测定体积分数0%和0.5%底物醋酸溶液发酵时的吸光度。以OD660nm为纵坐标,培养时间为横坐标,绘制醋酸发酵生长曲线,观察其生长情况。用5 g/L的酚酞作指示剂,0.1 mol/L的氢氧化钠溶液进行滴定至微粉色并且30 s后不变色即为滴定终点量。以醋酸的净增加量为纵坐标,培养时间为横坐标,绘制不同底酸启动醋酸发酵的产酸曲线,观察各个培养物之间的产酸情况。产酸量[19]按下式计算:
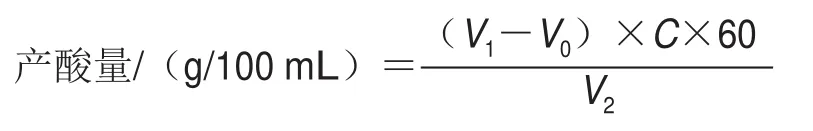
式中:V0为未发酵样液消耗的氢氧化钠溶液体积/mL;V1为发酵样液消耗的氢氧化钠溶液体积/mL;V2为取样体积/mL;C为氢氧化钠溶液的浓度/(mol/L);60为醋酸的摩尔质量/(g/mol)。
1.3.3 转录组分析
1.3.3.1 RNA样品的制备
从种子液中取5 mL培养液分别加入GYPE和GYPA培养基中进行发酵。以不加醋酸的发酵为对照组,以添加0.5%底物醋酸的发酵为实验组,分别在巴氏醋杆菌发酵早期(1 d)和中后期(7 d)4个点进行取样,每个样品设置3次平行。将发酵液倒入50 mL离心管中,4 ℃、8 000 r/min离心10 min收集菌体,迅速放入液氮中速冻,之后转移至-80 ℃保存备用。
1.3.3.2 RNA的提取,文库建立及转录测序
采用Trizol法提取醋酸菌细胞中的总RNA[20]。使用1%琼脂糖凝胶电泳检测总RNA的完整性以及是否有gDNA的污染,使用核酸蛋白检测仪检测RNA的纯度(OD260/280=1.8~2.2),以及生物分析仪精确检测RNA的完整性(Rin>6.5)。质量合格的RNA样品用于文库构建,通过Ribo-zeroTM试剂盒去除rRNA,并将mRNA片段化,以mRNA为模板,添加dNTP将其反转录成cDNA。双链cDNA先进行末端修复、加A尾和接头,再进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,并纯化PCR产物,得到最终的文库。库检合格后,把不同文库按照有效浓度及目标下机数据量的需求pooling后进行Illumina HiSeqTM2500测序。高通量测序得到的样本转录组数据经过CASAVA碱基识别分析转化为原始序列Raw reads。对Raw reads进行过滤,除去里面含有接头的Reads、去除N的比例大于10%的Reads和除去低质量的Reads后,获得Clean reads,以保证信息分析质量。从基因组网站直接下载A.pasteurianusIFO 3283-01的参考基因组和基因模型标注文件(https://www.ncbi.nlm.nih.gov/nuccore/NC_013209.1?report=fasta)。使用Bowtie 2建立参照基因组指数和将Clean reads与参照基因组比对,获取其在参考基因组上的位置信息。
1.3.3.3 基因差异表达分析和富集分析
采用HTSeq对各样品进行基因表达水平分析,根据每百万碎片中来自某一基因每千碱基的转录本所包含的碎片数目(fragments per kilobase million,FPKM)计算每个基因的表达水平[21]。考察添加0%和0.5%底物醋酸时发酵早期(Z2 vs Z1;Z2为加0.5%底物醋酸发酵1 d,Z1为不加醋酸发酵1 d)和发酵中后期(F2 vs F1;F2为加0.5%底物醋酸发酵7 d,F1为不加醋酸发酵7 d)的差异表达基因。利用edgeR对结果进行差异表达分析并获得差异表达基因(differentially expressed genes,DEGs)[22]。选择显著DEGs的标准如下:1)|log2Fold Change|>1.0,2)统计学显著性水平P<0.05;使用SPSS 25.0进行显著性分析。通过基因本体(Gene Ontology,GO)富集分析(http://www.geneontology.org)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析(http://www.genome.jp/kegg/)获得基因注释列表。
2 结果与分析
2.1 添加底物醋酸对巴氏醋杆菌发酵的影响
本课题组前期研究表明,加入一定浓度的底物醋酸能够促进醋酸发酵,但底酸促进醋酸发酵的分子机理尚不明确[19]。本实验以不添加底物醋酸为空白对照,考察添加0.5%底物醋酸对巴氏醋杆菌CICC 20001发酵过程中菌体生长和产酸的影响。
由图1可知,巴氏醋杆菌CICC 20001的生长量与发酵时间呈正相关,并且0.5%底物醋酸添加量下的生长量高于不加醋酸的对照组。添加0.5%底物醋酸时,巴氏醋杆菌CICC 20001的产酸量明显高于空白对照,增加的趋势具有显著性。由此可见,添加合适体积分数醋酸可以促进巴氏醋杆菌CICC 20001的发酵,但是底酸的添加量与醋酸的产量并不呈正相关[23]。选择发酵第1天(发酵早期)和第7天(发酵中后期)取样以获取转录组样品。
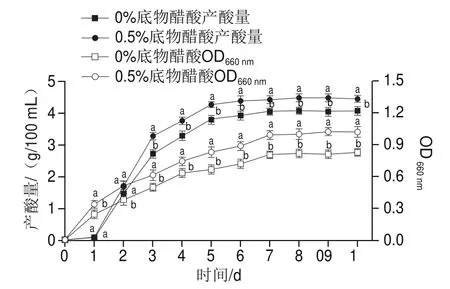
图1 添加底酸对巴氏醋杆菌CICC 20001生长和产酸的影响Fig.1 Effect of exogenous acid addition on the growth and acid production of A.pasteurianus CICC 20001
2.2 转录组测序数据的质控
转录组测序得到的原始序列会存在低质量的reads,需要对原始数据进行质量控制,以保证后续分析的质量。由表1可知,样本间基因组的GC质量分数均在55%左右,错误率均不大于0.02%,测序质量分值Q30均在90%以上,说明测序原始数据结果可靠,可进行后续生物信息学分析。
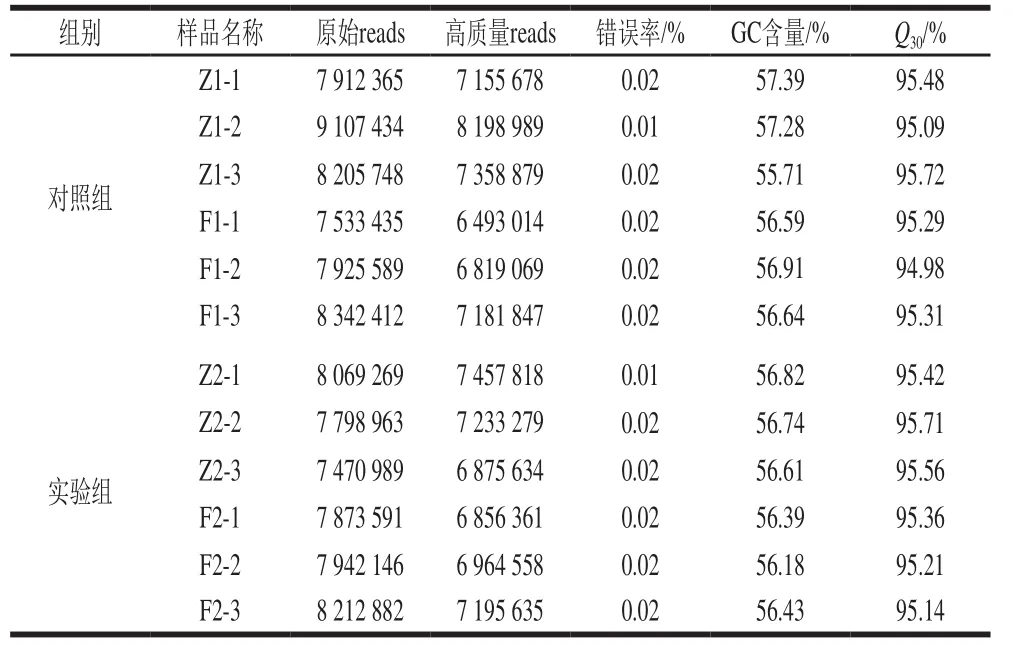
表1 巴氏醋杆菌CICC 20001转录组测序数据统计Table 1 Statistical analysis of transcriptome sequencing data of A.pasteurianus CICC 20001
2.3 醋酸发酵过程中DEGs分析
通过DEGs的筛选有助于发现基因的功能,更有助于揭示某些现象的分子机制。添加底物醋酸启动醋酸发酵早期(Z2 vs Z1)表达出的基因共有2 247个,其中显著性的DEGs有412个,包括394个上调基因和18个下调基因;而在中后期(F2 vs F1)共检测出2 240个基因,其中显著性差异表达的基因有70个,包括30个上调基因和40个下调基因(图2A)。在醋酸发酵早期和中后期表达的总基因数量无明显差异,而显著DEGs数量差异较大。由图2B可知,有36个显著DEGs在醋酸发酵中共表达,有376个显著DEGs只在醋酸发酵早期表达,34个显著DEGs只在醋酸发酵中后期表达。转录组数据表明,在巴氏醋杆菌CICC 20001发酵早期,显著上调的基因多于下调的基因数目,而在巴氏醋杆菌CICC 20001发酵的中后期,显著下调的基因略多于上调基因数目。这些在发酵早期上调的基因和中后期显著差异表达的基因可能是潜在的促进巴氏醋杆菌CICC 20001产酸的关键基因。同时在加入低添加量醋酸后,与醋酸发酵中后期相比,在发酵早期细胞内基因的表达变化较为明显,说明底物醋酸可能在醋酸发酵早期发挥更重要的作用。
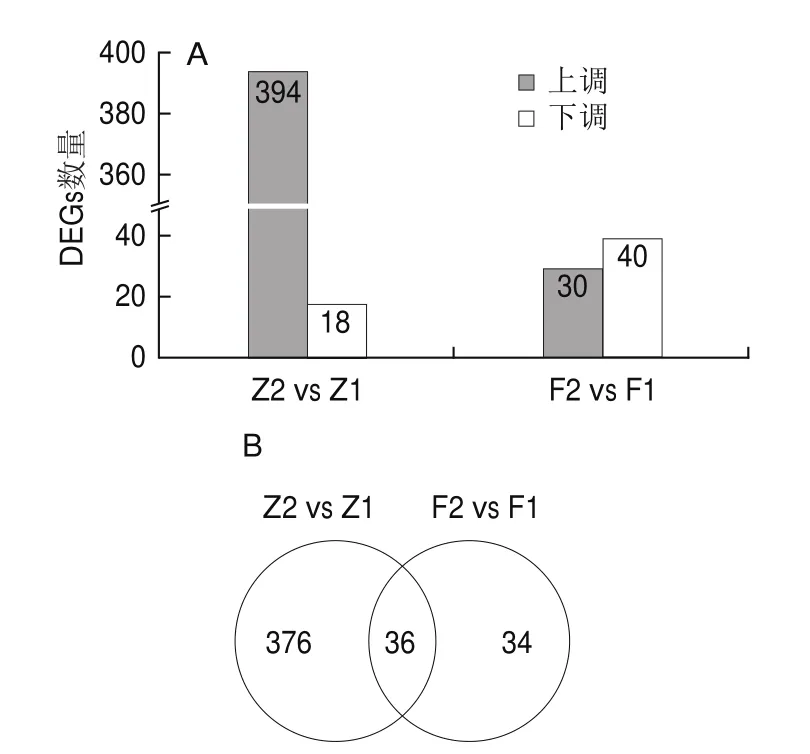
图2 添加底酸促进巴氏醋杆菌CICC 20001发酵过程中DEGs表达情况Fig.2 Differential gene expression induced by exogenous acetic acid during fermentation of acetic acid by A.pasteurianus CICC 20001
2.4 GO功能富集分析和KEGG通路富集分析
2.4.1 醋酸发酵早期的DEGs富集分析
随着我国刨花板行业不断淘汰部分落后产能,新增先进生产线,质量不断提高,产量也有增加,刨花板出口出现增长。今年前3季度累计,我国刨花板出口量完成17.4万t,比上年同期增长18.29%。出口金额同比增加9.74%,主要出口到蒙古、印度和我国台湾省等。
GO是描述基因功能的综合性数据库,GO数据库把基因的本体分为3类,即生物过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)。将412个DEGs与GO数据库进行比对,得到256个GO条目。根据P-value分别在BP、CC、MF中筛选部分GO条目进行分析,如图3所示。
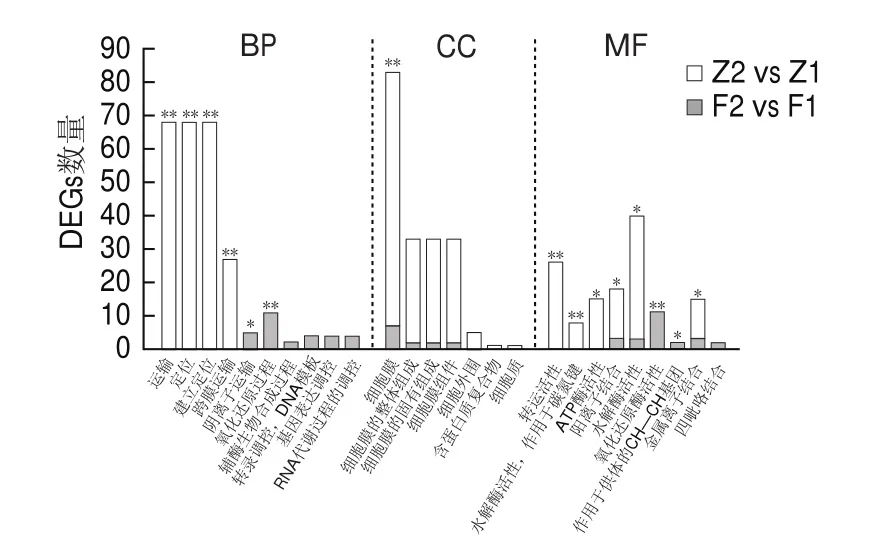
图3 添加底酸促进巴氏醋杆菌CICC 20001醋酸发酵的GO富集分析Fig.3 GO enrichment analysis of DEGs induced by exogenous acetic acid in acetic acid fermentation by A.pasteurianus CICC 20001
由图3可知,在醋酸发酵早期的DEGs显著富集在BP过程的运输、定位、建立定位和跨膜运输;CC过程的细胞膜;MF过程的转运活性、ATP酶活性、水解酶活性和阳离子活性等功能。结果表明,DEGs主要与醋酸发酵的跨膜运输过程、细胞膜、转运活性和酶活性等有关,说明低浓度底酸处理可能会影响巴氏醋杆菌的物质转运及相关酶的活性。
KEGG是整合了基因组、化学和系统功能信息的综合性数据库。为了进一步了解基因的生物学功能,通过KEGG数据库对细胞内DEGs进行功能分析。醋酸发酵早期阶段的DEGs共涉及42 条通路,根据P-value筛选出前20 条通路进行分析。如图4所示,圆圈代表注释到KEGG通路上的基因数目,颜色从蓝到红代表富集的显著性大小(以-lg(P-value)计算)。发现显著富集的几个被注释的信号通路为烟酸和烟酰胺代谢、ATP结合盒式转运蛋白(ATP-binding cassette,ABC)转运蛋白、双组分体系(two-component systems,TCSs)、精氨酸生物合成、丙酸代谢等。研究发现,低体积分数底酸对醋酸发酵早期的辅因子和维生素代谢、氨基酸代谢、碳水化合物代谢、膜运输以及信号转导等通路均有影响。因此,推测与跨膜运输相关的DEGs可能在醋酸发酵早期的代谢机制中起重要调节作用。
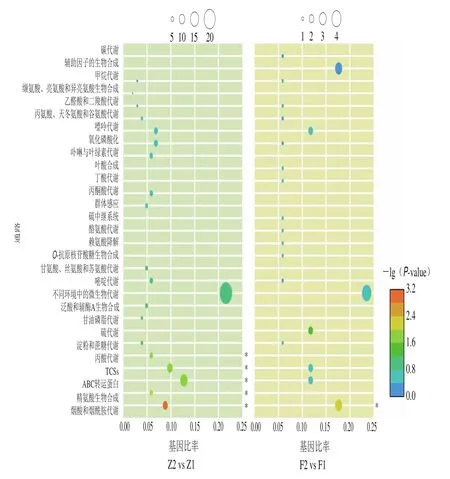
图4 添加底酸促进巴氏醋杆菌CICC 20001醋酸发酵的KEGG富集分析Fig.4 KEGG enrichment analysis of DEGs induced by exogenous acetic acid in acetic acid fermentation by A.pasteurianus CICC 20001
2.4.2 醋酸发酵中后期的DEGs富集分析
对醋酸发酵中后期的70个DEGs进行GO富集分析得到21个GO条目,根据P-value分别在BP、CC、MF中筛选部分GO条目进行分析。如图3所示,这些DEGs主要富集在BP过程的氧化还原过程和调控过程;CC过程的细胞膜、细胞膜的整体组成、细胞膜的固有组成以及细胞膜组件;MF过程的氧化还原酶活性、金属离子结合和阳离子结合等功能。结果表明醋酸发酵中后期阶段的DEGs主要与细胞的调控过程、细胞膜和氧化还原活性等有关,进而在此阶段可能会对巴氏醋杆菌的生长代谢进程造成影响。
对醋酸发酵中后期的DEGs进行KEGG通路分析,共涉及21 条通路。如图4所示,数量较多的几个被注释的信号通路为烟酸和烟酰胺代谢、硫代谢和TCSs等。研究发现,低添加量底酸对醋酸发酵中后期的辅因子和维生素代谢、能量代谢和信号转导等均有影响。因此,推测与物质代谢和能量代谢相关的DEGs可能在醋酸发酵中后期发挥一定的作用。
2.5 底酸促进巴氏醋杆菌醋酸发酵的分子机理
通过GO富集分析和KEGG通路分析,发现ABC转运蛋白、尿素代谢、TCSs、丙酸代谢和能量代谢等途径对醋酸发酵过程影响较大,并从以上通路中找出重要基因如表2所示。
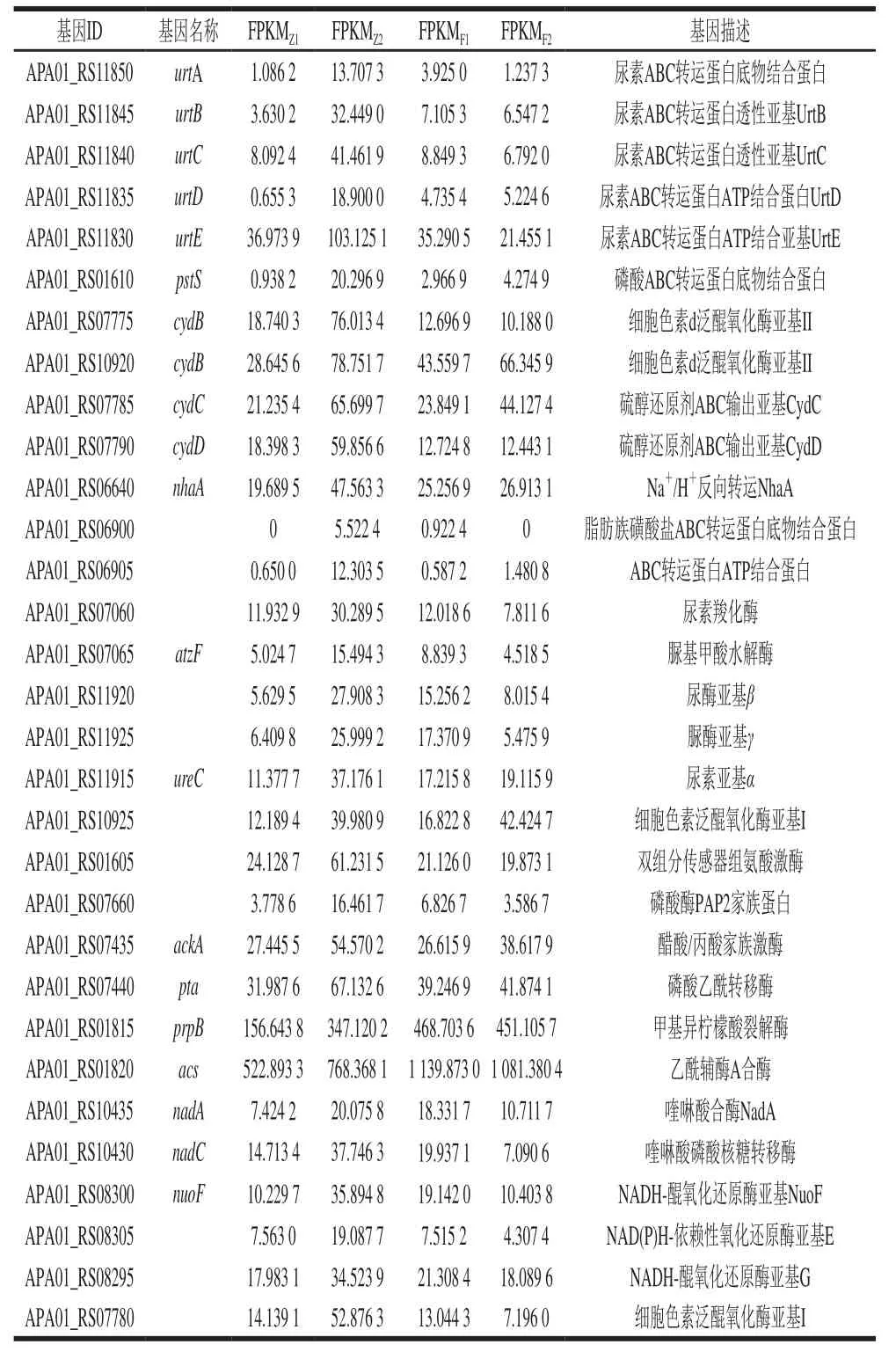
表2 巴氏醋杆菌CICC 20001醋酸发酵过程中的DEGsTable 2 DEGs induced by exogenous acetic acid in acetic acidfermentation by A.pasteurianus CICC 20001
2.5.1 ABC转运蛋白
营养物质只有进入了微生物细胞之后才能被微生物细胞内的新陈代谢系统分解利用,进而使微生物正常生长繁殖。细菌可以通过特殊的转运机制(包括外膜受体和孔蛋白以及内膜中的高度特异性转运蛋白)获取必需的营养物质[24]。ABC转运蛋白是一大类跨膜运输蛋白的统称,广泛存在于生物体中,它利用ATP水解产生的能量通过细胞膜转运底物,包括氨基酸、离子、糖类、脂质和弱酸等[25-26]。此外,Na+/H+反向转运蛋白可通过将H+逆向转运出细胞外来抵制细胞中过高的H+浓度,可提高微生物的耐酸性[27]。生物体可通过跨膜运输抵御对自身不利的细胞内外环境变化,以维持正常的生命活动。在研究中发现醋酸发酵早期,细胞中脂肪族磺酸盐ABC转运蛋白底物结合蛋白基因(APA01_RS06900、APA01_RS06905)、pstS、urtABCDE和cydCD等上调(表2、图5)。脂肪族磺酸盐ABC转运蛋白底物结合蛋白基因、pstS和urtABCDE分别与细胞中硫、磷酸和氨基酸等营养物质的转运有关[28-29]。cydCD在ABC转运蛋白中具有重要作用,它们能够与调节ATP酶活性的血红素辅助因子结合,并且与细菌的代谢、跨膜运输、氧化还原反应和耐受性等密切相关[30-31]。与不加底酸的对照组相比,这些上调的基因说明在酸胁迫下的巴氏醋杆菌CICC 20001可能通过加快对细胞外营养物质的吸收、促进大量能量的生成和提高酶活满足自身的生长和代谢需要,以促进巴氏醋杆菌CICC 20001的产酸。
微生物可通过产生碱性化合物抵抗酸性环境。目前已知尿素和精氨酸这2种主要底物能够产生碱性物质。精氨酸代谢可产生尿素,而尿素产生氨的途径有2种,一是在脲酶的调控下迅速水解为氨和二氧化碳;二是在尿素羧化酶和脲基甲酸水解酶作用下水解为氨和二氧化碳[32-33]。其中氨分子在细胞中起质子消耗作用,因而脲酶、尿素羧化酶和脲基甲酸水解酶在获取碱中起着重要作用。产碱机制对细菌在不同酸性条件下的生存有效,有研究表明由ureIABCEFGD操纵子组成的脲酶系统可以保护一些细菌,如罗伊氏乳杆菌和幽门螺旋杆菌免受酸引起的损害[34-35]。在醋酸发酵早期urtABCDE、尿素羧化酶基因(APA01_RS07060)、atzF以及与脲酶系统相关的脲酶亚基β基因(APA01_RS11920)、脲酶亚基γ基因(APA01_RS11925)和ureC等上调(表2、图5),说明这些基因可能调控细胞中脲酶分解尿素产生氨,而氨可能参与了细胞中醋酸的中和,进而减弱了细胞中醋酸的积累,促进巴氏醋杆菌CICC 20001产酸。
2.5.3 TCSs
TCSs是由感应组氨酸激酶和反应调节蛋白组成的一种细胞应答反应,也是存在于细菌内的一种信号转导体系。通过这个系统可监测外界环境的压力,并调控基因表达来适应环境胁迫,是细菌适应外界压力的一种自我保护机制[36]。有研究表明,TCSs体系在细菌的酸胁迫中发挥了重要的作用。Li Yuanjing等[37]发现酸胁迫环境激活了Komagataeibacter hanseniiHDM1-3的TCSs信号通路,调控了其脂肪酸的合成,进而诱导下游脂肪酸组成和结构的变化,从而帮助细菌抵抗酸性环境。Choi等[38]发现TCSs中的PhoQ/PhoP体系在酸性环境下被激活,刺激靶基因的转录。有研究表明双组分传感器组氨酸激酶和PstS与细菌中磷水平调控密切相关[29]。在本研究中发现醋酸发酵早期,与TCSs有关的双组分传感器组氨酸激酶基因(APA01_RS01605)和pstS等多个基因显著上调(表2、图5),表明TCSs可能受到酸性环境的激活。同时,双组分传感器组氨酸激酶基因和pstS的表达量增加,说明在醋酸发酵早期,巴氏醋杆菌CICC 20001可能通过提高磷的吸收和利用,保持酸性条件下细胞膜的完整性和流动性,以抵抗细胞所面临的酸性环境,促进巴氏醋杆菌CICC 20001代谢产酸。在巴氏醋杆菌CICC 20001发酵中后期,TCSs中有2个DEGs上调(APA01_RS10925、APA01_RS10920)(图5),表明TCSs在高醋酸环境中仍然发挥着重要作用,维持细胞正常生命活动,但是其积极作用略低于醋酸发酵早期,也进一步表明低浓度底酸可能主要在醋酸发酵早期激活TCSs以促进巴氏醋杆菌CICC 20001产酸。
2.5.4 醋酸同化及丙酸代谢
醋酸同化被认为是醋酸菌耐酸机制之一。醋酸进入细胞后,可由醋酸菌中特殊的ABC转运蛋白AatA将醋酸排出细胞外;也可在醋酸激酶、磷酸转移酶和乙酰辅酶A合酶的作用下将醋酸转化为乙酰辅酶A,并通过三羧酸循环进行同化,这一过程不仅能为醋酸发酵提供能量,也可减少细胞中醋酸含量,减弱醋酸对细胞的毒害作用[20]。在醋酸发酵早期,与醋酸同化相关的ackA、pta和acs等基因明显上调(表2、图5),表明在加入0.5%底物醋酸后,细胞中可能出现了醋酸同化现象,减轻巴氏醋杆菌所面对的酸性环境。丙酸是自然界中一种丰富的分解代谢产物,是生物体生长代谢的潜在碳源。但是,丙酸的积累对细胞也具有一定毒性,因此丙酸分解代谢也可以视为一种解毒机制。丙酸可在丙酰辅酶A合成酶或醋酸激酶和磷酸转移酶的催化下转化为丙酰辅酶A,再经过2-甲基柠檬酸循环生成琥珀酸,进一步进入丙酮酸代谢,丙酸代谢下的2-甲基柠檬酸循环是一种新的潜在耐酸机制[20,39]。在醋酸发酵早期,编码丙酸代谢关键酶甲基异柠檬酸裂解酶的基因prpB明显上调,将异柠檬酸甲酯转化为琥珀酸进入丙酮酸代谢,进而将丙酸分解,可能减弱细胞中的酸性环境,改善了巴氏醋杆菌的生长代谢,促进其产酸。但丙酸在醋酸发酵过程中的产生机制还有待进一步研究。另外,研究表明与酸同化相关的基因ackA、pta、acs和prpB在发酵过程中一直处于上调水平(表2、图5),其可能减弱了醋酸所产生的酸性环境对巴氏醋杆菌生长带来的胁迫影响,对底酸促进巴氏醋杆菌产酸发挥了重要作用。
2.5.5 能量代谢
能量代谢是一切生物代谢的核心问题。烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP+)这2种辅酶是生物体氧化还原反应中产能所必需的,也是电子传递链上的递氢载体,还是参与非氧化还原信号通路的酶的底物,从而调节生物学功能,包括物质代谢、能量代谢、DNA修复和胁迫抗性等[40]。在醋酸发酵早期,研究发现nadA、nadC、nuoF和cydB等上调(表2、图5)。其中,NadA与NadC参与NAD+的从头合成,并且NadC是其合成过程中的主要限速酶,NuoF与CydB等氧化还原酶作为辅酶促进电子在呼吸链上的传递,从而促进能量的释放[41]。这些上调的基因说明低添加量底酸可能促进氧化磷酸化过程,进而加快了能量产生,有助于提高巴氏醋杆菌CICC 20001产酸效率。在醋酸发酵中后期,与辅因子和维生素代谢、能量代谢等通路有关的基因大多数被下调,可能是由于细胞中醋酸体积分数升高,降低了酶活,从而影响了能量代谢过程。由此可见,底物醋酸可能在醋酸发酵早期时的能量代谢中发挥着更加重要的作用。
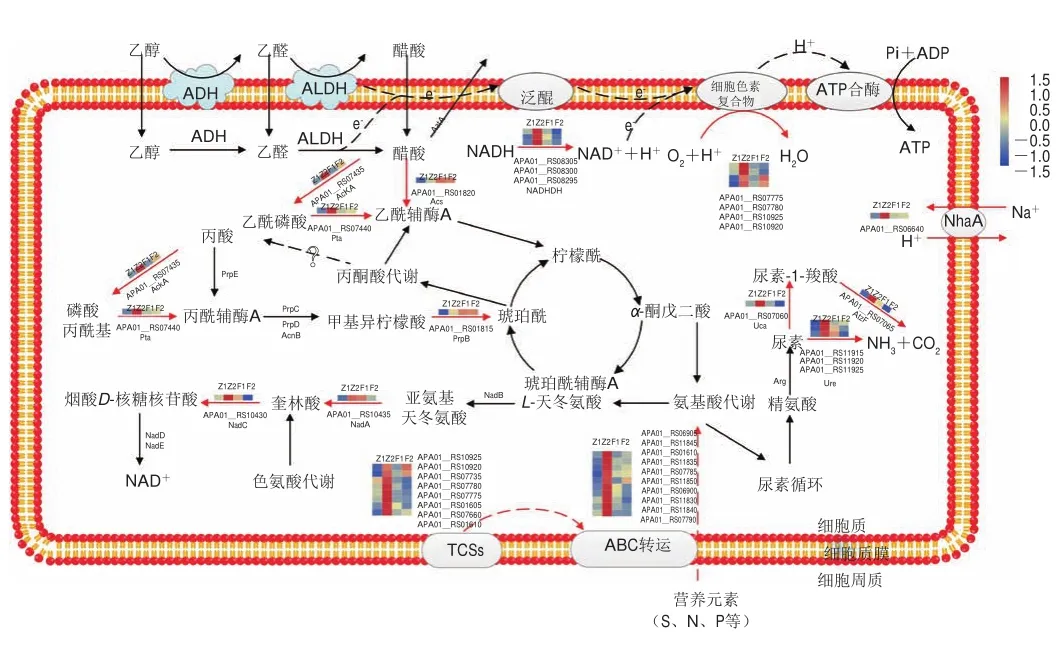
图5 巴氏醋杆菌CICC 20001醋酸发酵代谢图Fig.5 Metabolic pathways in acetic acid fermentation by A.pasteurianus CICC 20001
3 结 论
前期研究表明,添加一定量的底物醋酸可以促进巴氏醋杆菌产酸。本研究采用转录组学方法探讨添加0.5%底物醋酸促进巴氏醋杆菌产酸的分子机理。结果表明,以0.5%底物醋酸启动醋酸发酵时,巴氏醋杆菌产酸效率明显提高;在发酵早期和中后期,分别有412个和70个显著差异表达的基因。这些基因涉及信号转导、膜运输、能量代谢、尿素代谢、丙酸代谢和醋酸同化代谢等。添加0.5%底物醋酸可能激发巴氏醋杆菌信号转导过程,强化菌体对营养物质的跨膜运输和能量代谢,可能为迅速开启醋酸发酵提供物质和能量基础。与此同时,巴氏醋杆菌还可能通过强化尿素代谢、丙酸代谢和醋酸同化代谢提高醋酸耐受性,减少发酵过程中醋酸对菌体的毒害作用,从而提高巴氏醋杆菌产酸效率。同时,将生理分析和转录组学与蛋白组学相结合的研究可能会阐明并加深对底物醋酸促进巴氏醋杆菌产酸分子机制的理解。
