羧甲基纤维素诱导培养下罗伦隐球酵母的转录组差异分析
2022-05-07马电通常雪苗李文清黄二宾杜嵘宇杨清王芳邓佳
马电通,常雪苗,李文清,黄二宾,杜嵘宇,杨清,王芳, 2,邓佳,3*
1(西南林业大学 林学院,云南 昆明,650224)2(西南地区生物多样性保育国家林业局重点实验室,云南 昆明,650224) 3(西南山地森林资源保育与利用教育部重点实验室,云南 昆明,650224)
罗伦隐球酵母(Cryptococcuslaurentii)作为众多拮抗酵母菌中的一种,因其具有繁殖速率快、对人体无毒、广谱性和不对环境产生危害等特点[1]。在国内外常被应用于果蔬采后病害的防治与贮藏中,如柑橘、苹果和草莓等[1-2]。然而,C.laurentii单独使用时,存在其拮抗效力不及化学杀菌剂、稳定性差、生产成本高、对病原菌具有选择性等缺点[3]。利用激发子诱导培养增强拮抗酵母生防效力的方法,近年来受到了越来越广泛的关注。有研究表明利用糖类作为保护剂,能够增加酵母细胞内ATP、单糖、多糖等的积累,此外,糖保护剂还使酵母活性氧的积累减少,从而保护细胞减弱氧化损伤[4]。LI等[5]以1%海藻糖作为外源物质诱导培养C.laurentii,使其酵母体内海藻糖的含量升高,并提高酵母在冻干条件下的生活力,同时,还显著增强低温及可控气调条件下C.laurentii对苹果青霉病的生防效力。因此,在培养基中添加糖类物质,可以提高菌体的抗氧化胁迫和生防能力。
酵母在外源物质的诱导下其形态会发生变化并会对酵母自身产生特定的影响,比如抗逆性、存活率和酶的活性等,从而影响自身和应用于果蔬中相关指标的变化[6]。迟孟山[7]研究发现,在0.3%琼脂的YPD固体培养基上酵母Pichiakudriavzevii和Pichiacecembensis表现为生物膜形态,而在2%琼脂的YPD固体培养基上酵母表现为单细胞形态,进一步研究发现生物膜形态的酵母比单细胞形态表现出更好的抗逆性、存活率和抗氧化性,当把生物膜形态的2种酵母分别接种于梨和苹果的伤口时,均表现出更好的繁殖速度,对灰霉和青霉病的防治效果更佳。王东升等[8]研究结果表明,在低葡萄糖浓度下,扣囊复膜孢酵母大多为单细胞酵母形态,少部分酵母为菌丝体形态,其葡聚糖酶和几丁质酶活性显著高于菌丝体形态,更能提高酵母的生防效力。上述研究表明,添加糖类外源物质,能够诱导酵母形态发生变化,并使酵母体内抗病物质积累、增强酶活性,提高作用于果蔬的生防效力。
羧甲基纤维素(carboxymethyl cellulose,CMC)是纤维素的羧甲基化衍生物,为一种糖类物质,性状为白色或淡黄色纤维状粉末,无臭、无味。在食品中具有广泛的用途,常作为食品添加剂和果蔬保鲜剂[9],对于食品和果蔬货架期的延长具有明显的促进作用。转录组测序技术(RNA-Seq)作为近年来发展起来的一种研究技术,能够从RNA水平上分析出不同环境条件下同种生物基因的差异表达量,从而找出关键差异表达基因,更进一步探究差异基因(differential genes,DEGs)的调控机制及功能作用[10]。本实验室在前期研究中发现,在培养基中添加CMC诱导培养,能提高C.laurentii对青霉病的生防效力。因此,结合转录组分析,进一步探索CMC对C.laurentii生理特性的影响,揭示其拮抗作用的分子机制,以期为C.laurentii在果品采后病害防治的分子机制研究提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 酵母菌
C.laurentii:ATCC18803,广东微生物研究所。
1.1.2 试剂
CMC,上海腾准生物科技有限公司;蛋白胨和麦芽浸粉,北京奥博星生物技术有限责任公司;葡萄糖,天津市科密欧化学试剂有限公司;酵母粉,赛默飞世尔科技公司。
1.1.3 仪器与设备
SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;MIKRO220R冷冻型台式高速离心机,广东市华粤仪器有限公司;HH·B11-BS-Ⅱ恒温培养箱,上海跃进医疗器械有限公司;TS-2102C恒温摇床,上海天呈实验仪器制造有限公司;702型超低温冰箱,赛默飞世尔科技公司;70型离子交换纯水器,上海南华医疗器械;LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;DM750徕卡显微镜,成贯仪器(上海)有限公司显微系统;Nikon YS100型电子显微镜,广州颐腾贸易有限公司。
1.2 实验方法
1.2.1 培养基的配制
YM液体培养基(g/L):蛋白胨5.0、葡萄糖10.0,酵母粉3.0,麦芽浸粉3.0,pH自然;配制完毕后于121 ℃ 的高压灭菌锅灭菌21 min。自然冷却后,备用。
1.2.2 CMC诱导酵母形态变化率观测
参考杨新等[11]的操作方法,略作修改。将事先准备好的种子液按照2%的接种量接种于CMC含量为0(对照组)、0.5%(质量分数)(处理组)的YM液体培养基中(每个处理组3个重复),装液量为50/100mL;接种完毕后,在28 ℃、120 r/min的摇床上培养,之后分别在12、24、36、48、72、84、96 h于徕卡显微镜取样观察酵母形态变化(每个样品记录6个视野),并计算其酵母诱导形态变化率(当酵母的纵径和横径比等于1时视为酵母形态没有改变,当其纵横径比小于或大于1视为酵母形态发生变化),计算如公式(1)所示:
(1)
1.2.3 转录组测序菌体的培养与收集
参考1.2.2中CMC诱导酵母形态变化率的操作方法,略作修改。将事先准备好的种子液按照2%的接种量接种于CMC含量为0(对照组:CK-1、CK-2、CK-3)、0.5%(处理组:CMC-1、CMC-2、CMC-3)的YM液体培养基中(每个处理组3个重复),装液量为300/500mL;接种完毕后,在28 ℃、120 r/min的摇床上培养。培养结束后,在4 ℃、8 000 r/min、15 min的条件下离心收集菌体,然后立即置于-80 ℃中冰箱保存。
1.3 RNA提取
冷冻保存的酵母样品委托广州基迪奥生物科技有限公司进行酵母RNA提取、文库构建、测序及过滤和生物学信息分析。
1.4 文库构建、测序数据分析
在转录组学中,错误发现率(false discovery rate,FDR)<0.05且差异倍数(fold change,FC)>1(|log2FC|>1)被认为是差异表达基因,对达到此标准的DEGS进行GO(Gene Ontology)功能和KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析。实验中各数据表示平均值±标准误差,数据为3次重复的平均值,采用t检验方法分析不同处理组间差异,P<0.05表示差异达显著水平,另使用Excel 2010进行数据统计、并使用Origin 2019软件进行图表绘制。
2 结果与分析
2.1 CMC诱导C.laurentii形态变化率观测
由图1可知,0.5%CMC诱导培养24 h时,酵母形态变化率比CK组高出4.02%,酵母形态开始发生显著性的差异变化(P<0.05),且其显著差异变化一直持续到诱导培养72 h;72 h之后,0.5% CMC和CK处理组之间变化差异不显著(P<0.05)。0.5% CMC诱导培养24 h时,酵母细胞形态如图2所示。CK组细胞多以正圆形细胞酵母形式存在(图2-a),0.5% CMC处理组正圆细胞酵母逐渐减少,椭圆形细胞酵母逐渐增多(图2-b)。该结果表明,CMC诱导对C.laurentii细胞形态变化可能存在某种作用关系。因此,以0.5% CMC诱导培养24 h,细胞发生显著形态变化的C.laurentii,进行转录组测序并对测序数据进行生物信息学分析,从分子水平揭示C.laurentii对CMC培养的诱导响应机制。

图1 CMC诱导C.laurentii的形态变化率Fig.1 Rate of morphological change of C.laurentii induced by CMC 注:图中不同时间段的不同小写字母表示显著性差异(P<0.05)
2.2 测序数据质控报告
对CMC诱导(0.5%)和未诱导培养24 hC.laurentii进行转录组测序,结果如表1所示,测序质量控制后,共得到36.82 Gb纯净数据。CK处理组和CMC处理组碱基碱基Q30平均值分别为6 487 935 247、5 907 988 763条,占比为93.48%和94.80%;碱基Q20平均值分别为6 774 082 121、6 117 749 022条,占比为97.56%和98.16%;同理,GC的碱基平均值分别为4 157 214 861、3 722 095 089条,占比为59.86%和59.72%。以上数据,说明该转录组测序碱基质量好,准确性高,可用于后续实验进一步分析。

a-未诱导的酵母;b-CMC诱导的酵母图2 CMC诱导处理24 h的C.laurentii形态变化(10×40)Fig.2 Morphological changes of C.laurentii induced by CMC treatment for 24 h(10×40)

表1 碱基信息统计表Table 1 Statistical table of base information
2.3 基因比对率统计
由表2可知,转录组测序获得的纯净序列中,能定位到基因组上的纯净序列平均值为42 588 444条和38 122 146条,占比为91.58%~92.08%,在参考序列上,能比对上多个序列的基因的平均值为38 903和34 678条,占比为0.08%~0.09%,在参考序列上,只有唯一比对位置序列基因的平均值为42 549 542条和38 087 468条,占比为91.49%~92.0%。其中能定位到纯净序列上的基因占比都>91.58%,而在参考序列上有多个比对位置的基因序列数均<1%,因此,本次所测序列没有受到污染,可以开展后续基因序列的组装和分析。
2.4 组装质量统计
从表3和图3-a可得,N50的数量远低于基因的数量,而且其长度高于基因的平均长度,平均GC含量为60.014%,说明该基因的组装质量合格,效果较好,可用于后续数据的分析和挖掘。
表2 基因比对率统计表 单位:条

表3 组装质量统计表Table 3 Statistical table of assembly quality
2.5 Unigene基本注释
对C.laurentii组装转录本分别与Nr、KEGG、KOG和Swissprot四大数据库进行比对。测序得到的7 191个基因,进行基因功能注释并分别结果如表4所示,有6 402条(89.03%)Unigene被注释到Nr数据库、5 958条(82.85%)Unigene被注释到KEGG数据库、3 480条(48.39%)Unigene被注释到KOG数据库、3 998条(55.60%)Unigene被注释到Swissprot数据库;总共有6 409条(89.13%)Unigene被注释到数据库,没有注释到数据库的一共有782(10.87%)条。
Nr作为非冗余蛋白数据库,通过比对基因序列可以确定物种相似性。由图3-b可知,C.laurentii与银耳(Naemateliaencephala)、新型隐球酵母(Cryptococcusneoformans)和白茅草考克娃酵母(Kockovaellaimperatae)的种源相似性最高,分别为996(15.56%)、817(12.76%)、768(11.20%),表明C.laurentii与酵母有较高的种源相似性。

表4 功能注释统计表Table 4 Statistical table of function notes
2.6 CMC诱导C.laurentii差异表达基因分析
2.6.1 DEGs的筛选
对于同一生物体而言,在不同的环境条件下其体内的基因表达会存在显著性差异。因此,为了探究C.laurentii在CMC培养条件下基因的表达的差异情况,对2处理组样品数据进行基因差异表达分析。筛选标准:FDR<0.05且FC>1(|log2FC|>1)。结果如图3-c所示,添加0.5% CMC诱导培养24 h的C.laurentii总共筛选出显著性差异表达基因58个,其中上调表达的有55个基因,占比为94.83%,3个基因为下调表达,占比仅有5.17%。
2.6.2 DEGs的GO富集分析
对所有的DEGs做二级GO数据库富集分析,DEGs被涉及到生物过程、细胞组分和分子功能3个大类,总共包括在24个二级亚类中(图4-a)。生物过程包括12个亚类,其中,以细胞过程、单生物过程和代谢过程富集的DEGs最多,分别为16、15、13个,该3个亚类可能与细胞的能量代谢、生长等相关;细胞组分的包括8个亚类,其中以细胞、细胞区域、膜和细胞器富集到最多的DEGs,分别为11、11、10、7个,该4个亚类可能与细胞内物质的运输、转运相关;富集到分子功能的亚类数目最少,仅有4个,分别为催化活性、结合、转运体活性和电子转运体活性,其参与的DEGs分别为13、9、3、1个,该4个亚类可能与细胞内酶的合成与电子的传递相关。
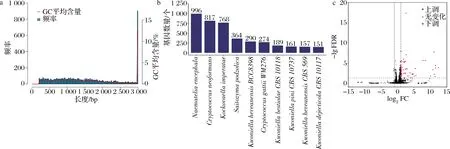
a-Unigene长度分布图;b-Nr比对物种数量统计图;c-DEGs火山图图3 Unigene长度分布图、Nr比对物种数量统计图和DEGs火山图Fig.3 Diagram of Unigene length distribution、cartograph of the number of Nr comparison specie and volcano map of differential genes
2.6.3 DEGs的KEGG富集分析
在生物体内,不同基因相互协调共同行使其生物学功能。KEGG作为主要的基因通路公共数据库,对筛选出的DEGs注释到KEGG数据库,能找到相关DEGs的通路并能够确定DEGs参与的最主要生化代谢通路和信号转导途径。对本实验所有DEGs进行通路富集分析(图4)。

a-GO富集分类柱状图;b-KEGG富集条形图图4 GO和KEGG富集分析Fig.4 GO and KEGG enrichment analysis
DEGs被富集到14个通路上,其中呈显著富集(Q<0.05)的是氧化磷酸化(oxidative phosphorylation,OXPHOS)和代谢途径2个通路,分别富集了7和12个DEGs;其次,酪氨酸代谢、次生代谢物的生物合成和β-丙氨酸代谢途径通路上各有2个DEGs;富集只有1个DEGs的通路为黄曲霉毒素生物合成、糖胺聚糖降解、苯丙氨酸代谢、磷脂酰肌醇信号系统、精氨酸与脯氨酸代谢、甘油脂代谢、甘氨酸、丝氨酸和苏氨酸代谢、酵母MAPK信号通路和酵母细胞周期通路。其中,OXPHOS通路归属于能量代谢亚类、磷脂酰肌醇信号系统和酵母MAPK信号通路归属于信号转导亚类、酵母细胞周期通路则归属于细胞生长与死亡亚类;其4条通路所参与的过程可能涉及酵母的能量代谢,生长与繁殖等。
2.7 相关DEGs的通路分析
由表5可知,在DEGs富集的14条通路中,所有通路中的DEGs都表现为上调表达且表达量均显著高于未诱导处理,其中与酵母的能量代谢、生长繁殖相关的通路,包括OXPHOS、代谢途径、磷脂酰肌醇信号系统、酵母MAPK信号通路和酵母细胞周期,差异表达基因呈现出不同幅度显著(P<0.05)上调(表6)。

表5 CMC诱导C.laurentii后的DEGsTable 5 Differential genes of C.laurentii after induction by CMC
由图5可知,CMC诱导培养C.laurentiiOXPHOS通路中,基因ND1(NADH-泛醌氧化还原酶链1)、ND3(NADH-泛醌氧化还原酶链3)、ND4(NADH-泛醌氧化还原酶链4)、Cytb(泛醌-细胞色素c还原酶细胞色素b亚基)、COX1(细胞色素c氧化酶亚基1)、COX3(细胞色素c氧化酶亚基3)和β-a(F型H+转运ATP酶亚基)的表达量均上调;经诱导后,其表达量均显著(P<0.05)高于未诱导处理,其分别提高48.86、2.56、25.62、28.03、15.38、35.03、21.53倍(表6)。C.laurentii的磷脂酰肌醇信号系统通路中,与钙离子相关基因CALM(钙调蛋白)为上调表达,其表达量增加了1.89倍,显著(P<0.05)高于未诱导处理(表6)。此外,经过CMC诱导培养后,在C.laurentii的MAPK信号通路和细胞周期通路中,与细胞周期和有丝分裂相关的基因MIH1(M期诱导酪氨酸磷酸酶)呈现上调表达,其表达量高于未诱导处理2.05倍,差异达显著(P<0.05)水平(表6)。

表6 CMC诱导C.laurentii与细胞能量代谢、生长相关的DEGs表达量Table 6 CMC induces differential gene expression in C.laurentill associated with cellular energy metabolism and growth
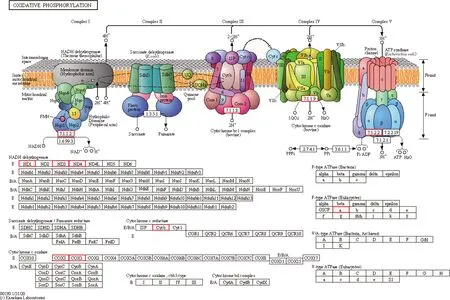
图5 OXPHOS通路Fig.5 Oxidative phosphorylation pathway
3 讨论与结论
本研究对C.laurentii进行CMC诱导培养,结果表明,当培养基中添加CMC培养,C.laurentii形态由正圆形向椭圆形变化,诱导培养24~72 h酵母形态变化率显著(P<0.05)高于对照处理,推测这个过程汲及到细胞的分裂。进一步对诱导培养24 h形态发生显著差异变化的酵母进行转录组测序,结果表明,经CMC诱导培养的C.laurentii,与对照组相比,C.laurentii共有58个DEGs,其中55个为上调表达,3个为下调表达。DEGs被注释到24条GO分类中和14条KEGG通路中,分析结果表明,0.5% CMC诱导培养24 hC.laurentii涉及的DEGs功能主要与细胞能量代谢和生长、繁殖等有关,显著(P<0.05)富集在OXPHOS、磷脂酰肌醇信号系统、酵母MAPK信号通路和酵母细胞周期通路中。
在能量代谢方面,OXPHOS是需氧细胞生长过程中细胞能量来源的主要途径,能生成大量的ATP[12],其由电子传递酶类(复合物I~Ⅳ)协同作用工作,复合物I~Ⅳ是由多亚基酶构成并协同作用与工作,而后在ATP合酶(复合物Ⅴ)的作用下产生ATP[13],因此,该途径能够为细胞的生长、繁殖提供能量支持。OXPHOS代谢途径中,复合物Ⅰ又称还原性烟酰胺腺嘌呤二核苷酸脱氢酶,是呼吸链中最大的酶[14],其能够转移电子给辅酶Q,利于电子的转移,最终促使质子泵入线粒体膜间隙。ND1(NADH-泛醌氧化还原酶链1)、ND3(NADH-泛醌氧化还原酶链3)、ND4(NADH-泛醌氧化还原酶链4)为NADH脱氢酶下的3个酶链,他们的聚集组合对NADH的产生具有重要的调控作用。本研究转录组数据中,基因ND1、ND3和ND4在CMC诱导培养后呈现上调表达,与NADH合成积累密切相关。复合物Ⅲ又名细胞色素c还原酶,其将电子从辅酶Q传递给细胞色素c,有助于质子传递进入膜间隙。主要参与了细胞呼吸、生物大分子合成等过程[15],对于酵母的生殖生长和代谢起着至关重要的作用。亚基基因Cytb(泛醌-细胞色素c还原酶细胞色素b亚基)是调控复合物Ⅲ合成的核心构件关键基因。发现CMC诱导培养后,C.laurentii的Cytb基因表达量呈现上调,说明该基因参与了复合物Ⅲ积累,从而促进电子向载体细胞色素c的转移。复合物Ⅳ又称细胞色素c氧化酶,线粒体呼吸链的最后一种酶[16],它接受来自细胞色素c的电子,把电子传递给O2转化为H2O,将质子泵送至膜间隙。COX1(细胞色素c氧化酶亚基1)、COX3(细胞色素c氧化酶亚基3)作为细胞色素c氧化酶下的2个亚基,具有参与、稳定催化及调节活性的功能,对复合物Ⅳ的积累起到重要调节作用。转录组数据中,C.laurentii的COX1和COX3基因在CMC诱导后呈现不同幅度上调,推测添加CMC培养诱导酵母COX1、COX3基因表达,使酵母胞内细胞色素c氧化酶相对含量增加,有利于胞内电子的大量传递转移。复合物Ⅴ又名ATP合酶,作为酵母能量代谢的关键酶,其利用复合物Ⅰ、Ⅲ和Ⅳ产生的质子动力将ADP合成ATP,为细胞内多种化学反应和功能的进行提供能量[17]。本研究转录数据显示,ATPase编码基因β-a(F型H+转运ATP酶亚基)在CMC诱导培养后表达量上调,β-a作为复合物Ⅴ的1种亚基组件对于ATP合酶的组装合成具有促进作用,进一步利于ADP和Pi(无机磷酸盐)在线粒体内膜上凝聚合成ATP[18]。基于以上分析推测,CMC诱导培养C.laurentii,酵母ND1、ND3、ND4、Cytb、COX1、COX3和β-a基因表达量均上调,促进复合物Ⅰ、Ⅲ、Ⅳ和Ⅴ积累,提高酵母细胞ATP的合成能力,为酵母细胞内各种代谢反应和物质合成提供能量保证,进而增强酵母的活力,上述研究结果与宋志强等[19]的研究结果类似。
CMC诱导培养提高C.laurentii生长繁殖能力,拮抗酵母的生长繁殖能力与其生防效力密切相关[20]。通过转录组学分析得出,磷脂酰肌醇信号系统通路中,基因CALM(钙调蛋白)表达量呈现上调,该研究结果与韩秀娟等[21]的研究结果类似。CALM是真核细胞内调节钙信号通路的一种关键蛋白[22],其作为调节因子并几乎存在于每一种细胞内[23]。CALM作为酵母细胞内Ca2+的主要受体,其功能主要是参与促进细胞的新陈代谢、细胞分裂、生殖生长和信号转导等一系列过程[24]。此外,在酵母MAPK信号通路和酵母细胞周期通路中,MIH1(M期诱导酪氨酸磷酸酶)的表达量上调。MIH1p是一种控制细胞周期的蛋白酪氨酸磷酸酯酶,其通过调节Cdc28p的磷酸化程度影响酵母的有丝分裂。其与基因Swe1p共同形成有丝分裂的负反馈调节系统[25]。有研究表明,基因MIH1缺失的情况下,细胞进入有丝分裂的时间会延迟,而且细胞的体积会变大[26],本研究转录数据表明,MIH1上调表达加速细胞有丝分裂进程,根据该结果推测细胞形态呈椭圆形态变化(图2-b),可能是酵母进行大量有丝分裂活动,两者结果基本相符,其研究结果与PAL等[26]研究类似。因此,CMC诱导C.laurentii使酵母CALM、MIH1的表达量上调,促进酵母细胞的有丝分裂及生殖生长,提升酵母自身增殖与代谢效率,从而增强了其拮抗效力。上述研究结果为多糖诱导提高生防酵母拮抗效力分子机制的进一步深入研究提供了一定理论参考与及科学依据。
