发酵乳杆菌LFQ153胞外多糖对RAW264.7巨噬细胞氧化损伤的保护作用
2022-05-07刘聪秀宋佳佳王洪伟张玉索化夷
刘聪秀,宋佳佳,王洪伟,张玉,索化夷
(西南大学 食品科学学院,重庆,400715)
氧化应激是指机体受到不良刺激时,产生的过量自由基超出细胞抗氧化防御能力,造成机体氧化与抗氧化作用失衡的现象[1]。持续的氧化应激可导致脂质过氧化、蛋白质和DNA损伤,引发炎症、糖尿病、动脉粥样硬化和神经退行性疾病[2]。其中,炎症与氧化应激密不可分,氧化应激使机体产生过量活性氧,激活免疫细胞释放多种炎症介质,引起机体炎症反应[3];同时炎症反应会促进大量自由基释放,进一步加剧氧化应激[4]。因此,缓解氧化性损伤对维持机体健康具有重要意义。
已有研究表明,多糖可通过清除活性氧自由基,提高抗氧化物酶活性,减少脂质过氧化物产生等途径起到抗炎抗氧化作用。例如,党参多糖对H2O2诱导的RAW264.7巨噬细胞氧化损伤具有保护作用[5],羊肚菌多糖对脂多糖诱导的RAW264.7巨噬细胞炎症反应具有抑制作用[3]。除植物多糖和真菌多糖外,乳酸菌胞外多糖(exopolysaccharide,EPS)由于具有生产周期短、成本低和易于控制等优势,也受到越来越多关注。乳酸菌 EPS是乳酸菌在生长代谢过程中分泌到细胞外的天然高分子聚合物,通常由一种或多种不同类型的单糖组成,可保护细胞免受干燥脱水、抗生素或有毒物质等外界不良影响[6]。研究证实,乳酸菌EPS具有抗炎、抗氧化、抗肿瘤和降糖降脂等生物学活性[7]。如HU等[8]发现鼠李糖乳杆菌ZFM231的EPS具有显著降血脂、降胆固醇活性和自由基清除能力;SIRIN等[9]的研究表明,保加利亚乳杆菌B3和植物乳杆菌GD2的EPS可缓解淀粉样β蛋白诱导的人神经母细胞瘤细胞SH-SY5Y氧化应激,预防阿尔茨海默病。
我国乳酸菌发酵食品资源丰富,已有学者从传统发酵食品中分离出产EPS的乳酸菌,并研究乳酸菌EPS的生物活性,如LIU等[10]发现从四川泡菜中分离到的植物乳杆菌HY,其产生的EPS具有较强抗氧化能力。本研究从青海西宁市手工酸奶中分离得到1株产EPS且胃肠抗性较好的发酵乳杆菌LFQ153,其EPS对氧化损伤的缓解作用尚不清楚。因此,本研究首先通过DPPH自由基和羟自由基清除实验考察EPS的体外抗氧化水平,进而基于氧化损伤的RAW264.7巨噬细胞,从抗氧化酶活性、炎症因子表达以及核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)/血红素氧合酶1(heme oxygenase-1,HO-1)/核因子κB(nuclear factor-κB,NF-κB)通路等角度,研究EPS对巨噬细胞氧化损伤的保护作用与机制,旨在为功能性乳酸菌胞外多糖的开发提供一定理论基础和科学依据。
1 材料与方法
1.1 材料及试剂
发酵乳杆菌LFQ153,本课题组分离自青海西宁市手工酸奶;RAW264.7小鼠单核巨噬细胞,来自中国科学院细胞库。
浓 H2SO4、苯酚、FeSO4、30% H2O2、95%乙醇、无水乙醇、三氯乙酸、三氯甲烷、异丙醇,成都市科隆化学品有限公司;DPPH、1,10-菲啰啉、噻唑蓝(methyl thiazolyl tetrazolium,MTT)、脂多糖(lipopolysaccharides,LPS),Sigma-Aldrich 试剂公司;MRS培养基,广东环凯微生物科技有限公司;DMEM(dulbecco′s modified eagle medium)培养基、胎牛血清(fetal calf serum,FBS)、0.25%胰酶、青霉素-链霉素溶液,美国 Gibco 公司;非必需氨基酸、磷酸盐缓冲液(phosphate buffer saline,PBS)、二甲基亚砜(dimethyl sulfoxide,DMSO)试剂,北京索莱宝科技有限公司;Griess 试剂盒、BCA试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、细胞裂解液,碧云天生物技术研究所;过氧化氢酶(catalase,CAT)试剂盒,南京建成生物工程研究所;RevertAid First Strand cDNA合成试剂盒、PCR 引物设计和合成,美国 Thermo公司;SYBR Green RCR Master Mix,翌圣生物科技有限公司。本研究采用的化学试剂均为分析纯。
1.2 仪器与设备
Epoch2型多功能酶标仪,美国BioTek公司;5810R型高速冷冻离心机,德国 Eppendorf 公司;CFX96 Touch型荧光定量 PCR 仪,美国 Bio-rad 公司;P100K200型超微量核酸蛋白测定仪,美国Pultton公司;371型二氧化碳培养箱,美国Thermo公司。
1.3 实验方法
1.3.1 发酵乳杆菌LFQ153胞外多糖的制备
将发酵乳杆菌LFQ153接入MRS液体培养基活化后,以2%的比例接种扩大培养。37 ℃厌氧培养 48 h后,取培养液于4 ℃下4 000 r/min离心15 min去除菌体,收集上清液,沸水浴10 min使分解多糖的酶类失活。冷却至室温,50 ℃减压浓缩至原体积的1/4,加入三氯乙酸至质量浓度40 g/L,4 ℃静置8 h,在4 ℃下10 000 r/min离心10 min去除蛋白质沉淀。加入3倍体积的预冷95% (体积分数)乙醇,4 ℃静置8 h,在4 ℃下10 000 r/min离心10 min得到粗多糖沉淀。将粗多糖沉淀溶于60 ℃蒸馏水中,10 000 r/min离心10 min去除底部不溶沉淀,然后将上清液装入截留分子质量为8~14 kDa的透析袋内,每隔6~8 h换1次水,连续透析2 d。收集透析袋内多糖溶液,真空冷冻干燥制得粗多糖。
采用DEAE Sepharose Fast Flow阴离子柱(21 mm×135 mm)初步纯化粗多糖,取200 mg粗多糖溶于20 mL去离子水,过0.22 μm滤膜后加入DEAE Sepharose Fast Flow柱,用去离子水、0.05、0.1、0.2 mol/L NaCl 溶液以流速4 mL/min梯度洗脱,6 mL/管收集洗脱液,苯酚硫酸法[11]跟踪检测洗脱液,收集主峰组分,浓缩透析并冷冻干燥。采用Superdex 200凝胶柱(10 mm×240 mm)进一步纯化,取多糖干粉溶于去离子水配成10 mg/mL的溶液,过0.22 μm滤膜后用去离子水以流速1 mL/min洗脱,3 mL/管收集洗脱液,苯酚硫酸法跟踪检测,收集洗脱峰,浓缩后冷冻干燥,得到纯化多糖EPS,根据苯酚硫酸法测得EPS总糖含量为(91.70±0.82)%。
1.3.2 EPS的体外抗氧化活性
1.3.2.1 DPPH自由基清除作用
参照CHEN等[12]的实验方法,分别吸取 1 mL不同质量浓度的EPS样品(1~5 mg/mL)于试管中,加入 1 mL 现配的 0.2 mmol/L DPPH无水乙醇溶液,混匀。室温避光反应 30 min后于517 nm 处测定OD值,DPPH自由基清除率计算如公式(1)所示:
(1)
式中:A1为多糖样品的OD值;A0为乙醇溶液代替DPPH溶液的OD值;A2为去离子水代替多糖样品的OD值。
1.3.2.2 羟自由基清除作用
参照CHEN等[12]的实验方法,分别吸取1 mL不同质量浓度的EPS样品(1~5 mg/mL)于试管中,依次向管中加入各1 mL 的0.75 mmol/L 1,10-菲啰啉、0.75 mmol/L FeSO4、0.01%(体积分数)H2O2和0.15 mol/L pH 7.4的磷酸钠缓冲液,混匀后于37 ℃反应1 h,测定混合液在536 nm处的OD值,羟自由基清除率计算如公式(2)所示:
(2)
式中:A1为多糖样品的OD值;A2为去离子水代替多糖样品的OD值;A0为去离子水代替多糖样品和 H2O2的OD值。
1.3.3 细胞实验
1.3.3.1 细胞培养
RAW264.7巨噬细胞复苏后,加入DMEM完全培养基(含10%FBS、1%青霉素-链霉素和1%非必需氨基酸),置于37 ℃、5% CO2细胞培养箱中培养,待细胞生长至融合度达80%,用 0.25%胰酶消化细胞获得细胞悬液用于后续实验。
1.3.3.2 RAW264.7巨噬细胞活力的测定
调整细胞数量为5×105个/mL,以100 μL/孔接种于 96 孔板,37 ℃培养过夜后弃去培养液,PBS洗涤1次,每孔加入100 μL含不同质量浓度EPS(62.5、125、250、500 μg/mL)的DMEM完全培养基,以无 EPS的相同培养基为正常对照,只加完全培养基为空白对照,每组设4个复孔,培养 24 h后每孔加10 μL MTT溶液于 37 ℃避光孵育,4 h后吸掉上清液,加入150 μL DMSO振摇15 min,于490 nm处测定OD值,细胞活力计算如公式(3)所示:

(3)
式中:A0为空白对照组 OD 值;Ac为正常对照组 OD 值;As为实验组OD值。
1.3.3.3 RAW264.7巨噬细胞中NO含量的测定
RAW264.7巨噬细胞以5×105个/mL接种于96孔板,每孔100 μL,37 ℃培养过夜后弃去培养液。PBS洗涤1遍后,对照组和LPS组加入完全培养基,EPS组分别加入含不同质量浓度EPS(125、250、 500 μg/mL)的完全培养基,每组设3个复孔。培养箱中孵育2 h后,向LPS组和EPS组每孔加入10 μL的10 μg/mL LPS(使培养基中LPS终质量浓度为1 μg/mL)。继续培养22 h后,取 50 μL上清液至96 孔板,加入 50 μL Griess试剂 A和试剂 B,在540 nm 处测定各孔 OD值,根据标准曲线计算每组NO含量。
1.3.3.4 RAW264.7巨噬细胞中抗氧化酶活性和MDA含量的测定
RAW264.7 巨噬细胞以5×105个/mL接种于6孔板, 37 ℃培养过夜后弃去培养液,分组及处理同 1.3.3.3。培养结束后弃去上清液,预冷PBS洗涤2次,每孔加入 200 μL 细胞裂解液,冰上反复吹打,于4 ℃、12 000 r/min 离心10 min收集各组细胞上清液。根据BCA 试剂盒说明书测定各组细胞蛋白浓度, CAT、SOD、GSH-Px和MDA的检测均按照试剂盒说明进行。
1.3.3.5 RAW264.7巨噬细胞中氧化损伤相关基因表达的测定
RAW264.7 巨噬细胞以5×105个/mL接种于6孔板,分组及处理同 1.3.3.3。培养结束后,按照臧中昊[13]的方法裂解细胞提取总 RNA,根据RevertAid First Strand cDNA试剂盒合成cDNA,体系反应 37 ℃ 30 min、95 ℃ 5 min后,用 RT-PCR检测mRNA表达,引物见表1。PCR反应条件:95 ℃ 预变性10 min;95 ℃ 15 s,60 ℃ 1 min,72 ℃ 30 s,循环40次。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因,使用2-ΔΔCt法计算mRNA含量。

表1 PCR 引物序列Table 1 Sequences of PCR primers
1.3.4 EPS的单糖组成分析
参考WANG等[14]的方法采用离子色谱仪分析EPS的单糖组成,并稍作修改:采用CarboPac PA20 色谱柱(3 mm×150 mm),脉冲安培检测器,流动相为H2O、15 mmol/L NaOH 和 100 mmol/L NaOAc,以进样量5 μL、流速0.3 mL/min进行洗脱。配制10 mg/mL单糖标准品混合溶液,包括岩藻糖、盐酸氨基半乳糖、鼠李糖、阿拉伯糖、盐酸氨基葡萄糖、半乳糖、葡萄糖、N-乙酰-D-氨基葡萄糖、木糖、甘露糖和核糖。配制多糖溶液,取 10 mg EPS于安瓿瓶中,加入 10 mL 的3 mol/L三氟乙酸,120 ℃烘箱水解 3 h,待水解液冷却后,氮气(65 ℃)吹干,重复3次加入甲醇 3 mL用氮气吹干以除尽三氟乙酸,再加入5 mL去离子水溶解多糖酸水解产物,稀释10倍后12 000 r/min离心5 min,取上清液进样分析。
1.3.5 数据处理

2 结果与分析
2.1 EPS的体外抗氧化活性
由图1可知,在1~5 mg/mL内,DPPH自由基和羟自由基的清除率随EPS质量浓度的增加而增加,存在剂量依赖关系。当质量浓度为5 mg/mL时,EPS对DPPH自由基和羟自由基的清除率分别为(64.19±1.03)%和(61.87±3.09)%。
与本研究相似,植物乳杆菌CNPC003胞外多糖在质量浓度为8 mg/mL时对DPPH自由基的清除率为51.52%[15];发酵乳杆菌S1胞外多糖在质量浓度为4 mg/mL 时对DPPH自由基和羟自由基的清除率分别为60.50%和61.67%[14]。在体外抗氧化实验中,乳酸菌EPS通常表现出较强的清除自由基能力,推测可能是多糖碳氢链上的氢原子结合羟自由基生成水,从而达到清除羟自由基效果[16]。此外,多糖大分子自身具有的空间结构可对DPPH自由基或羟自由基产生包合作用,从而抑制自由基反应[17]。

a-DPPH自由基清除率;b-羟自由基清除率图1 EPS对DPPH自由基和羟自由基清除活性的影响Fig.1 Effect of EPS on DPPH and hydroxyl radical activity
2.2 EPS对RAW264.7 巨噬细胞活力的影响
如图2所示,质量浓度为62.5~500 μg/mL的 EPS 作用细胞 24 h 后,与对照组相比,各组细胞活力没有差异(P>0.05),表明EPS对RAW264.7细胞无毒性作用。因此,本研究选取125、250、500 μg/mL 3个质量浓度进行后续实验。
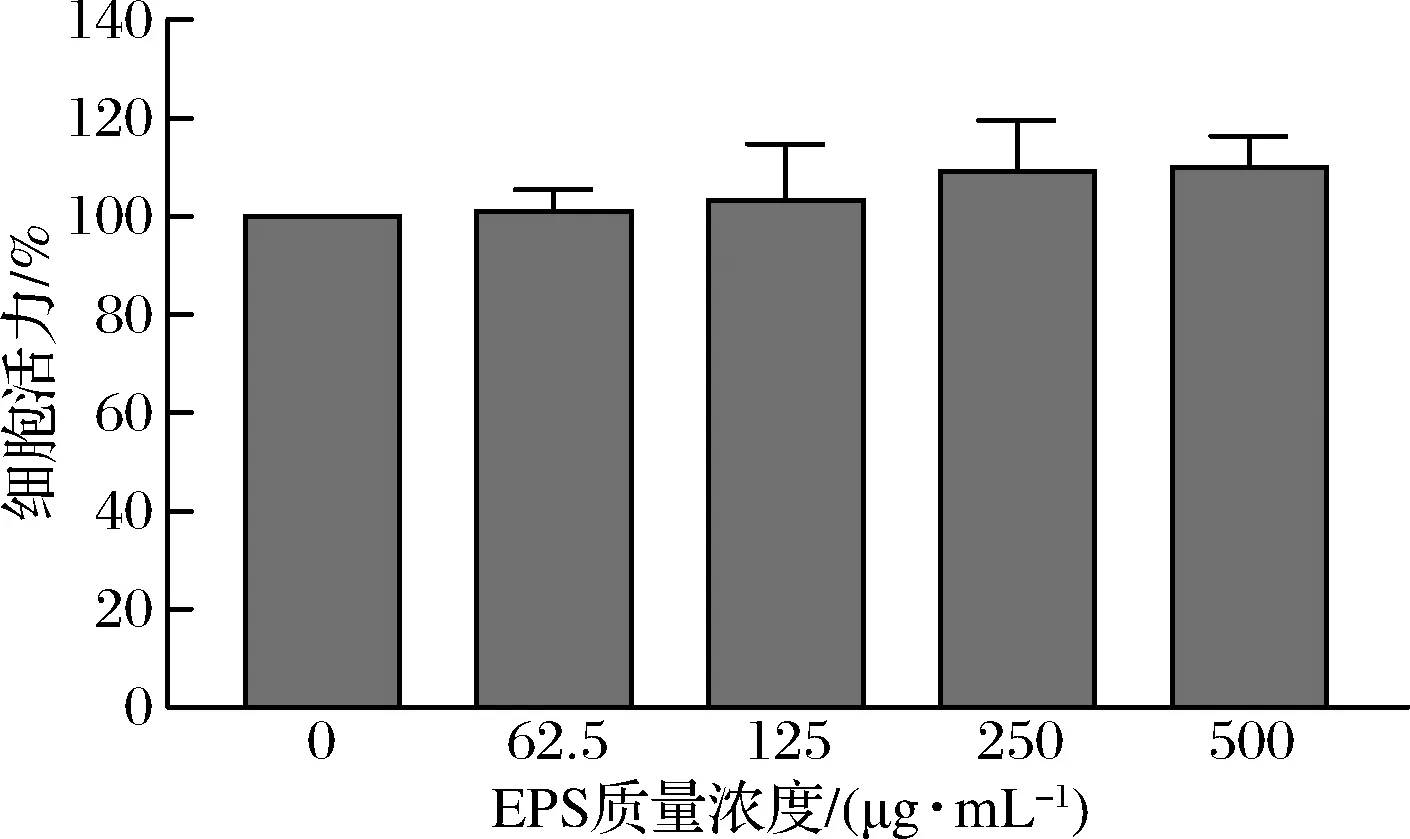
图2 EPS 对 RAW264.7 巨噬细胞活力的影响Fig.2 Effect of EPS on the viability of RAW264.7 macrophages
2.3 EPS对RAW264.7巨噬细胞中抗氧化酶活力和MDA含量的影响
由图3可知,与对照组相比,LPS处理使细胞内抗氧化酶SOD、CAT 和 GSH-Px的活力显著下降,MDA 含量显著增加(P<0.05),表明LPS可使细胞发生氧化损伤。与LPS损伤组相比,经EPS处理后细胞中SOD、CAT 和 GSH-Px 的活力均有所提升,而MDA的含量呈下降趋势(P<0.05)。并且,3种抗氧化活力与EPS剂量呈正相关,而MDA的含量与EPS剂量呈负相关,这表明随EPS浓度增加,细胞抗氧化酶活力提高,自由基清除能力增强,脂质过氧化物减少,LPS诱导的细胞氧化损伤减轻。
2.4 EPS对RAW264.7 巨噬细胞 中NO含量和炎症基因表达的影响
根据图4结果,与对照组相比,LPS诱导损伤的细胞中NO含量、iNOS、TNF-α、IL-1β和IL-6的mRNA表达量均显著增加(P<0.05);与LPS处理组相比,经不同浓度的EPS干预后,细胞中NO 含量、iNOS、TNF-α、IL-1β和IL-6的mRNA表达量均明显下降(P<0.05),而且,这种降低作用与EPS的剂量呈浓度依赖性关系。上述结果表明,EPS可通过降低NO含量和抑制炎症基因表达,缓解LPS引起的细胞炎症损伤。
2.5 EPS对RAW264.7 巨噬细胞氧化损伤的保护机制
为进一步研究EPS保护RAW264.7 细胞氧化损伤的作用机制,本研究采用RT-PCR检测Nrf2/HO-1/NF-κB 通路相关基因的表达水平。如图5所示,与对照组相比,LPS刺激使RAW264.7巨噬细胞中Nrf2、HO-1和IκB-α的mRNA表达显著下降,而NF-κB的mRNA表达显著上升(P<0.05);与LPS处理组相比,EPS的干预不仅显著上调了Nrf2、HO-1和IκB-α的mRNA表达水平,还显著下调了NF-κB的mRNA表达水平(P<0.05)。RAW264.7 巨噬细胞内Nrf2、HO-1和IκB-α的mRNA表达量与EPS剂量呈正相关,而NF-κB的mRNA表达量与EPS剂量呈负相关。结果表明,EPS对RAW264.7巨噬细胞氧化损伤的保护机制,可能与EPS激活Nrf2/HO-1通路,并抑制NF-κB通路有关。

a-SOD活力;b-CAT活力;c-GSH-Px活力;d-MDA含量图3 EPS对RAW264.7巨噬细胞中抗氧化酶活力和MDA含量的影响Fig.3 Effects of EPS on antioxidant enzymes activity and MDA content in RAW264.7 macrophages 注:与对照组相比,#表示P<0.05;与LPS损伤组相比,*表示P<0.05 (下同)
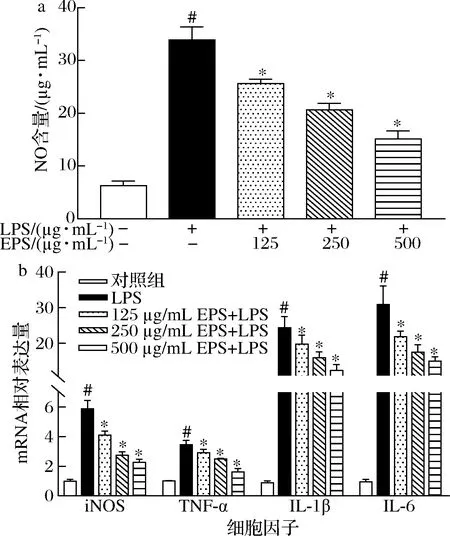
a-NO含量;b-iNOS、TNF-α、IL-1β和IL-6的mRNA相对表达量图4 EPS对RAW264.7巨噬细胞中NO含量和炎症 基因表达的影响Fig.4 Effects of EPS on NO content and inflammatory genes expression in RAW264.7 macrophages
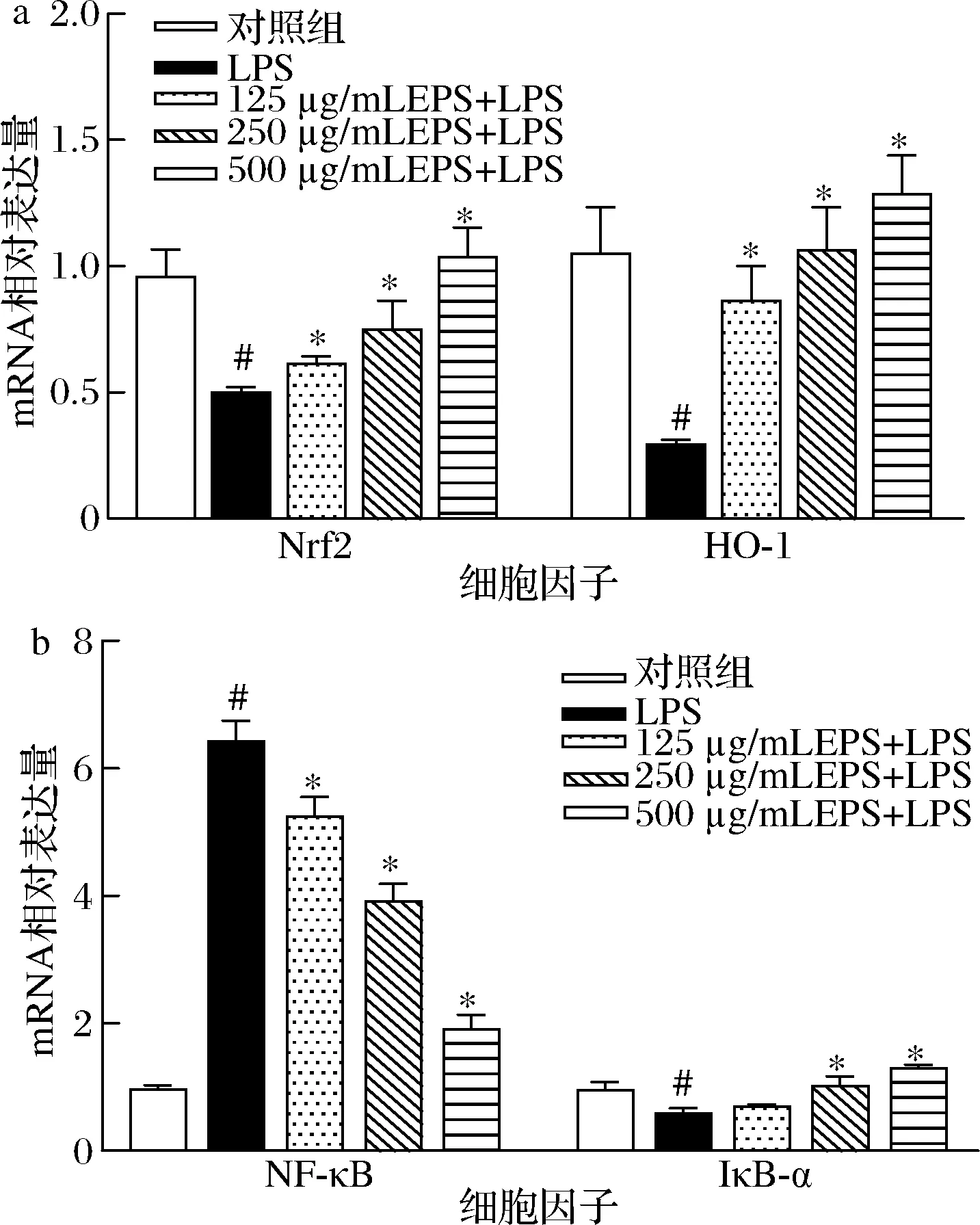
a-Nrf2和HO-1的mRNA相对表达量;b-NF-κB和IκB-α的 mRNA相对表达量图5 EPS对RAW264.7巨噬细胞中Nrf2/HO-1/NF-κB 通路相关基因表达的影响Fig.5 Effects of EPS on the expression of Nrf2/HO-1/NF-κB signaling-related genes in RAW264.7 macrophages
2.6 EPS的单糖组成
图6为单糖标准品(图6-a)和 EPS(图6-b)的离子色谱图。结合图6-a和图6-b可知,EPS由盐酸氨基葡萄糖、半乳糖、葡萄糖和甘露糖组成,摩尔比为2.48∶10.26∶50.22∶8.16。
乳酸菌胞外多糖通常由葡萄糖、甘露糖、半乳糖、鼠李糖及少量糖单元衍生物组成[10]。半乳糖、葡萄糖和甘露糖均含有醛基,容易被自由基氧化降解,使多糖具有抗氧化活性[18]。并且,多糖的抗氧化活性与葡萄糖、甘露糖含量呈显著正相关[19]。与本研究相似,瑞士乳杆菌MB2-1的胞外多糖由半乳糖、葡萄糖和甘露糖组成,对DPPH自由基、羟自由基和超氧阴离子自由基均有较强清除作用[20];动物双歧杆菌RH的胞外多糖主要由摩尔比为43∶34∶18∶4∶1∶1的葡萄糖、甘露糖、半乳糖、阿拉伯糖、果糖和鼠李糖组成,在抗氧化实验中表现出较强的羟自由基和超氧阴离子自由基清除活性[21]。由此推断,本研究中EPS的抗氧化活性与半乳糖、葡萄糖和甘露糖的存在及比例有关。

1-岩藻糖;2-盐酸氨基半乳糖;3-鼠李糖;4-阿拉伯糖; 5-盐酸氨基葡萄糖;6-半乳糖;7-葡萄糖;8-N-乙酰-D-氨基葡萄糖; 9-木糖;10-甘露糖;11-核糖 a-单糖标准品的离子色谱图;b-EPS的离子色谱图图6 单糖标准品和 EPS离子色谱图Fig.6 The ion chromatograms of monosaccharides standard and EPS
3 结论与讨论
巨噬细胞作为免疫细胞,在机体受到病理刺激时发挥免疫应答作用,消除外界应激源或诱导剂造成的不良影响。LPS 是革兰氏阴性菌外膜的主要成分,具有毒性,可促使巨噬细胞分化产生炎症介质(如NO)和细胞因子(如TNF-α、IL-1β和IL-6等),常用于研究氧化应激与炎症反应[5]。因此,本实验采用LPS诱导RAW264.7巨噬细胞建立氧化损伤模型,研究EPS对RAW264.7巨噬细胞氧化损伤的保护作用及机制。
已有研究证明,抗氧化酶活力的高低和MDA的水平可反映细胞氧化损伤的程度[22]。抗氧化酶SOD、CAT和GSH-Px 是细胞抗氧化防御体系中的重要组成部分,可通过清除体内的过量自由基和脂类过氧化物,保护生物膜结构和功能的完整性,从而减轻细胞氧化损伤[23];MDA是脂质过氧化反应的终产物之一,它具有细胞毒性,可诱使蛋白质、核酸等大分子物质发生交联聚合,使细胞出现异常分裂和癌变,最终导致细胞退化、引发疾病[24]。本实验中,EPS显著提高RAW264.7巨噬细胞内SOD、CAT和GSH-Px活性,并降低MDA含量,表明EPS对RAW264.7巨噬细胞的氧化应激反应具有抑制作用。炎症反应与氧化应激密切相关,LPS刺激可使RAW264.7巨噬细胞发生氧化应激,产生过量活性氧及炎症介质,诱导 iNOS 高度表达[13]。iNOS 是NO的上游激酶,通过调控NO的合成参与炎症反应[25]。NO是炎症反应中发挥重要作用的促炎因子,过量的NO可导致DNA损伤,诱导凋亡和氧化应激,最终加剧机体炎症,其分泌量可间接反映炎症程度[26-27]。TNF-α产生于炎症初期,它能刺激细胞产生炎症因子(如IL-1β和IL-6),使机体发生炎症,增加诱发类风湿性关节炎、哮喘和炎症性肠病的风险[26, 28]。本研究中,EPS降低了RAW264.7 巨噬细胞内NO含量,并抑制了TNF-α、IL-1β和IL-6的mRNA表达,表明EPS对RAW264.7巨噬细胞的炎症反应具有抑制作用。
Nrf2是调控氧化应激的关键因子,一方面,它通过激活SOD、CAT和GSH-Px等抗氧化酶增强组织抗氧化能力[22];另一方面,其可诱导HO-1的表达,HO-1能有效清除自由基,通过激活抗凋亡蛋白抑制过氧化反应[29]。正常情况下,NF-κB和IκB-α以复合物形式存在于细胞内;当细胞受到氧化应激刺激时,IκB-α发生磷酸化与降解,使NF-κB解离并被激活,进而促进多种炎症介质的产生,引起炎症反应[3]。本实验结果显示,RAW264.7巨噬细胞经EPS处理后,细胞内Nrf2、HO-1和IκB-α的mRNA表达量均上升,而NF-κB的mRNA表达量下降,提示EPS的抗炎抗氧化作用可能与Nrf2/HO-1/NF-κB通路有关,这与前人的研究结果一致[30]。
上述分析表明,发酵乳杆菌LFQ153EPS能够有效缓解LPS诱导的RAW264.7巨噬细胞氧化损伤,并且这种保护作用可能与与Nrf2/HO-1/NF-κB通路的调节有关。此外,对EPS的单糖分析表明,EPS的抗氧化活性还与半乳糖、葡萄糖和甘露糖的存在及比例有关。综上,本研究可为功能性发酵乳杆菌LFQ153胞外多糖的进一步开发利用提供理论依据。
