白藜芦醇调控线粒体通路诱导口腔鳞状细胞癌细胞凋亡
2022-05-07汪佳颖陶德韬王维康李先振周静萍
于 瑞,汪佳颖,陶德韬,王维康,黄 瑞,李先振,周静萍
(1.皖南医学院 口腔医学院,安徽 芜湖 241002;2.皖南医学院第一附属医院 弋矶山医院 口腔颌面外科,安徽 芜湖 241001)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔颌面部一种较常见的恶性肿瘤[1]。目前OSCC标准化的治疗是手术切除以及随后辅助放化疗。其中手术治疗会造成颌面部较大面积的缺损,从而导致患者身体和心理上遭受较大的伤害;也有很多患者由于化疗药物的副作用以及耐药性,而放弃治疗或最终治疗失败[2]。所以,寻找出新的低毒高效的抗癌剂和化疗增敏药物是改善OSCC预后的关键。
白藜芦醇是一类天然的多酚类物质,其具有广泛的药理作用和良好的生物学活性,可以调节代谢,保护心血管,抗炎和抗肿瘤等[3]。有研究提到其能通过阻滞细胞周期、调节相关蛋白表达及活化线粒体等途径,诱导胃癌、肝癌和卵巢癌等肿瘤细胞凋亡的发生[4-6]。但白藜芦醇对OSCC的相关研究报告较少,是否能作为一种天然的肿瘤化学预防剂应用于OSCC,目前尚无明确的机制研究。本研究采用HN4、Cal27、HN6 3种细胞株作为研究对象,观察白藜芦醇对OSCC细胞凋亡的影响,探索线粒体通路在OSCC细胞发生凋亡的过程中起到的作用,为OSCC临床治疗提供新的方向。
1 材料与方法
1.1 实验材料 人OSCC细胞HN4、Cal27、HN6(ATCC公司);DMEM-F12培养基、DMEM、胰酶及胎牛血清(美国GIBCO);白藜芦醇、线粒体分离试剂盒、二甲基亚砜(DMSO)、β-actin鼠抗(上海碧云天);Bax、Bcl-2、caspase3、cytochrome C兔抗(武汉ABclonal);MTT试剂盒、细胞裂解液、BCA蛋白浓度测定试剂盒(凯基生物);Real Master Mix RT-PCR试剂盒、逆转录试剂盒(北京天根)。
1.2 方法
1.2.1 细胞培养 HN4、Cal27在DMEM完全培养基中培养。HN6在DMEM-F12完全培养基中培养。CO2恒温培养箱保持37℃左右,细胞生长至瓶底90%左右进行传代。
1.2.2 细胞处理 细胞贴壁后,分成对照组和处理组。对照组:未作任何处理的3种细胞;处理组:不同浓度梯度的白藜芦醇处理3种细胞。
1.2.3 MTT法测定OSCC细胞的活力 细胞按1x104个/孔均匀铺在96孔板中,通过预实验确定白藜芦醇的作用浓度梯度。不同浓度梯度(25、50、100、200、400μmol/L)的白藜芦醇处理96孔板24、48 h,设置对照组和调零组,每组6个复孔。每孔加入50 μL 1×MTT至蓝色结晶出现后,使用150 μL DMSO充分溶解蓝色结晶。酶联免疫检测仪570 nm测定各孔的吸光值(即OD值)。细胞活力计算:细胞存活率=[(处理组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。本次实验共重复3次。
1.2.4 蛋白质免疫印迹法(Western blot) 将生长状态良好的3种细胞分别铺在6孔板上,细胞贴壁后处理组中分别加入50、100、200 μmol/L白藜芦醇处理48 h,设置对照组(对照组不作处理)。细胞裂解液和PMSF提取细胞的总蛋白和胞浆蛋白,胞浆蛋白提取时需加入线粒体分离试剂。采用BCA试剂盒测量浓度。用10% SDS-PAGE凝胶分离蛋白,通过湿法转印到NC膜上;脱脂牛奶封闭1 h,后放入一抗Bax、Bcl-2、Cyt-c、caspase3、cleared-caspase3中4℃摇床过夜,β-actin为内参对照;二抗孵育1.5 h后用化学发光分析仪曝光,实验均重复3次。
1.2.5 实时荧光定量PCR(RT-PCR) 细胞处理同Western blot处理组,β-actin内参对照,目的基因引物序列由上海生工设计(表1),Trizol法提取总RNA,按照Real Master Mix RT-PCR试剂盒说明进行反应液的配制,逆转录后使用7500ABI real-time PCR仪进行检测,实验重复3次。

表1 RT-PCR所需引物序列

2 结果
2.1 白藜芦醇降低了OSCC细胞的存活率 不同浓度白藜芦醇处理24、48 h后,OSCC细胞数目明显减少,密度降低(图1)。酶标仪读取OD值后计算细胞活力。在25、50、100、200、400 μmol/L白藜芦醇分别处理3种细胞24、48 h后(表2),3种细胞活力在50~400 μmol/L浓度上均低于0 μmol/L浓度(P<0.05);在50~400 μmol/L浓度处理48 h后,3种细胞活力均低于24 h(P<0.05)。
2.2 Western blot法检测白藜芦醇对相关凋亡蛋白表达量的影响
2.2.1 白藜芦醇处理后 Bax和Bcl-2的蛋白表达量变化见图2、表3,与对照组0 μmol/L相比,在100和200 μmol/L浓度作用HN4、Cal27细胞时,Bcl-2蛋白表达低于对照组(P<0.05);在HN6细胞中,50~200 μmol/L浓度时Bcl-2蛋白表达低于对照组(P<0.05)。而在50~200 μmol/L浓度处理HN4、HN6细胞时,Bax蛋白表达高于对照组(P<0.05);在Cal27中,100和200 μmol/L浓度时Bax蛋白表达高于对照组(P<0.05)。说明白藜芦醇促凋亡过程中调控了Bcl-2、Bax的变化。
2.2.2 经白藜芦醇处理后,与对照组0 μmol/L相比(图3、表4),不同浓度处理3种细胞总蛋白中cyt-c的表达量没有明显的变化(P>0.05),接着提取3种细胞的胞浆蛋白,发现50~200 μmol/L浓度时胞浆蛋白内的cyt-c表达量高于对照组;且随着处理浓度的增加,cyt-c表达量也在逐渐上升(P<0.05)。白藜芦醇的促凋亡作用可能与cyt-c释放到胞浆内的过程密切相关。
2.2.3 与对照组0 μmol/L相比(图4、表5),随着白藜芦醇处理浓度的增加,50~200 μmol/L浓度时HN4、Cal27细胞内的caspase3表达并未出现变化(P>0.05);HN6细胞内的caspase3表达在200 μmol/L时略有下降(P<0.05),而3种细胞cleaved-caspase3的表达在100和200 μmol/L时均高于对照组(P<0.05)。因此,可以说明在白藜芦醇的作用下OSCC中的caspase3被活化。
2.3 实时荧光定量PCR检测白藜芦醇处理后相关因子mRNA表达情况 不同浓度的白藜芦醇处理细胞48 h后,RT-PCR检测Bax、Bcl-2及cyt-c mRNA的表达量变化,与对照组0 μmol/L相比(表6),3种细胞Bcl-2 mRNA表达在100和200 μmol/L时均低于对照组(P<0.05),在100、200 μmol/L浓度作用HN4、Cal27细胞时,Bax、cyt-c mRNA表达均高于对照组(P<0.05);在200 μmol/L浓度处理HN6时,Bax、cyt-c mRNA表达高于对照组(P<0.05)。说明白藜芦醇可能是通过调控Bcl-2、Bax来参与OSCC的凋亡过程,且其促凋亡的过程与cyt-c释放的过程有关。

图1 白藜芦醇对HN4、Cal27、HN6细胞数目的影响(×1,00)
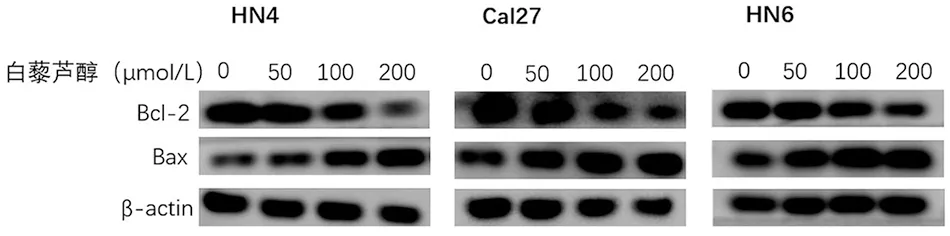
图2 Western blot检测白藜芦醇对3种细胞中Bcl-2和Bax蛋白的影响
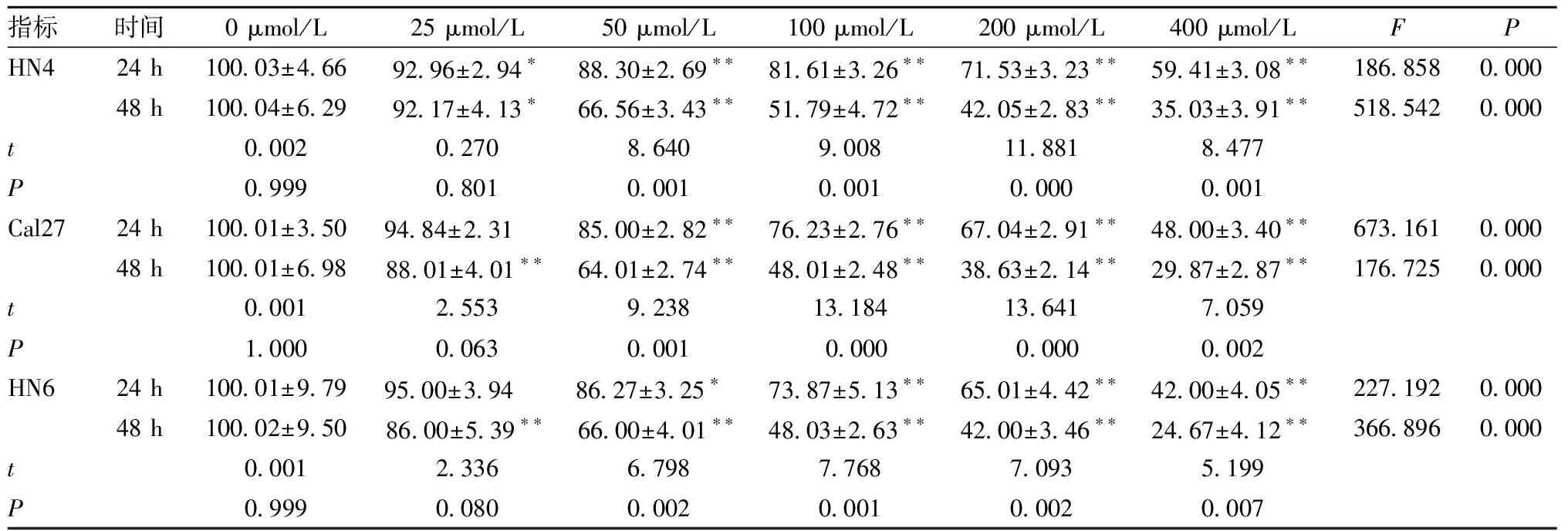
表2 白藜芦醇对HN4、Cal27、HN6细胞活力的影响(n=3,%)
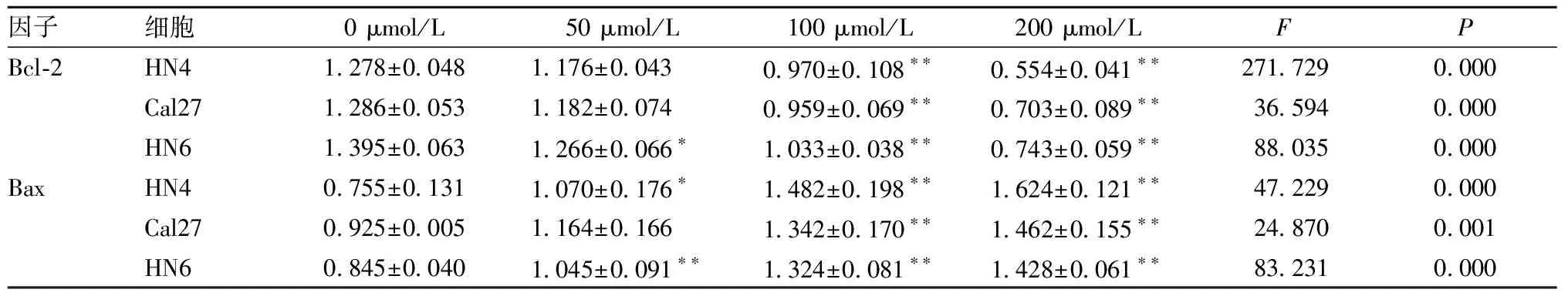
表3 白藜芦醇对3种细胞处理后Bcl-2和Bax蛋白表达量变化(Gene/β-actin,n=3)
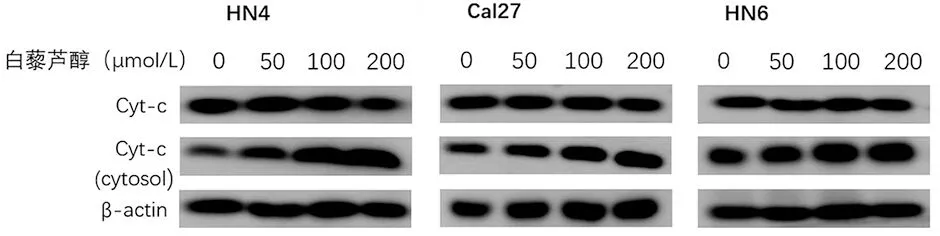
图3 Western blot检测白藜芦醇作用后3种细胞中cyt-c蛋白表达量变化
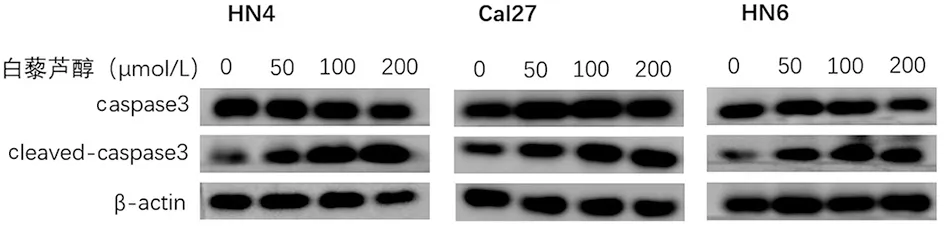
图4 Western blot检测白藜芦醇作用后3种细胞中caspase3及cleaved-caspase3的蛋白表达量变化
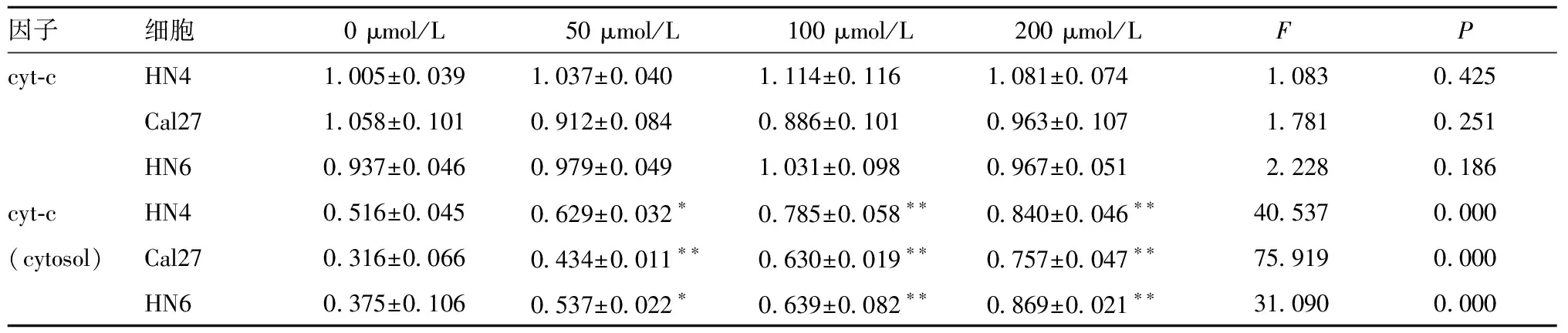
表4 白藜芦醇对3种细胞处理后cyt-c蛋白表达量变化(Gene/β-actin,n=3)
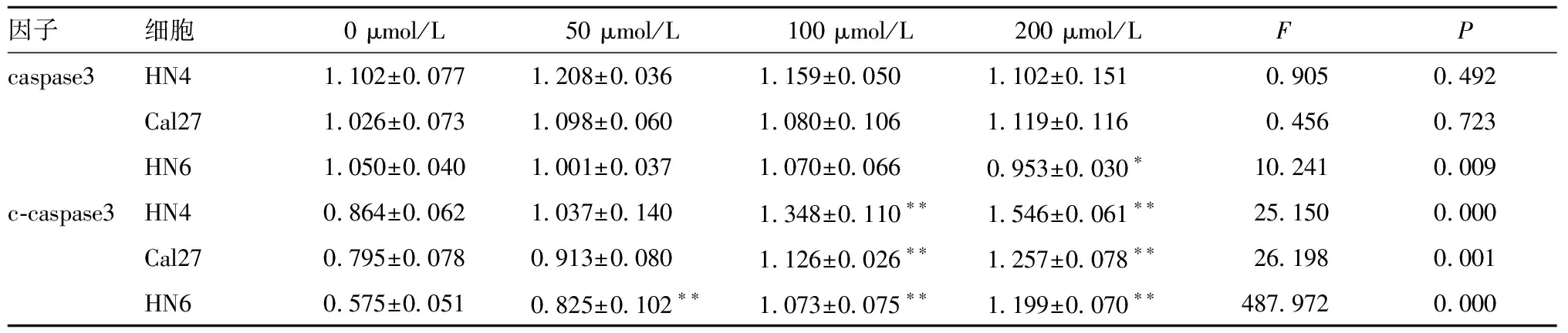
表5 白藜芦醇对3种细胞处理后caspase3蛋白表达量变化(Gene/β-actin,n=3)
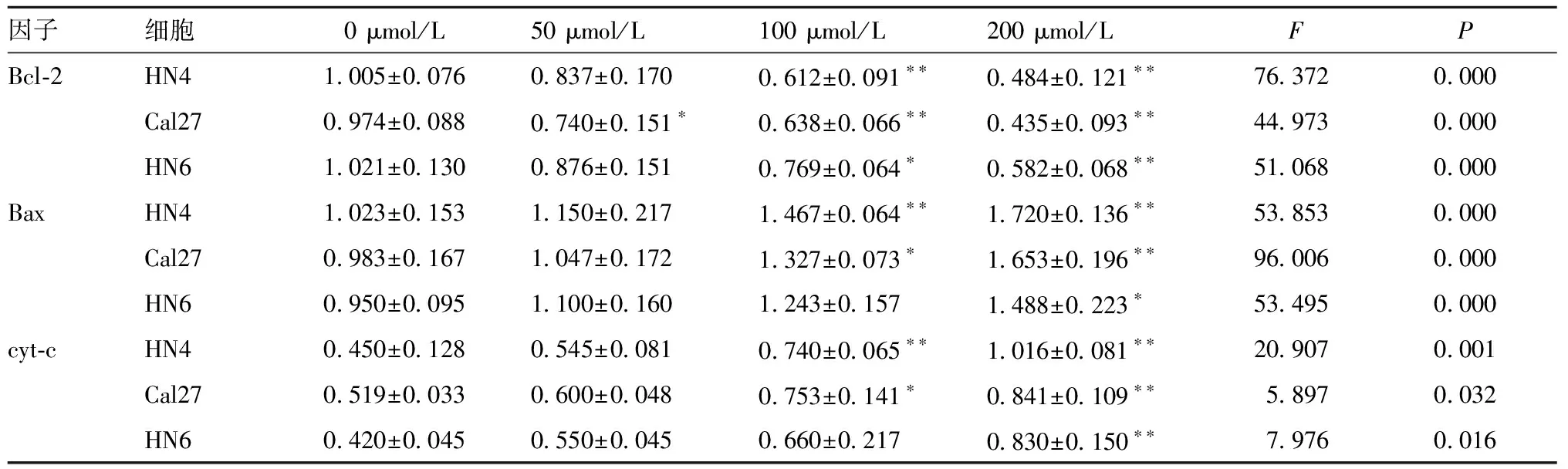
表6 白藜芦醇处理后3种细胞Bcl-2、Bax及cyt-c mRNA表达量变化(Gene/β-actin,n=3)
3 讨论
白藜芦醇作为天然抗氧化剂,多种肿瘤细胞的细胞活力能够被其抑制[3],其抗肿瘤作用引起了广泛的关注。本研究中我们通过MTT法发现,在25、50、100、200、400 μmol/L白藜芦醇处理OSCC细胞后,对OSCC细胞存活率的影响呈现浓度和时间的依赖性。这提示了我们白藜芦醇可以明显抑制人OSCC细胞的细胞活力,对OSCC细胞可能有促进凋亡的作用。但由于25 μmol/L白藜芦醇作用于OSCC细胞时,细胞活力的变化差异无统计学意义;而在作用浓度400 μmol/L时,细胞存活率较低,不具有实验意义,故选用浓度梯度为50、100、200 μmol/L白藜芦醇用于后续实验。
细胞凋亡过程的启动由细胞内一系列基因交叉控制。在线粒体凋亡通路中,Bcl-2家族起到了较为重要的作用[7]。Bcl-2是家族中主要的抗凋亡蛋白,其同源基因Bax可以与其形成异源二聚体Bcl-2/Bax来抑制凋亡,也可以自身形成同源二聚体Bax/Bax来促进凋亡发生,两者均广泛存在于线粒体中[8]。所以,在线粒体凋亡通路中,Bcl-2/Bax的比例决定着线粒体外膜通路开放的程度,是调节凋亡过程的“阀门”[9]。本研究中我们发现,伴随着白藜芦醇诱导浓度的上升变化,Bcl-2逐渐减少,Bax逐渐升高。这一结果提示,白藜芦醇可能是通过调节Bcl-2、Bax的变化,形成大量Bax/Bax来促进OSCC发生凋亡,这一过程可能有线粒体的参与。
线粒体是真核细胞能量代谢的中心,功能异常会导致细胞凋亡的发生[10]。在线粒体凋亡通路中cytochrome C释放入胞质,是线粒体通路激活的标志[11]。本研究中我们发现白藜芦醇处理后,细胞总蛋白中cyt-c表达量没有明显变化,而胞浆蛋白中cyt-c的表达随白藜芦醇浓度的增加而上升。cytochrome C释放后可以与Apaf-1、Pro-caspase9合成凋亡小体,最终激活caspase3。而caspase3活化是caspase级联反应的最后一步[12],其可以通过分解DNA修复酶、激活核酸内切酶来促进细胞凋亡的发生[13]。本研究中发现caspase3的表达没有明显变化或略微下降,而cleaved-caspase3则随作用浓度增加而上升。有报道显示Bax可以增加线粒体通透性,激活线粒体通路促进凋亡发生[7];而Bcl-2可以通过稳定线粒体膜电位,阻止cytochrome C释放到胞浆内,来发挥抗凋亡的作用[8]。这提示我们,白藜芦醇作用后可能是通过调节Bcl-2、Bax的表达,活化线粒体通路,使cyt-c向胞浆内释放激活caspase3,最终促使OSCC细胞发生凋亡。除此以外,在凋亡发生过程中,细胞内外Ca2+交换、活性氧水平的改变和线粒体膜通透性的改变等都有可能会影响cyt-c的释放[14-15],以上这些仍待我们进一步的探究。
综上所述,本研究结果表明白藜芦醇可能是通过调节Bax、Bcl-2因子来激活线粒体通路,使cyt-c向胞浆内释放激活caspase3,最后诱导OSCC发生凋亡。本研究结果为白藜芦醇的临床应用奠定了理论基础,然而,本研究仅是通过体外实验而得出的结论,对于白藜芦醇在临床上的应用仍需进一步探究。OSCC细胞凋亡的过程是由多种因素调控的,除线粒体通路外,可能还存在与其他途径之间的相互关联,这也需要我们通过更进一步的研究来探讨。
