4-PBA治疗单侧肾输尿管结扎小鼠肾脏纤维化的机制探讨
2022-05-07徐爱萍邵德翠
余 剑,陈 曦,方 洁,徐爱萍,邵德翠
(皖南医学院 细胞电生理研究室,安徽 芜湖 241002)
慢性肾脏疾病(chronic kidney disease,CKD)已成为全球性公共卫生问题,各种危险因素如高血糖、高尿酸、肥胖等都可导致CKD,其发病率逐年增加。肾脏纤维化是CKD的特征之一,以细胞外基质的过度沉积和大量肌纤维母细胞的浸润为其主要特征[1]。对肾纤维化的机制认知尚不完全,仍缺乏非常有效、特异的治疗手段。
近年来,内质网应激(endoplasmic reticulum stress,ERS)成为关注的新热点,内质网(endoplasmic reticulum,ER)是细胞内除核酸以外的生物大分子合成的场所。正常生理情况下,ER具有强大的维持细胞内环境稳态的功能,当某种诱因(如葡萄糖或营养物质的缺乏、脂质过度负荷、Ca2+代谢失衡、氧化应激与缺血再灌注等)打破了这种稳态,使细胞内蛋白质合成速度过快,超过了ER折叠能力,导致ER处于一种生理功能紊乱状态,即形成ERS[2]。ERS与急性肾损伤向CKD的转变密切相关[3-4]。4-苯基丁酸(4-phenylbutyric acid,4-PBA)是化学合成的小分子伴侣,可以减轻ERS[5]。故我们研究目的在于探讨4-PBA治疗是否可以缓解UUO所致的肾脏纤维化,并在培养的肾小管上皮细胞探讨其改善肾脏纤维化的机制。
1 材料与方法
1.1 材料
1.1.1 动物 雄性C57BL/6J小鼠(20~25 g)购自南京青龙山。动物合格证号:SCXK(豫)2019-0002。
1.1.2 药物及主要试剂 DMEM低糖培养基(Cat#8120459,Gbico)和新生牛血清(Gbico);100×的青霉素和链霉素溶液(Cat#BL008A,BIOMIKY)、ECL化学发光试剂(Beyotime Biotechnology)、BCA蛋白测定试剂(Beyotime Biotechnology);4-PBA(Sigma);一抗:Fibronectin、Collagen Ⅳ、GRP78和p47phox抗体购自abcam公司;二抗:HRP标记山羊抗兔IgG(H+L)(Cat#A0208)、HRP标记山羊抗小鼠IgG(H+L)(Cat#A0216)购自Beyotime Biotechnology。
1.1.3 主要仪器 EPOCH全波长酶标仪(美国伯腾仪器有限公司)、多样品组织研磨机(上海净信Tissuelyser-32)、垂直电泳仪(伯乐)、凝胶成像分析仪器(GE,AI600)。
1.2 方法
1.2.1 实验动物与分组 20~25 g的雄性C57BL/6J小鼠进行单侧输尿管梗阻(unilateral ureteral obstruction,UUO)手术后随机分为2组:UUO模型组,UUO+4-PBA组。
1.2.2 UUO模型制备与用药 参考文献[6]进行UUO手术。C57BL/6J小鼠麻醉后取仰卧位固定于手术台上,腹部脱毛、消毒、铺巾,腹正中直切口约2 cm,分离筋膜及肌肉,暴露出左侧肾脏和输尿管,在肾盂输尿管连接处游离输尿管,以3-0丝线在左肾下极结扎两道,确认无出血后逐层缝合并关闭腹腔。麻醉苏醒后常规喂食、水。手术后第2日开始灌胃给药,每日给予4-PBA(300 mg/kg)灌胃,UUO组给予等体积的生理盐水灌胃,共14 d。
1.2.3 细胞培养 肾小管上皮细胞(NRK-52E)用10%新生牛血清的含青霉素和链霉素的DMEM低糖培养基置于37℃、5%CO2培养箱中。
1.2.4 Western blot 如前所述进行Western blot[7],肾皮质研磨后,将组织匀浆于4℃、5 000 r/min离心10 min取上清,测定样品蛋白浓度。样品与(5×)缓冲液4∶1混合,煮沸5 min,放置-80℃冰箱保存备用。等量蛋白质上样,用7.5%~10%的SDS-聚丙烯酰胺凝胶进行电泳。吸附了蛋白的PVDF膜用5%的牛奶(TBST溶解)在室温下封闭1 h,然后放入相应的一抗中,4℃孵育过夜。用TBST洗膜后,室温下二抗孵育2 h,洗膜。避光显色,曝光。以Actin或GAPDH为内参照,Image J软件进行光密度值定量分析。

2 结果
2.1 4-PBA减轻UUO小鼠肾脏纤维化和ERS 天狼星红染色法观察梗阻侧肾脏胶原沉积变化的结果显示,相较于UUO组,4-PBA治疗改善梗阻侧肾组织的红色胶原沉积(图1)。
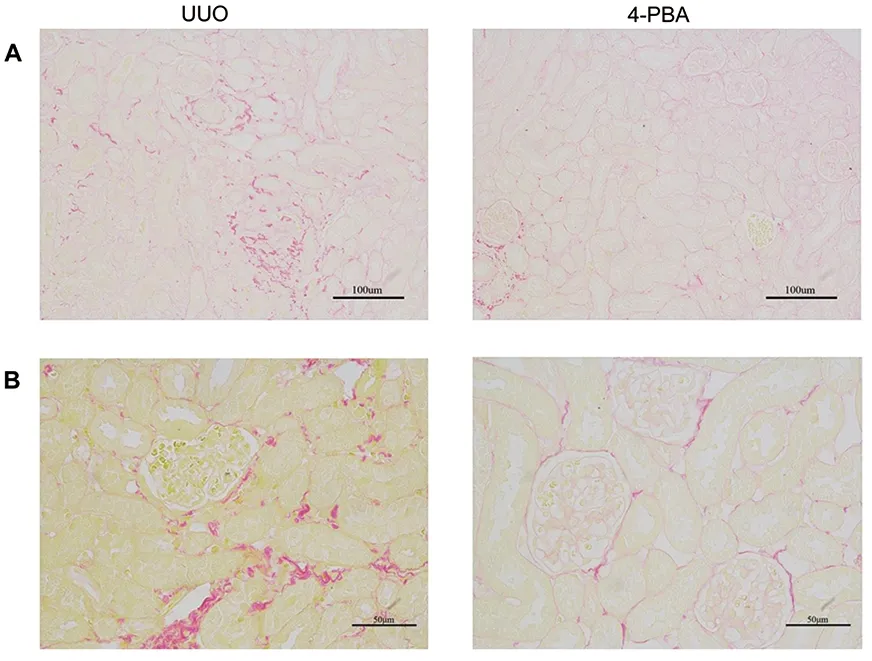
A.200×;B.400×。
Western blot显示,相较于UUO组,4-PBA降低了梗阻侧肾皮质的Fibronectin和Collagen Ⅳ蛋白表达水平(P<0.05)(图2);4-PBA灌胃14 d降低了梗阻侧肾皮质的ERS标志蛋白GRP78的表达量(P<0.05)(图3)。
2.2 4-PBA减轻TGF-β诱导的NRK-52E细胞外基质合成、ERS和氧化应激 用5 ng/mL和10 ng/mL的TGF-β处理NRK-52E细胞48 h,Western blot分析显示:相较于对照组(0 ng/mL),10 ng/mL的TGF-β明显增加NRK-52E中GRP78和Fibronectin的蛋白表达水平(P<0.05)(图4)。
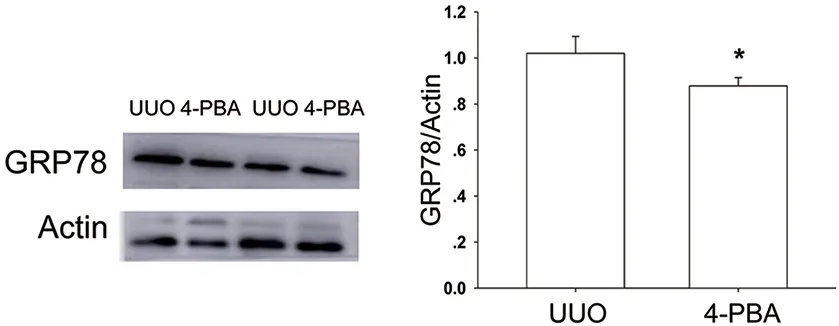
n=3,t=-2.996,P=0.040;与UUO组比较,*P<0.05。
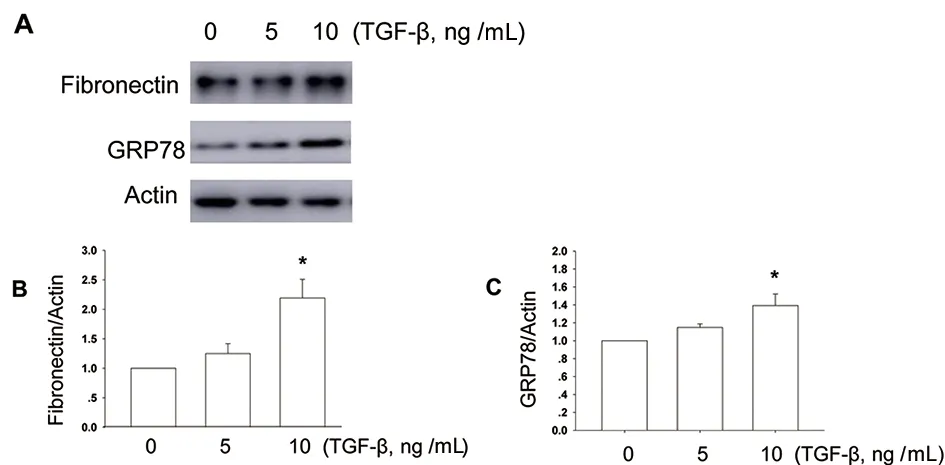
分别用5 ng/mL、10 ng/mL TGF-β处理NRK-52E细胞48 h;Western blot观察与分析不同剂量的TGF-β对Fibronectin和GRP78蛋白表达量的影响;n=3,F1=9.210,P1=0.015;n=5,F2=6.580,P2=0.012;与0 ng/mL比较,*P<0.05。
Western blot显示,4-PBA(2 mmol/L)降低TGF-β(10 ng/mL)诱导的GRP78、Fibronectin和Collagen Ⅳ的蛋白表达水平(P<0.05)(图5)。
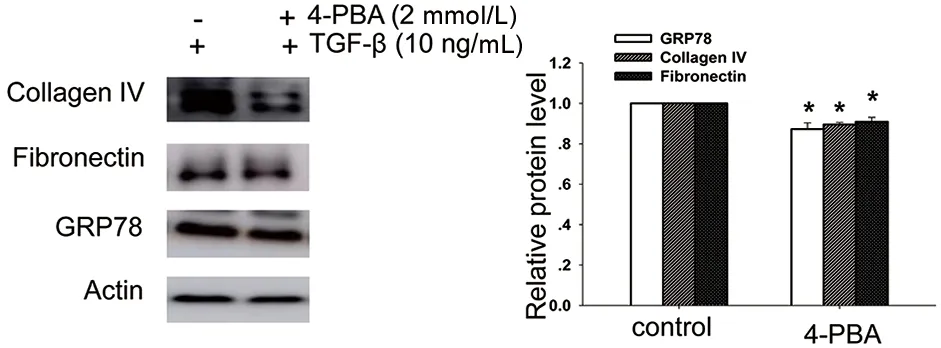
10 ng/mL TGF-β、4-PBA(2 mmol/L)处理NRK-52E细胞48h;Western blot显示4-PBA对TGF-β诱导的Fibronectin、Collagen Ⅳ和GRP78蛋白表达量的影响;n=3,t1=4.173,t2=4.509,t3=4.199,P1=0.014,P2=0.011,P3=0.014;与对照组比较,*P<0.05。
4-PBA处理NRK-52E 48 h,Western blot显示,4-PBA(2 mmol/L)降低了TGF-β(10 ng/mL)诱导的p47phox蛋白表达量(P<0.05)(图6)。
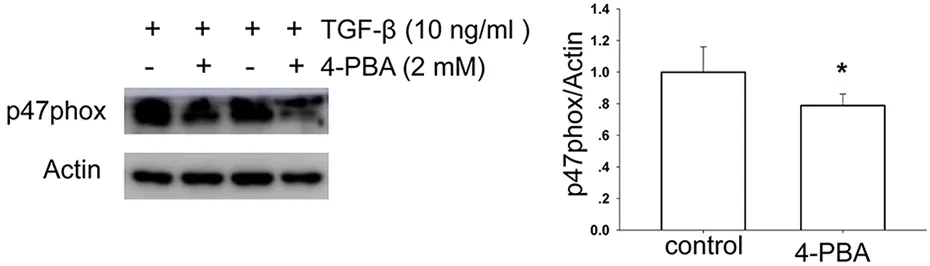
10 ng/mL TGF-β、4-PBA(2 mmol/L)处理NRK-52E细胞48h;Western blot观察与分析4-PBA对TGF-β诱导的p47phox蛋白表达量的影响;n=4,Z=2.309,P=0.021;与对照组比较,*P<0.05。
3 讨论
近年来,针对肾脏纤维化的治疗有抗TGF-β靶向治疗、肾素血管紧张素系统的药物研发,但其临床疗效仍难以获得满意的治疗效果,积极有效地针对靶点选择仍被视为防止肾纤维化的重要策略[8]。ERS在肾损伤中的作用已成为近年来的热门话题,UUO小鼠肾纤维化模型上,ERS导致小鼠肾细胞凋亡和随后的纤维化,使用血管紧张素受体拮抗可明显改善纤维化,其减轻肾纤维化与调控ERS信号通路有关,提示ERS可能参与了肾纤维化的发病机制[9],减轻ERS有望成为预防肾纤维化的一个潜在靶点[10]。
4-PBA作为一种低分子量的化学伴侣,可以防止错误折叠的蛋白质聚集并减轻ERS。近年来,其在防治肾纤维化中的作用逐渐得到学者的关注,有研究表明4-PBA减弱UUO大鼠的肾纤维化,并且4-PBA在体内外肾纤维化模型中显著减弱了GRP78蛋白的表达[11]。这与我们在UUO小鼠肾纤维化模型的研究结果一致,提示4-PBA可能通过减轻ERS而延缓肾纤维化的进展。
ERS参与肾损伤的机制可能与氧化应激有关,ROS积累可上调细胞凋亡硫氧还蛋白相互作用蛋白(TXNIP)的表达,刺激磷脂酰肌醇3激酶(PI3K)通路、p38MAPK信号通路与核细胞凋亡、转录因子(NF-κB)信号通路,这些信号通路在CKD的发病机制中起着至关重要作用[12]。肾脏ROS的产生主要由多种NADPH氧化酶(NOX)介导[13]。NOX包括NOX1、NOX2、NOX3、NOX4、NOX5和双氧化酶Duox(Duox1和Duox2)。NOX4是目前与肾纤维化最为密切、研究最为广泛的NOX亚型,沉默NOX4可显著抑制TGF-β诱导的NOX活性刺激,抑制TGF-β受体[14]。p47phox和p67phox是NOX2的经典调节亚单位。本研究中,4-PBA可显著降低TGF-β诱导的NRK-52E的ROS生成和p47phox蛋白的表达,提示除NOX4外,NOX2可能参与肾纤维化,4-PBA可以通过NOX2减少ROS的产生。
虽然本实验证实了减轻ERS可以缓解肾脏纤维化,但ERS信号通路错综复杂,ERS是由位于内质网的三种不同跨膜蛋白质介导:蛋白激酶样内质网激酶(PERK)、肌醇需要酶1(IRE1)和激活转录因子6(ATF6)。正常状态下,IRE1、PERK和ATF6蛋白与内质网上的GRP78结合,呈无活性状态;ERS发生时,IRE1和PERK从GRP78上分离后,形成二聚体,发生自身磷酸化后激活未折叠蛋白反应(UPR),而ATF6则转移至高尔基体被进一步的剪切与激活。IRE1、PERK和ATF6三条通路激活强度以及持续时间,都可以改变细胞生理或病理反应的走向,从而决定细胞的命运:死亡或生存[15-16]。后续的研究中我们将进一步探讨ERS不同通路在UUO肾纤维化的发生发展中所起的作用。
综上所述,本研究结果表明4-PBA在UUO小鼠模型和TGF-β诱导的细胞损伤中均能有效地对抗肾纤维化,其机制可能与减轻ERS和氧化应激有关,提示抑制ERS是潜在的防治肾纤维化的治疗靶点。
