达格列净通过上调SIRT1增强糖尿病肾病大鼠肾脏细胞自噬从而抑制足细胞损伤*
2022-05-06熊哲学唐明娟李凝旭
熊哲学, 唐明娟, 李凝旭
(华中科技大学同济医学院附属梨园医院肾内科,湖北 武汉 430000)
糖尿病肾脏疾病(diabetic kidney disease,DKD),也称为糖尿病肾病,是由糖尿病引发的一类重大肾脏并发症,长期高糖状态对肾脏足细胞的损伤加速了DKD 的进展,临床上会以尿蛋白的形式表现出来[1-2]。足细胞是肾小球滤过屏障不可或缺的一部分,它们是一类高度分化的细胞群,损伤丢失后无法增殖,自噬作为维持足细胞稳态的防御机制,其活跃程度成为了保持足细胞完整性的关键[3],然而现有研究表明自噬在糖尿病和肥胖症等营养过剩的能量状态下是被抑制的,在饥饿或营养剥夺状态下则被激活[4-6],因此DKD 的发展与肾脏自噬的缺失存在紧密联系。达格列净是一种钠-葡萄糖协同转运蛋白2 抑制剂(sodium-glucose cotransporter 2 inhibitors,SGLT2i),最初适用于降低血糖,因其极大的肾脏保护作用而受到广泛关注。有学者推测[7],在SGLT2i的使用过程中,通过加大尿液葡萄糖的排泄,不仅仅降低了血糖,更模拟了一种营养剥夺或能量丢失的机体生理状态,通过上调能量感受器沉默信息调节因子2相关酶1(silent information regulator factor 2-related enzyme 1,SIRT1)的表达,刺激了肾脏自噬流量,从而抑制了高糖对足细胞的持续损伤,延缓了DKD 的进展。目前对于此方向的研究几乎是空白的,本实验的目的是通过对DKD 大鼠的喂养与治疗,观察各组目的蛋白的表达情况,探讨达格列净是否通过上调SIRT1 的表达来增强肾脏自噬通量,并抑制足细胞损伤,遏制DKD的进一步发展。
材料和方法
1 实验材料
1.1 实验试剂及设备 达格列净片购自AstraZeneca;链脲佐菌素(streptozotocin,STZ)购自Sigma;抗SIRT1 抗体、抗微管相关蛋白 1 轻链 3(microtubuleassociated protein 1 light chain 3,LC3)抗体、抗 beclin-1 抗体、抗 NPHS2 抗体、抗 GAPDH 抗体、辣根过氧化物酶标记的羊抗兔IgG 抗体及辣根过氧化物酶标记的羊抗鼠IgG 抗体均购自Proteintech;BCA 检测试剂盒、SDS 制胶试剂盒及DAPI 染色剂均购自武汉赛维尔生物科技有限公司。全自动生化检测分析仪(BECKMAN COULTER AU5800);ChemiDoc XRS+成像系统(Bio-Rad);荧光显微镜(Nikon Eclipse C1);透射电子显微镜(HITACHI)。
1.2 实验动物及饲料 20只SPF 级雄性SD 大鼠,4~5 周龄,体重75~105 g,订购于三峡大学动物实验中心,许可证号SCXK(鄂)2017-0012。高脂饲料及普通饲料购自武汉市万千佳兴生物科技有限公司。本研究已通过华中科技大学同济医学院实验动物伦理委员会审批[伦审字(S822)号]。
2 实验方法
2.1 DKD 模型构建 20只 4~5 周龄 SD 雄性大鼠被饲养在标准的12 h 光/暗周期的笼子里,可以自由获取食物和水,恒定室温为(23±2)℃,相对湿度为(45±10)%,随机分选出6只大鼠作为对照组,另14只大鼠用作后续糖尿病模型构建。对照组饲以普通饲料,准备用作造模的大鼠给予高脂饲料喂养4 周,然后连续3 日空腹腹腔注射链STZ(35 mg/kg,溶于pH 4.2 的柠檬酸-柠檬酸钠缓冲液中)[8-9],注射 STZ 前后记录大鼠体重、进水量、血糖。一周后对大鼠进行血糖检测,空腹血糖≥16.7 mmol/L 及观察到显著“三多一少”症状的大鼠确定为糖尿病成功模型动物,14只大鼠中造模成功12只。成模后的糖尿病大鼠继续给予高脂高糖饲料,两周后将其随机分为糖尿病组及达格列净组,每组6只,达格列净组大鼠按照达格列净 1 mg·kg-1·d-1每日 17 时定时灌胃治疗,糖尿病组大鼠用生理盐水1 mg·kg-1·d-1每日17 时定时灌胃治疗。治疗4 周后在代谢笼中收集每只大鼠24 h 尿液,之后所有大鼠麻醉,取血、摘除肾脏(称重),将部分肾组织固定在4%甲醛中进行组织化学分析,部分肾组织置于2.5%的戊二醛固定液中进行电子显微镜检查。最后将其余肾组织立即冷冻在液氮中,并保存在-80 ℃中,直到进一步分析。
2.2 生化分析指标 血液及尿液标本于4 ℃、12 000×g离心15 min,取上清液送华中科技大学附属梨园医院检验医学科行全自动分析仪检测,检测内容包括空腹血糖、空腹胰岛素、肌酐、尿总蛋白和尿白蛋白。
2.3 透射电镜 麻醉处死各组大鼠前准备好电镜固定液,取出新鲜肾脏标本,用手术刀片切割至黄豆大小,再将切割好的小块肾脏转移至装有新的电镜固定液的EP 管内固定。依次经过后固定、漂洗、脱水、包埋、过夜后制成树脂块备用。树脂块于超薄切片机中行60~80 nm 超薄切片,150 目方华膜铜网捞片,铜网切片放入铜网盒内室温干燥过夜。最后置于透射电子显微镜下观察并采集图像进行分析。使用Image J 软件(Madison,WI)分别对每组大鼠中的某一个肾脏截面电镜图的随机7 个肾小球视野进行肾小球结构参数分析。
2.4 Western blot 首先使用RIPA 裂解液与蛋白酶抑制剂Cocktail 从肾脏皮质区组中提取总蛋白;然后用BCA 蛋白质浓度测定试盒定量测定蛋白浓度,在配置好的10 孔SDS-PAGE 凝胶中上样,之后电泳分离,将目的蛋白转致PVDF 膜;然后用指定的Ⅰ抗(SIRT1、LC3、beclin-1、NPHS2)及内参照 GAPDH 抗体4 ℃下孵育过夜,之后将膜与Ⅱ抗(辣根过氧化物酶标记的羊抗兔/鼠IgG 抗体)于室温下孵育,最后用化学发光试剂盒显影,于多功能数字凝胶成像分析系统暗箱中曝光,观察免疫反应条带并采集图像。使用ImageJ 软件进行各目的蛋白表达的相对丰度分析,每组样本均进行3次独立重复实验取平均值。
2.5 免疫荧光检测 将待染组织切片置于65 ℃恒温箱烤片1 h,依次进行脱蜡、抗原修复、封闭非特异性抗原表位等步骤。按所需目的抗体孵育特异性Ⅰ抗(LC3、NPHS2)于4 ℃湿盒中静置过夜。次日取出切片,室温下复温30 min,PBS 洗涤3 次,每次5 min,选取相应的免疫荧光Ⅱ抗滴加于肾脏组织上,PBS洗涤3 次,每次5 min。避光条件下,DAPI 染液染细胞核后用PBS 洗涤3 次,每次5 min。最后使用荧光显微镜在相同曝光时间下进行观察拍照。使用Image J 软件进行肾小球区域荧光半定量分析,我们随机截取了每组大鼠中的某一个肾脏荧光切面图中50个肾小球区域进行测量。
3 统计学处理
采用GraphPad Prism 8.0.2 软件进行统计学分析及图形制作。计量资料以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 造模前后大鼠血糖、体重和饮水量变化
适应性喂养1 周后,将准备用于造模糖尿病的大鼠开始行高脂饲料喂养4 周,在第6 周开始注射STZ 造模,造模前后两周内(第5、7 周)3组大鼠的体重、血糖以及进水量变化趋势如表1 所示,可以观察到注射STZ 7 周后的糖尿病组大鼠相对于对照组体重减轻、血糖显著升高及饮水量显著增多(P<0.05)。

表1 注射STZ前后大鼠血糖、体重和饮水量变化Table 1. Changes of fasting blood glucose,body weight and water drinking before and after STZ injection(Mean±SD)
2 大鼠一般生理指标
经过4 周治疗后,肾重在3组大鼠中无显著差异;与糖尿病组比较,达格列净组大鼠的体重和尿量显著增加(P<0.05);与糖尿病组比较,达格列净组大鼠肾重/体重比降低(P<0.05),见表2。
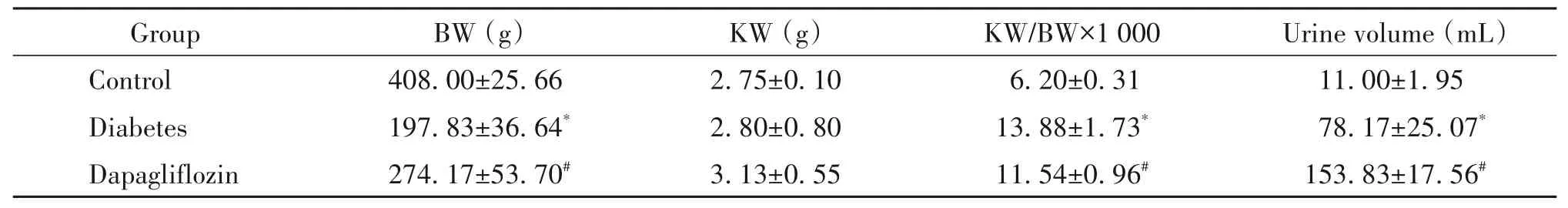
表2 各组大鼠体重、肾重、肾重/体重比和尿量比较Table 2. Comparison of body weight(BW),kidney weight(KW),kW/BW ratio and urine volume among groups(Mean±SD. n=6)
3 大鼠各项生化指标
如表3 所示,达格列净组大鼠经过治疗,血肌酐(serum creatinine,SCr)较糖尿病组增加(P<0.05);24 h 尿总蛋白(total urinary protein,UTP)、24 h 尿白蛋白(urinary albumin,UAlb)、空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting insulin,FIns)和稳态模型胰岛素抵抗指数(homeostasis model assessment-insulin resistance index,HOMA-IR;HOMA-IR=FBG×FIns/22.5[10])较糖尿病组显著降低(P<0.05)。
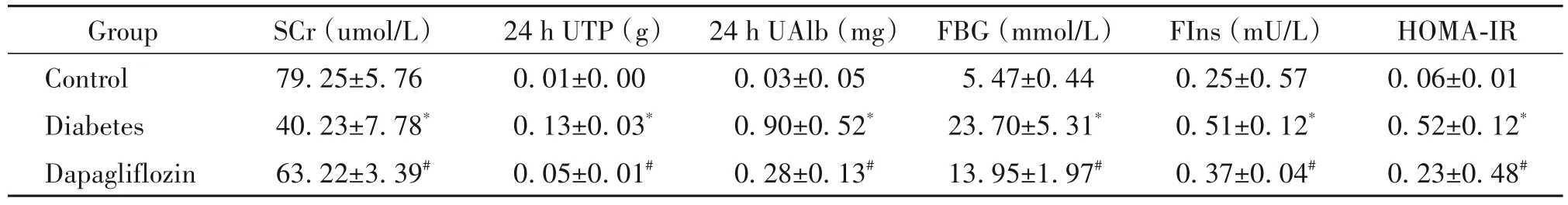
表3 各组生化指标比较Table 3. Comparison of biochemical indexes among groups(Mean±SD. n=6)
4 电镜下肾小球结构参数变化
如图1 所示,透射电镜下可观察到糖尿病大鼠肾小球基底膜增厚,足细胞足突融合、消失。这两项指标通过量化分析后观察到,相对于糖尿病组,在经过治疗的达格列净组中显著降低(P<0.05),其中达格列净组足细胞足突宽度与对照组无显著差异。

Figure 1. Transmission electron microscope of glomeruli and quantitative analysis of each group(scale bar=2µm). The thickening of the glomerular basement membrane(white arrows)and the fusion and disappearance of podocytes foot processes(black arrows)in diabetic rats can be observed. GBM:glomerular basement membrane;FPs:foot processes. Mean±SD. n=7.*P<0.05,**P<0.01 vs control group;#P<0.05 vs diabetes group.图1 各组肾小球电镜及量化分析图
5 Western blot 实验检测 SIRT1、beclin-1、LC3 和NPHS2蛋白表达情况
如图2所示,达格列净组大鼠中SIRT1表达量显著高于另外两组,而且在糖尿病组表达最低(P<0.05);自噬标志物LC3-II/LC3-I比值和beclin-1 蛋白表达呈现达格列净组、对照组、糖尿病组依次降低的趋势(P<0.05);足细胞标记蛋白NPHS2 在达格列净组的表达量低于对照组,高于糖尿病组(P<0.05)。
6 免疫荧光实验检测NPHS2及LC3蛋白表达情况

Figure 2. Comparison of SIRT1,beclin-1,NPHS2 and LC3 protein expression in each group. Mean±SD. n=6.*P<0.05 vs control group;#P<0.05 vs diabetes group.图2 各组SIRT1、beclin-1、NPHS2和LC3蛋白表达的比较
如图3 所示,使用抗NPHS2 抗体(红色)免疫染色以鉴定足细胞,使用抗LC3 抗体(绿色)免疫染色以鉴定自噬。量化后的达格列净组中由LC3 标记的绿色荧光总量高于糖尿病组(图3B),考虑到截取的每个肾小球区域大小不一,可能对统计的荧光总量造成误差,我们分别将每组截取的50 个肾小球中每个肾小球的荧光量与其区域面积的比值在图3C 中展现了出来,达格列净组肾小球单位区域上的LC3表达量显著高于糖尿病组(P<0.05);NPHS2 蛋白显示的红色荧光总量对照组中是最高的,达格列净组也是优于糖尿病组的,同样的方式换算后各组肾小球单位面积的NPHS2表达趋势仍然与前者相似。
讨 论
在本研究中,高脂饮食配合低剂量链脲佐菌素连续注射的大鼠模型与人类2 型糖尿病有很大的相似性,而且导致了DKD 的发生。在表1中可观察到,注射STZ 的大鼠前后两周在体重、血糖和饮水量与对照组大鼠产生了差异,表现出“三多一少”糖尿病症状。表2中糖尿病组肾重/体重比与对照组产生显著差异,表明糖尿病组大鼠肾脏出现了肥大;而且表3中对照组和糖尿病组的各项生化指标血肌酐、尿总蛋白、尿白蛋白及HOMA-IR 的差异表明模型大鼠出现胰岛素抵抗和肾脏病变。
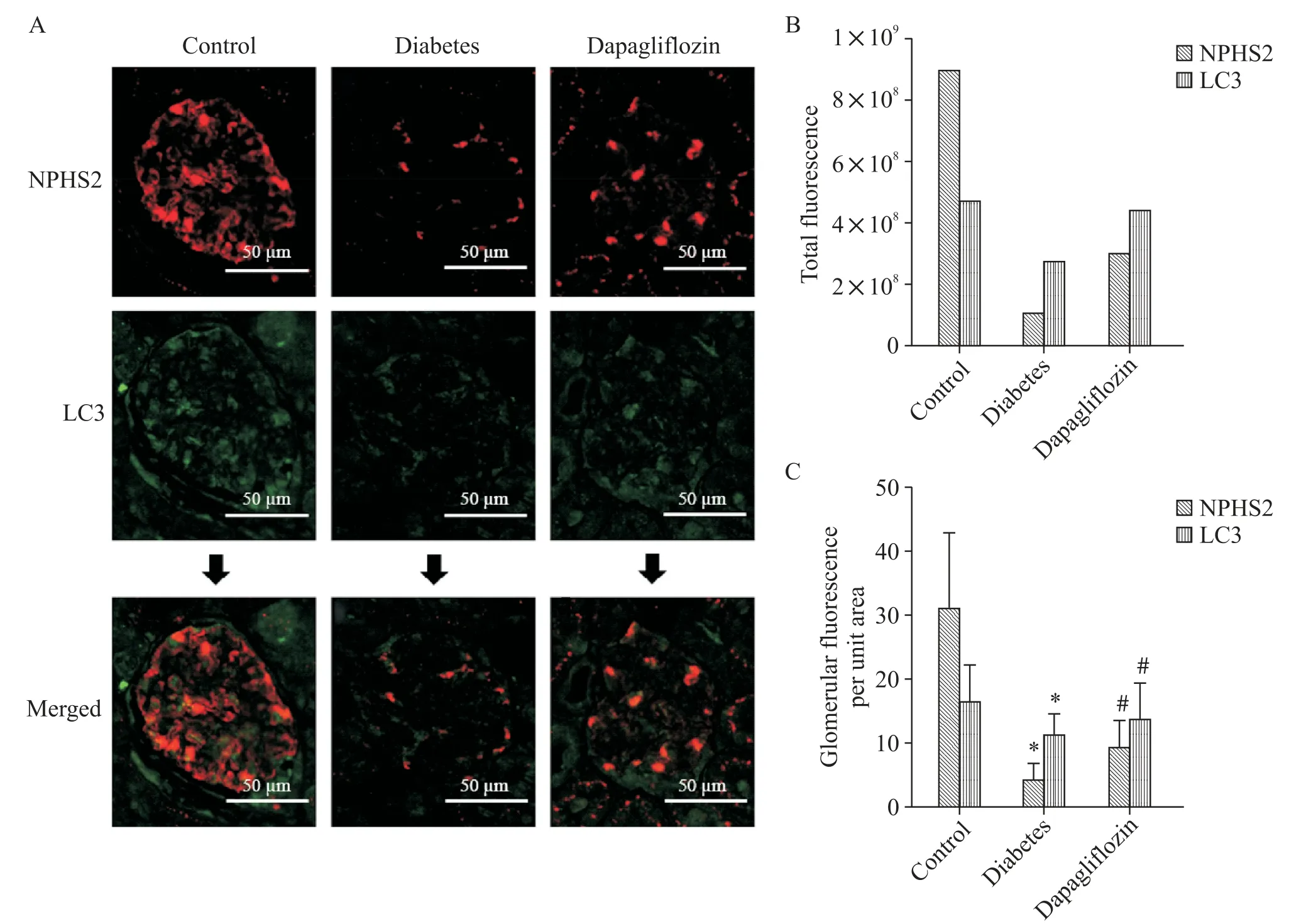
Figure 3. Immunofluorescence staining showed the changes of autophagy and podocyte marker fluorescence intensity in each group(scale bar=50 µm). A:the red fluorescence represents NPHS2,the green fluorescence represents LC3;B:the total amount of immunofluorescence in each group;C:mean fluorescence of glomerular region in each group. Mean±SD. n=50.*P<0.05 vs control group;#P<0.05 vs diabetes group.图3 免疫荧光染色显示各组大鼠自噬与足细胞标志物荧光强度变化
钠-葡萄糖协同转运蛋白2(sodium-glucose cotransporter 2,SGLT2)表达于近曲小管上皮细胞的管腔表面[2],它主动重吸收小管液中的钠与葡萄糖,SGLT2 抑制剂最初适用于降低血糖,随后其明显的肾脏保护作用成为研究的焦点。在本次实验中,使用达格列净对糖尿病大鼠进行为期4 周的治疗,治疗结束后,我们观察到电镜下的肾小球基底膜厚度与足细胞足突宽度经过量化之后在达格列净组与糖尿病组之间表现出显著差异,在超微结构下便显示出达格列净对肾脏足细胞的保护作用。而且通过检测各组大鼠的血液及尿液生化指标,观察到经过达格列净治疗的糖尿病大鼠,尿总蛋白、尿白蛋白及胰岛素抵抗相较于糖尿病组均有不同程度的减轻,血肌酐的差异表明达格列净对DKD 早期肾小球的超滤状态也有一定的缓解。在表2 肾脏的一般情况中,达格列净组的肾重/体重比优于糖尿病组,说明经过治疗后的达格列净组大鼠肾脏肥大也有所减轻。这些结果与各组之间的超微结构变化趋势一致。
sirtuins 是一类依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的脱乙酰酶,广泛存在于胚胎和众多动物组织中,是细胞内转录活性的调节剂[11]。SIRT1 是sirtuins 家族中表达广泛、研究广泛的成员,它对LC3 的去乙酰化促进了核质转运和自噬体的形成,因此它与自噬的发生存在紧密联系[12]。SIRT1 作为一种能量感受器,其活性的变化受能量代谢状态的影响,在衰老及过量营养供应的情况下,NAD+/NADH 比率的降低会导致SIRT1 在肾脏表达下降;在禁食或营养剥夺时,大鼠体内显示出NAD+生物合成酶-烟酰胺磷酸核糖基转移酶的增加,线粒体NAD+随之增加[13],SIRT1的表达则被上调,进而促进自噬发生。
自噬是一种保守的分解代谢机制,它将细胞内的各种成分,如蛋白质聚集体和受损的细胞器运送到溶酶体进行降解、清除和循环,以维持体内平衡和细胞的完整性[4]。足细胞是一类特殊的肾小球上皮细胞,高度分化且无法增殖,它附着在肾小球基底膜的外侧,与内皮细胞和基底膜一起形成肾小球滤过屏障,是肾小球滤过屏障不可或缺的一部分[14]。足细胞在基础状态下就保持较高的自噬率来维持自身稳定,如果它受损,滤过屏障被破坏,临床上则会表现出蛋白尿的特征[15-16],故自噬对于维持足细胞的功能意义尤为重要。为了对足细胞进行检测,我们应用足细胞特异性标记蛋白NPHS2(一种在动物体内由Nephrosis2基因编码的蛋白质)进行其定量评估,为了确保对自噬准确和客观的评估,我们选择两种分子来客观评估足细胞自噬状态:自噬基因becn1编码蛋白beclin-1 与LC3。beclin-1 是最早被检测的哺乳动物自噬蛋白之一[17],是自噬特异性Ⅲ类磷脂酰肌醇3 激酶复合物的一部分,形成自噬小体的必需分子,可介导自噬相关蛋白定位于吞噬泡[18];LC3 前体被半胱氨酸蛋白酶裂解,转化为LC3-I,LC3-I 与新生自噬小体表面的磷脂酰乙醇胺偶联形式LC3-II,因此,LC3-II 与自噬小体和自溶酶体具有相对特异性[19-20],故可以通过检测 LC3-I 到 LC3-II 的转化以及beclin-1蛋白的表达情况来评估自噬水平。
我们通过Western blot 实验进行相关蛋白定量检测,免疫荧光实验定位观察及半定量佐证,在Western blot 实验结果中观察到,达格列净组LC3-II/LC3-I 比值及beclin-1 蛋白的表达高于对照组,对照组高于糖尿病组;NPHS2蛋白表达呈现对照组、达格列净组、糖尿病组依次降低的趋势。这说明经过治疗后的达格列净组大鼠肾脏自噬通量增强,足细胞稳态得以维持,损失减少,而糖尿病组则表现出自噬不足,足细胞稳态破坏,数量减少。而免疫荧光实验中我们随机对各组大鼠肾脏标本进行LC3 与NPHS2双标,得到了定位及半定量结果,通过量化分析,观察到各组的NPHS2、LC3 荧光总量和每个肾小球的单位平均荧光值的统计分析呈现对照组、达格列净组、糖尿病组依次升高趋势。这跟Western blot 实验结果趋势一致,而且我们在荧光图片上可直接观察到LC3 标记的绿色自噬荧光相对集中的表达于NPHS2 标记的代表足细胞的红色荧光周围,这说明肾脏自噬通量增强主要的受益者是足细胞。理论上足细胞表面并不存在SGLT2,那么达格列净对足细胞周围自噬的诱导作用是否是通过其对全身能量代谢的影响而实现?这正是我们思考的方向。
在Western blot 实验中SIRT1蛋白的表达在达格列净组中最高,对照组中次之,糖尿病组中最低。由此可以肯定的是达格列净组大鼠体内的SIRT1 被上调,从能量代谢角度分析,说明达格列净的使用导致大鼠尿液葡萄糖大量排泄,模拟了饥饿或能量剥夺状态,促使肾脏细胞中NAD+增加,上调SIRT1在肾脏中的表达,进而增强了肾脏自噬,维护了足细胞稳态,最终减轻其损伤;而糖尿病组大鼠体内葡萄糖蓄积,表现出营养过剩的特点,故SIRT1 被抑制,肾脏自噬减弱,足细胞丢失最多;对照组大鼠体内无异常能量状态波动,则足细胞保存完好,这符合我们的实验预期。
在已经发表过的相关研究中,目前只有1 篇文献探讨过关于SGLT2 抑制剂对肾脏足细胞的影响,Korbut 等[21]证明了恩格列净能通过促进db/db小鼠的肾小球自噬来减轻肾小球损伤。但遗憾的是并没有深入对其分子机制进行探讨。在本实验中,我们结合能量代谢与自噬的调节机制,从SIRT1-自噬途径探究了达格列净对DKD 大鼠足细胞的保护作用。从我们的实验结果可以总结出,达格列净通过上调SIRT1 的表达,增强了肾脏的自噬通量,减轻了DKD大鼠足细胞的丢失,减少了蛋白尿,发挥了肾脏保护作用。
综上所述,达格列净可通过增强糖尿病肾病大鼠肾脏细胞自噬从而抑制足细胞损伤,其中SIRT1信号通路可能成为其促进自噬的潜在途径。
