负载人脐带间充质干细胞新型盆底补片的构建及其在大鼠的应用*
2022-05-06金克勤骆健峰苏爱芳丁明星傅赛红方远书
金克勤, 骆健峰,2▲△, 苏爱芳, 丁明星, 傅赛红 , 方远书
(1金华市妇幼保健院遗传实验室,浙江 金华 321000;2浙江大学医学院附属金华医院分子实验室,浙江 金华 321000;3金华职业技术学院医学分子生物学实验室,浙江 金华 321007;4金华市食品药品检验检测研究院,金华实验动物中心,浙江 金华 321000)
盆腔器官脱垂(pelvic floor prolapse,POP)最重要的手术治疗方式——盆底重建手术已占到普通妇科大手术的40%~60%。由于盆底结构及力学的复杂性,有高达19%的术后复发率,存在再次手术的风险[1]。文献报道,在盆底重建中,利用脂肪源性干细胞(adipose-derived mesenchymal stem cells,ADSCs)构建组织工程补片,是一种潜在的治疗策略[2],在临床上有巨大的应用潜能[3]。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UC-MSCs)在增殖和细菌/病毒感染风险方面更具优势,且移植排斥反应机率低。然而,有关UC-MSCs 应用于盆底重建的研究较少,需更多的证据。应用丝心蛋白(silk fibroin,SF)、胶原(collagen,COL)、聚乳酸(polylactic acid,PLA)等网状支架的实验研究证实,辅加UCMSCs 的支架材料修复效果优于单纯的支架材料,其机制可能与促进血管新生、减少局部粒细胞和巨噬细胞的浸润及免疫调节等有关[4-5]。本研究采用复合UC-MSCs 与SF/COL/聚(左旋乳酸-己内酯)[poly(L-lactide-co-ε-caprolactone),PLCL]静电纺丝纳米纤维支架构建新型盆底补片,并进行体内实验研究,探索其修复的可行性,为其在女性盆底重建手术中的应用提供实验依据。
材料和方法
1 实验动物
SPF 级雄性SD 大鼠,4 周龄,购自上海斯莱克有限公司,许可证号为SCXK(沪)2017-0005,合格证号为20170005019883。实验动物房使用许可证号为SYXK(浙)2015-0008。实验过程中对动物处置符合国科发财字〔2006〕398号文件规定。
2 主要试剂
人UC-MSCs由浙江思丹姆干细胞生物科技有限公司提供;SF 委托天津医院提取;猪I 型COL 购自成都市科乐生物技术有限公司;PLCL 由济南岱罡生物工程有限公司提供;逆转录试剂盒HiScript-ⅡQ RT SuperMix for qPCR(Vazyme);PrimeScript ™ RT Reagent Kit(TaKaRa);实验引物由上海桑尼生物科技有限公司合成、纯化;大鼠I 型及III 型COL 酶联免疫检测试剂盒(南京建成生物工程研究所)。
3 实验方法
3.1 用携带绿色荧光蛋白(green fluorescent protein,GFP)的慢病毒转染人UC-MSCs 将成品UCMSCs 传代并扩增后,将细胞悬浮接种到24 孔板中,每孔均加入3.5×104个细胞,静置过夜。细胞覆盖率达到60%时,换液,加入针对不同的MOI值相对应的病毒量。病毒感染8 h 后换液,并继续培养48 h,最终病毒滴度为1×1011TU/L 的病毒颗粒。然后收集细胞用于后续实验。
3.2 静电纺丝三维纳米纤维支架的制备 SF/COL/PLCL 静电纺丝三维纳米纤维支架的制备过程如下[6-7]:将纯 SF 与 COL 按质量比为 70∶30 溶于六氟异丙醇(hexafluoroisopropanol,HFIP)中,得到8%的共混溶液,再将最佳配比的SF/COL 与PLCL{PLLA[poly(L-lactide)]∶PCL[poly(caprolactone)]=75∶25}分别按 100∶0、70∶30、50∶50、30∶70 和 0∶100 的质量比溶于HFIP 中,配制成8%的纺丝液,在电压为11 kV、接收距离12 cm、喷速1.5 mL/h 的条件下进行静电纺丝,电纺后的支架在真空干燥箱内充分干燥。
3.3 纳米纤维支架形貌表征观察与植入前后力学性能检测 (1)用扫描电子显微镜(scanning electron microscope,SEM;HITACHI SU8010)观察纳米纤维支架纤维形态,通过分析软件测量纤维直径,计算其直径的分布范围和纤维的平均直径,分析SF/COL 与PLCL 不同比例对其纳米纤维直径的影响。(2)采用多功能材料力学实验机(MTS-Exceed-Model E42 及INSTRON-2716-020)对纳米纤维支架的植入前后不同时间段的力学性能进行评价。以10 mm/min 的加载速率对样品进行拉伸,直至完全拉断。经数据采集系统输出数据并绘制应力一形变量曲线,记录样品最大失效力(N)并计算杨氏模量(MPa)。
3.4 UC-MSCs 在纳米纤维支架上生长及增殖情况的检测 将慢病毒稳转UC-MSCs接种在三维纳米纤维支架上,UC-MSCs 接种后 5、7 和9 d 进行 SEM(Nova NanoSEM™ 450;Thermo Fisher Scientific)形态学观察,CCK-8法检测细胞增殖情况。
3.5 埋植实验 将12只SD 大鼠随机分为2组,10%水合氯醛300 mg/kg 麻醉后,仰卧位固定,腹部备皮消毒,切开腹侧壁约1 cm。实验组:将负载UCMSCs 的SF/COL/PLCL 补片植入大鼠腹部皮下;对照组:单纯SF/COL/PLCL 补片植入大鼠腹部皮下。用普里灵线缝合固定一针,可吸收线缝合切口。于术后1 周、4 周、12 周活体成像观察动态追踪移植细胞的存活、分布,并分别处死大鼠后对补片进行取材。
3.6组织病理学评价 将样品立即固定在4%多聚甲醛中,通过乙醇梯度脱水,清除并包埋在石蜡块中。使用切片机(LEICA)准备组织切片(4~5 µm),然后根据标准苏木精-伊红及Masson 三色方案进行染色,观察炎症细胞浸润及纤维化情况,腹部壁组织CD31 免疫组化染色标记检测新生血管。在1、4 和12 周组中对切片进行处理,通过光学显微镜半定量评估局部炎性细胞浸润、纤维化和新生血管情况。单个载玻片以0~4 评分。炎症评分:0 分为未见炎症细胞;1 分为每高倍镜视野(×400)可见1~10 个炎症细胞;2 分为每高倍镜视野(×400)可见10~30 个炎症细胞;3 分为明显浸润炎症细胞;4 分为可见形成包裹。纤维化评分:0 分为未见胶原纤维;1 分为可见局限的胶原纤维;2 分为可见中厚胶原纤维;3 分为可见厚胶原纤维;4分为可见广泛胶原纤维[8]。
HE 染色:将切片置于二甲苯中脱蜡,然后于无水乙醇中浸泡,最后自来水浸洗。将切片浸入苏木素染液染色5 min,水洗1 min,1%盐酸乙醇分化数秒,自来水中返蓝,将切片浸入伊红染液中染色3~5 min,再经梯度乙醇与二甲苯脱水透明,中性树胶封固,做好相关标记。
Masson 染色:将切片置于二甲苯中脱蜡,然后于无水乙醇中浸泡,最后自来水浸洗。将切片浸入37 ℃Bouin 液2 h,水洗至无黄色。天青石蓝染色液3 min;稍水洗;Mayer 苏木素染色液滴染 3 min;稍水洗;酸性乙醇分化液分化数秒;流水冲洗10 min;丽春红品红染液染10 min,蒸馏水稍冲洗;磷钼酸水溶液处理约10 min,直接用苯胺蓝液复染5 min、1%冰醋酸处理2 min,显微镜下观察染液的染色效果;再经梯度乙醇与二甲苯脱水透明,中性树胶封固,做好相关标记。
腹部壁组织CD31 免疫组织化学染色:切片二甲苯脱蜡,然后于无水乙醇中浸泡,最后PBS 浸洗。然后切片于 37 ℃、3% H2O2孵育 15 min,PBS 冲洗 3 次,每次3 min;置0.01 mmol/L 枸橼酸缓冲液(pH 6.0)中水煮修复10 min,自然冷却至室温,PBS 冲洗3 次,每次3 min;滴加Ⅰ抗,4 ℃冰箱孵育过夜,转至室温平衡 30 min,PBS 冲洗 3 次,每次 5 min;滴加Ⅱ抗,37 ℃孵育 30 min,PBS 冲洗 3 次,每次 5 min;DAB 反应染色,显微镜下观察反应进度,自来水充分冲洗;苏木素复染,干燥,封片,拍照;光学显微镜下观察。
3.7 RT-qPCR 检测白细胞介素2(interleukin-2,IL-2)、IL-6、IL-8 和肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)的表达量 两组大鼠于术后1、4 和12周,麻醉后处死,取出补片及周围组织。采用TRIzol试剂分离细胞的总RNA,依照说明书进行逆转录反应。以β-actin 为内参照,采用RT-qPCR 进行IL-2、IL-6、IL-8、TNF-α 和 β-actin 产物扩增及结果分析。RT-qPCR 条件:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,共40个循环。引物序列见表1。

表1 RT-qPCR引物序列Table 1. Sequences of the primers used for RT-qPCR
3.8 I 型及 III 型 COL 含量检测 移植后 1、4 和 12周不同时点每组大鼠补片样本均按照I 型及III 型COL ELISA 试剂盒说明书中方法处理,样品处理完毕后置于酶标仪(MD-SpectraMax Plus 384)中,设定检测波长为450 nm,测定吸光度,计算大鼠补片样本中 I 型 及 III 型 COL 浓 度 ,计 算 I 型 COL/III 型 COL比值。
4 统计学处理
应用SPSS 23.0 软件进行统计分析。使用Kolmogorov-Smirnov 法对每组数据进行正态分布检验,计量资料采用均数±标准差(mean±SD)表示。正态分布资料组间比较采用t检验及重复测量方差分析,非正态分布资料及等级资料采用非参数检验。定性资料采用率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
结 果
1 SF/COL/PLCL 纤维支架SEM表征和力学表征
SEM 图片显示,SF/COL/PLCL 纤维支架纤维的直径为(782.8±121.3)nm,成功制备了 SF/COL/PLCL 纤维支架,见图1。SF/COL/PLCL 纤维支架的拉力测试测得其拉伸断裂应力为(3.92±0.48)MPa,此时断裂伸长率为(56.53±15.72)%,拉伸弹性模量为(93.68±8.18)MPa,见图2。
2 接种纳米纤维支架不同时间后细胞的生长及增殖情况

Figure 1. SEM micrographs of SF/COL/PLCL at different magnifications.图1 SEM不同放大倍数观察最佳质量分数的SF/COL/PLCL 三维纳米纤维支架的表面形态
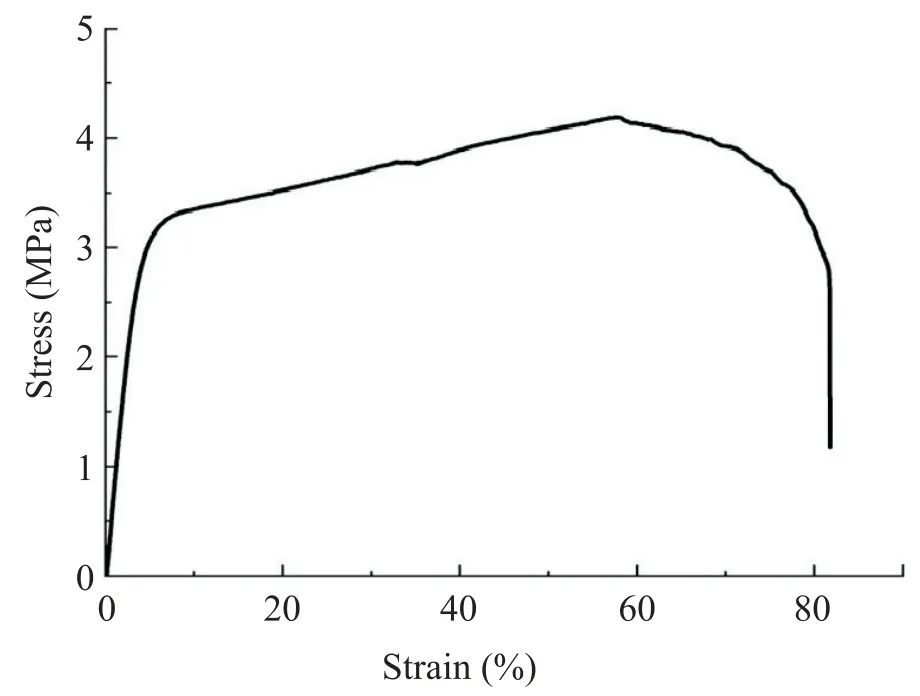
Figure 2. Stress-strain curves of SF/COL/PLCL fiber scaffolds.图2 SF/COL/PLCL 纤维支架的应力应变曲线
慢病毒转染的UC-MSCs 植入纳米纤维支架后,第5 天细胞形态正常,细胞结构正常,SEM 观察到UC-MSCs 在纳米纤维支架的外表面和网格内部有粘附生长,少量细胞聚集成片,呈不规则长形,细胞贴壁聚集且有细小空隙;第7 天细胞形态正常,细胞结构正常,延伸强,增殖能力明显增强,较第5 天细胞团增多,细胞贴壁聚集成片的有开裂空隙;到第9天,细胞增殖能力下降,细胞出现肿胀和结构断开,SEM 下可见更多的不规则网状细胞团,呈现细胞贴壁聚集成片的有开裂,边缘呈蛛网状,见图3。植入后以同时点的对照组存活率为100%相比,第5、7 和9 天的存活率分别为(137.98±4.53)%、(141.36±1.70)%和(85.92±2.12)%,差异有统计学意义(P<0.01)。细胞活力在接种5 d 后增加,第9 天开始下降。
3组织病理学评估
HE染色显示单纯SF/COL/PLCL 补片组在第1周和第4 周显示出清晰的支架结构。随着时间的推移及炎症细胞浸润进展,局部组织肿胀坏死、凋亡、吞噬,支架慢慢降解,补片结构中间逐步形成空洞,到第12 周,支架中心区域不再可见,周围组织覆盖周边区域。在负载UC-MSCs 补片组中,纳米纤维膜在第1 周时仍然完好无损,但UC-MSCs 黏附于支架并已形成细胞层,且炎症细胞已显著浸润,见图4。
支架结构在第4 周完全分解,到第12 周,炎症细胞浸润已经消退,炎症细胞浸润评分较单纯SF/COL/PLCL 补片组无显著差异。Masson 和免疫组化染色显示,负载UC-MSCs 补片组与大鼠组织的整合表现较强;基于CD31标记的血管存在,支架已完全降解,被软组织取代,有广泛血管生成的证据。单纯SF/COL/PLCL 补片组与大鼠组织的整合较差,植入12周仍可见支架。与单纯SF/COL/PLCL 补片组相比,负载UC-MSCs 补片组显示出明显更多的CD31 标记的血管及更高程度的纤维化(P<0.01)。见图5及表2。
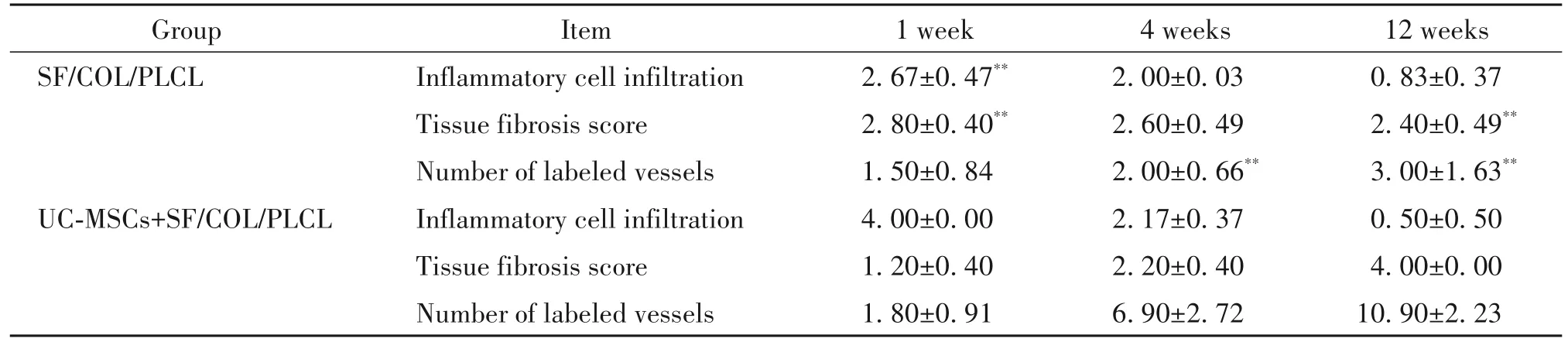
表2 不同时点SF/COL/PLCL组和UC-MSCs+SF/COL/PLCL组的组织病理学评估Table 2. The semi-quantitative pathohistological assessment of the SF/COL/PLCL and UC-MSCs+SF/COL/PLCL groups at different time points after implantation(Mean±SD. n=5 to 6)
4 RT-qPCR 检测IL-2、IL-6、IL-8和TNF-α 的相对表达量
植入支架周围组织中 IL-2、IL-6、IL-8 和 TNF-α的相对水平随着时间的推移呈普遍下降趋势。与单纯SF/COL/PLCL 补片组相比,负载UC-MSCs 补片组在植入后1 和4 周时周围组织中的IL-6 水平略有升高,12 周时显著降低,差异有统计学意义(P<0.05);但两组各时点IL-2、IL-8和TNF-α的表达水平差异无统计学意义(P>0.05),见表3。
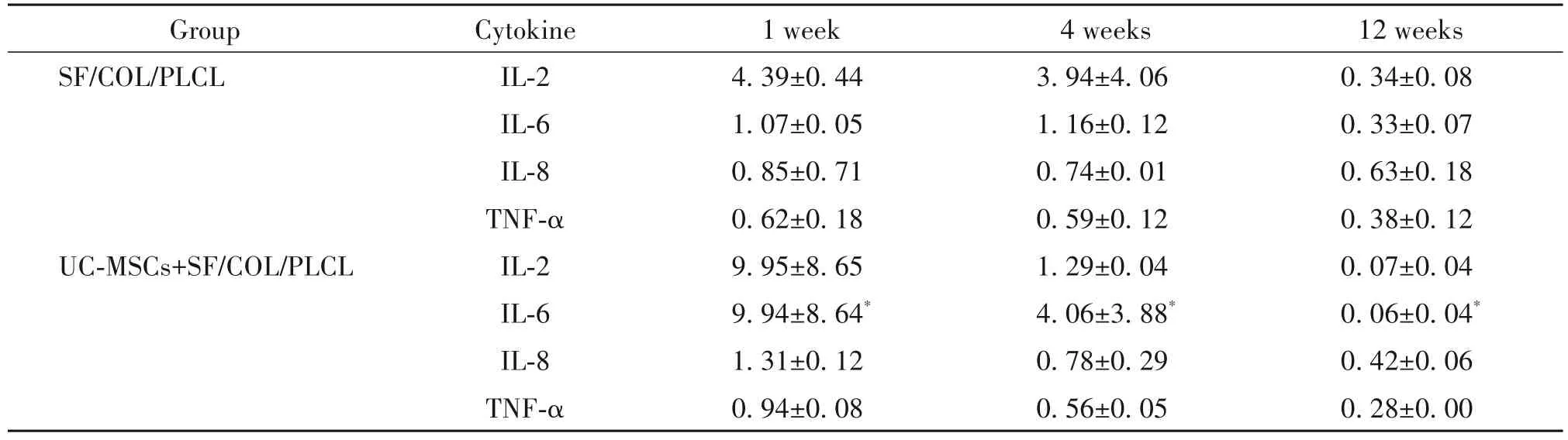
表3 植入后不同时点炎性细胞因子的相对表达水平Table 3. The relative expression levels of inflammatory cytokines at different time points after implantation(Mean±SD. n=4)
5 补片植入后的体内转归和力学性能
随时间增长,两组I 型COL/III 型COL 比值均增加。与单纯SF/COL/PLCL 补片组相比,负载UCMSCs组 I 型 COL/III 型 COL 比值增加更明显,差异有统计学意义(P<0.01),见图6。
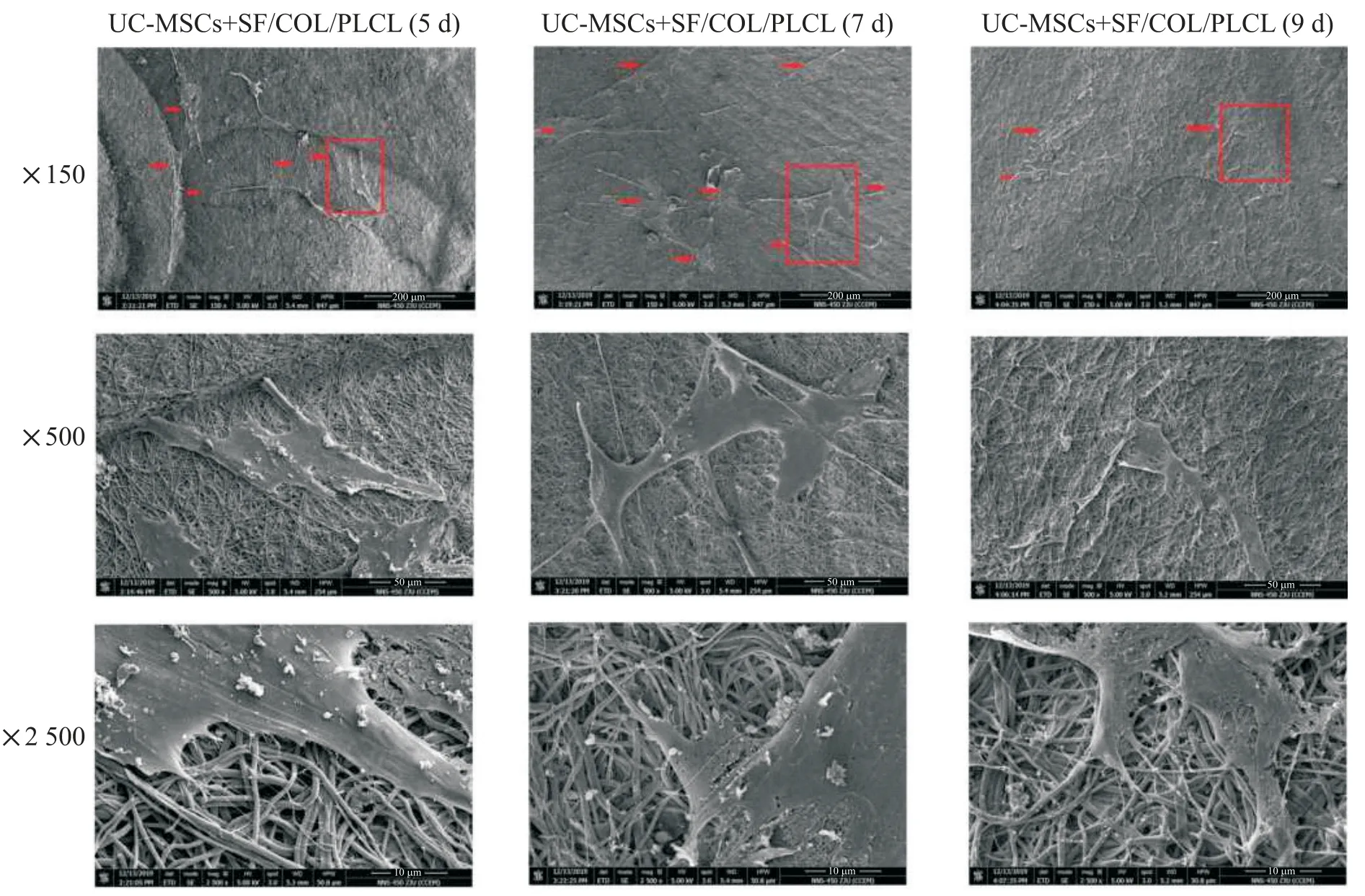
Figure 3. Scanning electron microscopic images showing the morphological changes of umbilical cord mesenchymal stem cells(UCMSCs)at different time points after implantated onto the nano-fibrous scaffolds. The red arrow indicates the loaded cells,and the cells delineated by the red border are further observed at×500 and ×2 500 magnification.图3 扫描电镜上不同放大倍数观察UC-MSC细胞接种到纳米纤维支架上不同时间点的细胞形态情况
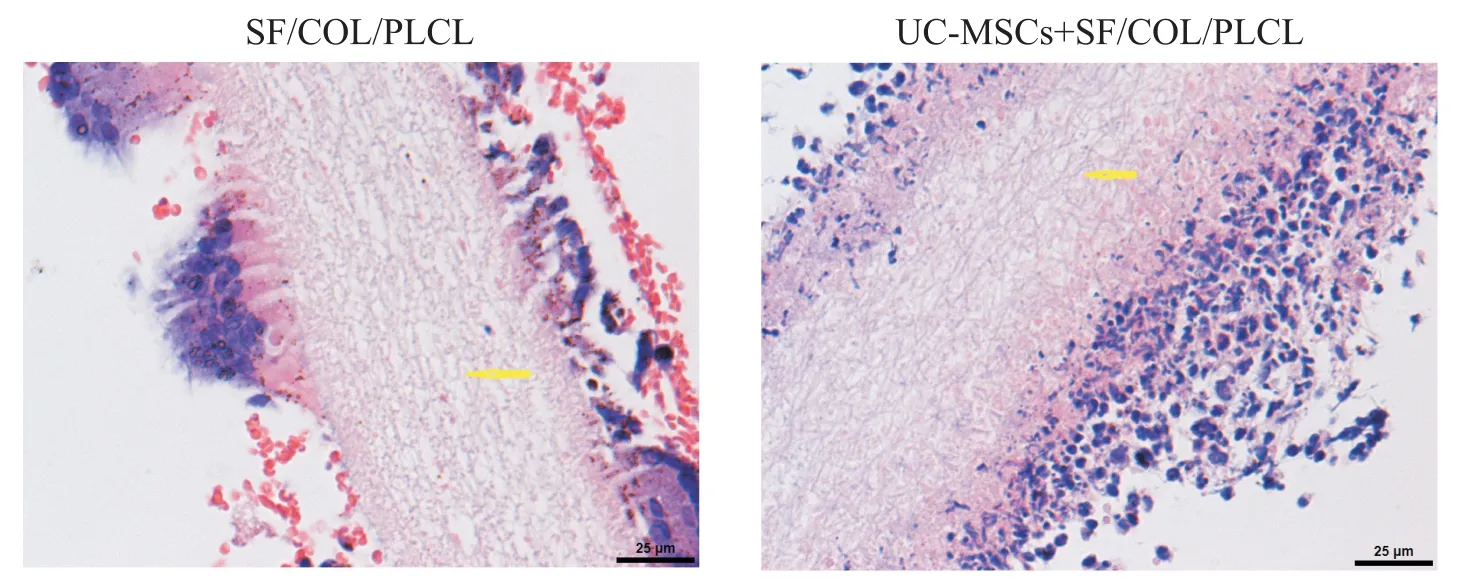
Figure 4. Morphological observation of the scaffolds in each group at 1 week(HE staining,scale bar=25µm).图4 1周时HE染色后两组支架的形态学观察
因第4 及12 周补片已降解,取第1 周的补片进行生物力学检测,记录样品最大失效力(N)并计算杨氏模量(MPa)。植入后1周,负载UC-MSCs补片组与单纯SF/COL/PLCL 补片组的最大载荷差异无统计学意义(P>0.05),但负载UC-MSCs 补片组的弹性模量高于单纯SF/COL/PLCL 补片组,差异有统计学意义(P<0.05),见图7。
讨 论
本研究显示SF/COL/PLCL 静电纺丝纳米纤维支架初始的拉伸断裂应力达到了(3.92±0.48)MPa,断裂伸长率为(56.53±15.72)%,拉伸弹性模量为(93.68±8.18)MPa,该支架起支持细胞黏附、实现力学支撑的作用。此外,以UC-MSCs 作为种子细胞构建组织工程补片,UC-MSCs 的形态在体外培养过程中保持稳定,在体外将UC-MSCs 细胞在接种纳米纤维支架后生长良好,接种支架7 d 时,细胞活力最强且细胞增殖能力最强,细胞形态,伸展较好且细胞结构致密,展现了良好的细胞相容性。
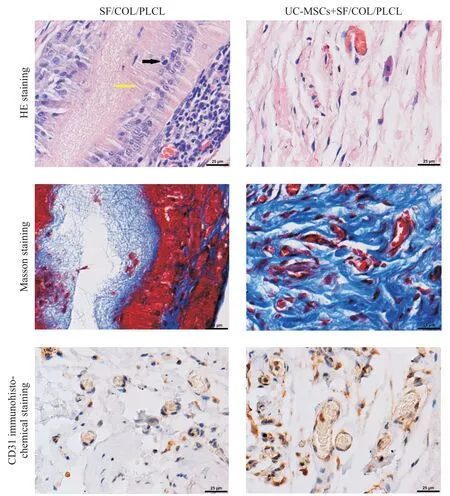
Figure 5. Pathohistological analysis of the naked and UC-MSCs+SF/COL/PLCL nano-membrane. The black arrow shows inflammatory cell infiltration,and the yellow arrow marks the position of the scaffold. Masson staining shows collagen fibers. CD31 immunohistochemical staining shows neovascularization.图5 12周时各组组织病理学染色分析
生物材料植入机体后往往会立即启动炎症反应,过强的炎症反应不仅导致局部组织肿胀坏死,同时还引起较强的纤维化,导致网片变形收缩,局部组织硬度增加,网片出现侵蚀等。本研究中负载UCMSCs 补片组1 周时组织学评分明显高于单纯SF/COL/PLCL 补片组,且镜下炎症细胞明显较多,但随着在体时间延长结构降解较快,12 周时负载UCMSCs 补片组受试位置补片已经降解,而大鼠活体成像显示负载UC-MSCs补片组随着在体时间延长体内分布更广,可能与组织相融合有关。因为此时组织可见大量胶原纤维及新生血管生成,组织纤维化评分及血管数负载UC-MSCs 补片组均明显高于单纯SF/COL/PLCL 补片组。随时间增长,两组Ⅰ型/Ⅲ型胶原蛋白比值均增长,负载UC-MSCs 补片组相对较快,而新生血管及胶原纤维大量增加有利于POP 患者盆底组织修复,并对器官起支撑作用。同时,较单纯SF/COL/PLCL 补片组,早期阶段(1 周、4 周)负载UC-MSCs 补片组的炎症因子水平 IL-6、IL-8 和 TNF-α相对增高,此与组织学观察到的炎性细胞的早期浸润要比单纯SF/COL/PLCL 补片组中更强表现一致,这可能与宿主对基质胶的降解和吸收的反应有关[9]。随着时间延长,可能由于UC-MSCs 发挥了免疫抑制能力,并且可以抑制刺激的淋巴细胞的增殖有关[10],负载UC-MSCs 补片组下降速率相对较快。而及时终止炎症与血运重建早期发作是相互依存的[11],早期高水平的炎症因子能够促进新生血管生成,如IL-6 是一种多功能细胞因子,Gopinathan等[12-15]研究显示,IL-6 可以直接刺激血管生成、诱导离体血管发芽、影响细胞增殖等,其与血管内皮生长因子相似的功效,但持续的炎症过程血管生成发育明显滞后,如IL-6 的高水平会造成总生存期下降[16],而MSCs因具有一定的免疫调节功能,影响局部炎症微环境,使得负载UC-MSCs补片组新生血管生成后,炎症因子及时终止,避免了过强的炎症反应和过强的纤维化带来的损害。UC-MSCs 还能分泌多种神经元相关的生长因子,例如营养介质,有助于组织修复[17-18]。
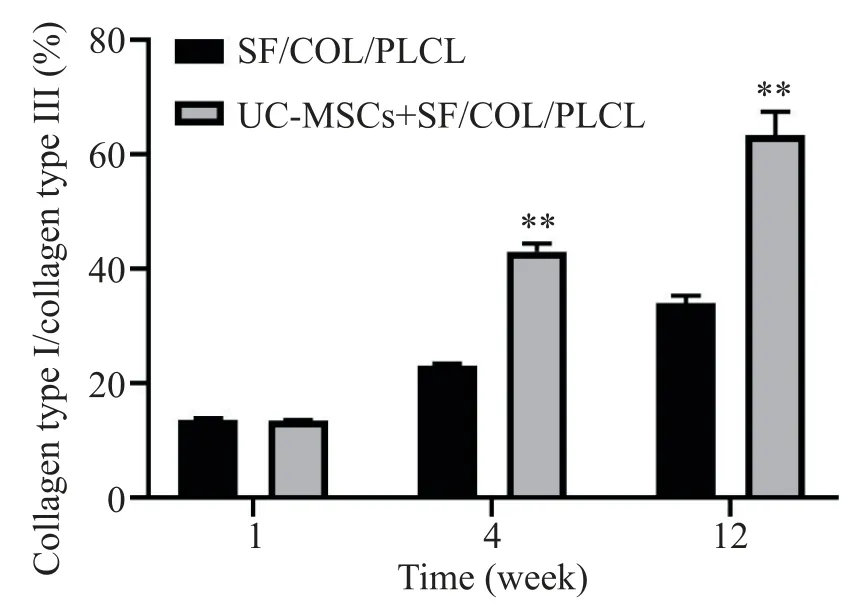
Figure 6. The ratio of collagen type I to collagen type III at different time points in each group. Mean±SD. n=6.**P<0.01 vs SF/COL/PLCL group图6 各组别不同时点Ⅰ型/Ⅲ型胶原蛋白比值
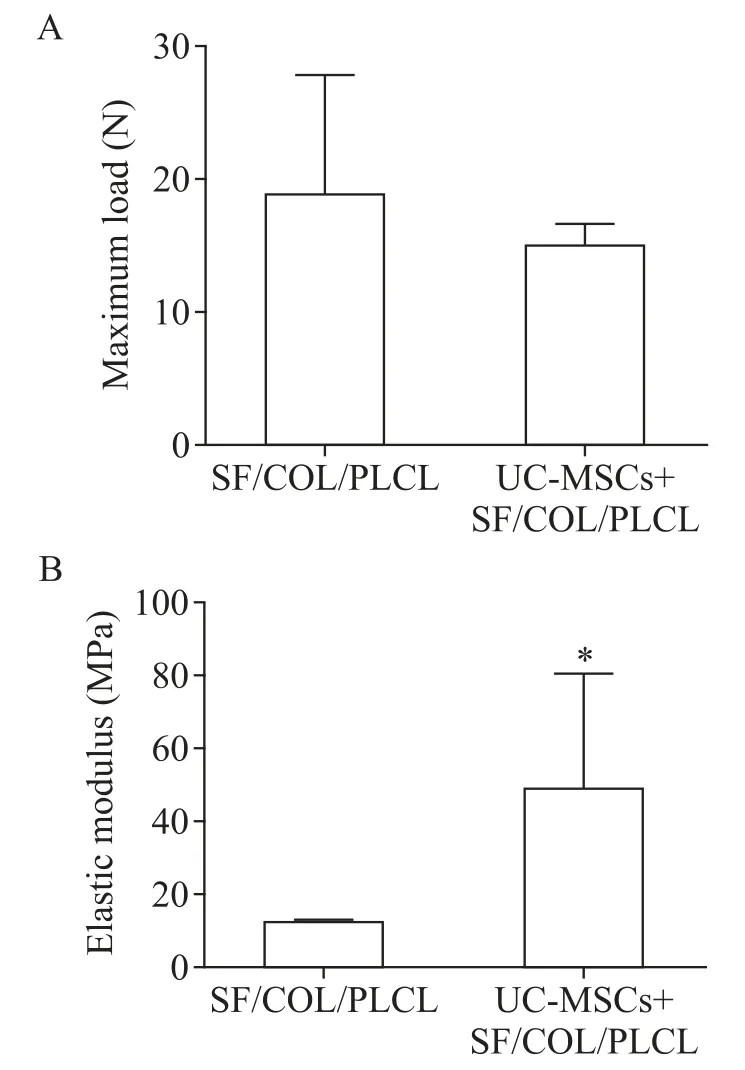
Figure 7. The maximum load(A)and elastic modulus(B)of synthetic implants for pelvic reconstructive surgery.Mean±SD. n=4.*P<0.05 vs SF/COL/PLCL group.图7 两组补片在体最大载荷和弹性模量
进一步研究表明,植入大鼠后1 周,负载UCMSCs 补片组与单纯补片组的最大载荷无明显差异,但负载UC-MSCs 补片组的弹性模量较高。可见UCMSCs 可改善组织工程支架的生物力学性能,使其具有更强顺应性和韧性,避免网片变形收缩。
本研究结果发现,负载UC-MSCs 的SF/COL/PLCL 静电纺丝纳米纤维支架展现了良好的细胞相容性,更强顺应性和韧性,及良好的抗炎性和组织修复能力,可满足盆底重建要求,具有良好应用前景。
