非热等离子体诱导肿瘤细胞的损伤和死亡模式
2022-05-06彭胜杰陈国栋
彭胜杰 ,陈国栋 ,韩 伟*
(1.中国科学院合肥物质科学研究院 健康与医学技术研究所,安徽 合肥 230031;2.中国科学技术大学研究生院 科学岛分院,安徽 合肥 230026;3.中国科学院合肥肿瘤医院 放疗中心,安徽 合肥 230031)
等离子体作为固、液、气之外的第4种物质存在状态,由气体电离后产生的大量活性基团、高能电子和离子、亚稳态粒子、光子、少量紫外线等组成[1-2].等离子体广泛存在于生活中,如太阳、闪电、氩弧焊、极光等.根据电离粒子的温度差异,等离子体可分为高温等离子体(high temperature plasma)与低温等离子体(low temperature plasma)两类,后者又可分为热等离子体(thermal plasma)和非热等离子体(non-thermal plasma,简称NTP).热等离子体的气体温度高于1 000 ℃,而非热等离子体的气体温度最低可接近室温[3-4],无明显电击感,可与人体安全接触.非热等离子体在生物医学领域的应用即得益于此.
非热等离子体富含正负离子、活性氧自由基(reactive oxygen species , 简称ROS)、活性氮自由基(reactive nitrogen species , 简称RNS)和紫外线等多种成分,可产生多种生物学效应[5].目前,非热等离子体已在医疗器械灭菌消毒、促凝血和伤口愈合、口腔疾病治疗、皮肤疾病治疗和医学美容等方面有不同程度的应用[6].
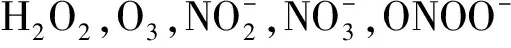
肿瘤现有的治疗手段如放、化疗等可诱导肿瘤细胞发生坏死和凋亡,其他类型的死亡方式如自噬、焦亡和铁死亡等也陆续被报道,与治疗效果和预后等密切相关.NTP活性组分的多样性和肿瘤组织的非均一性,可能导致NTP诱导细胞死亡方式的多样化和复杂化.开展NTP诱导的肿瘤细胞死亡方式的研究,有助于探明NTP治疗肿瘤的关键靶点和作用机制,对提升肿瘤治疗效果有一定的理论价值和实践指导意义.
1 NTP导致的DNA和细胞器损伤
1.1 DNA损伤
DNA损伤及修复是肿瘤治疗研究的重要内容.NTP可损伤DNA和细胞器,激活不同细胞死亡信号通路.2010年,Kim等[14]证明NTP处理会引起DNA损伤.Choi等[15]进一步明确NTP会导致DNA单链断裂,Ma等[16]证实NTP也会引起DNA双链断裂,并且可“选择性”诱导肿瘤细胞DNA损伤.鉴于NTP组成的复杂性,Kurita等[17]对导致DNA分子链断裂的NTP组分进行了单分子分析,发现紫外线对DNA损伤无明显影响,而·OH自由基是导致DNA链断裂损伤的主要活性成分.López,Yost等[18-19]推测NTP产生的多种活性成分攻击DNA双链,破坏糖苷键,从而导致碱基缺失,进而诱发DNA链断裂.目前,虽已证明NTP中的氧/氮活性基团是DNA损伤的主要诱因[15],但其中导致DNA损伤的具体过程和机制仍不清楚,NTP导致DNA损伤类型与NTP发生参数间的相关性、损伤修复动力学及相关机制等研究也均未系统开展.对NTP致DNA损伤的全面系统的探索,可为NTP杀伤肿瘤细胞的研究工作提供一个“窗口”,以观察处理引发的早期生物学“响应”,从而有助于完善NTP肿瘤治疗的机理,发现增效治疗的新靶点.
1.2 线粒体损伤
除DNA/细胞核外,NTP还会损伤核外细胞器,其中对线粒体的损伤最先被报道[14].作为细胞内氧化代谢和能量供应的主要场所,线粒体是过量ROS的作用靶点,也是ROS大量产生的位点.NTP处理导致细胞内ROS水平上升,线粒体膜电位改变,最终通过释放细胞色素c及激活MAPK通路,诱导肿瘤细胞凋亡[20].Panngom等[21]发现,NTP处理显著降低了肿瘤细胞中线粒体酶活性、呼吸速率和ATP产量,低剂量处理引起线粒体膜电位下降,高剂量处理则造成线粒体膨胀及破碎、融合等.Kumara等[22]也证实NTP处理会导致线粒体钙积累和未折叠蛋白反应增加.虽有不少研究涉及NTP导致线粒体损伤,但是损伤的具体类型/表现、对能量代谢影响的机制仍不清楚.
1.3 其他细胞器损伤
目前,NTP对其他细胞器损伤的研究较少,缺乏系统性.Kumara等[22]证实NTP通过氧化胁迫启动了内质网应激信号途径,导致内质网中未折叠类蛋白反应增强、CHOP 蛋白表达上调等,从而诱导细胞凋亡的发生.Paal等[23]证实NTP处理还可导致肿瘤细胞骨架结构和细胞形态改变,细胞膜磷脂氧化、堆积及脂筏结构形成.Kim等[24]证实NTP会导致溶酶体功能障碍,介导髓系白血病细胞死亡.
因此,NTP作用于肿瘤细胞时,不仅会导致DNA这种关键生物学大分子发生损伤,其引发的细胞内氧化性胁迫还会导致线粒体损伤,破坏内质网、细胞骨架、溶酶体等其他细胞器,从而造成细胞的结构和功能失调,进而诱导肿瘤细胞进入死亡阶段.
2 NTP诱导肿瘤细胞死亡的类型
2.1 细胞凋亡
细胞凋亡(apoptosis)由Kerr等[25]于1972年首次发现.凋亡是由基因决定为了维持细胞内环境稳定而发生的程序性细胞死亡,是细胞生理性、主动性的“自觉自杀行为”[26].凋亡的主要形态学特征包括细胞体积缩小,凋亡小体形成,核膜破碎,DNA降解为180~200 bp小片段等[27].凋亡的生理学意义在于其属于受基因调控的自发性细胞死亡,一般不会引发周围细胞及组织的炎性反应.
在2004年,Kieft等[28]首次证实NTP可诱导肺癌细胞发生凋亡.随后,Fridman等[7]也证明NTP可诱导黑色素瘤细胞发生凋亡.目前,NTP致肿瘤细胞死亡的研究多数集中于凋亡[29-34].NTP所导致的细胞内氧化胁迫(oxidative stress),被认为在肿瘤细胞凋亡发生中起关键作用[35].Chang等[36]证实,NTP诱导细胞内ROS水平上升,导致DNA损伤,触发ATM/p53通路诱导癌细胞凋亡.Ishaq等[29,35]发现NTP通过胞内ROS激活了TNF受体通路,上调凋亡信号调节蛋白表达,从而引发细胞凋亡.此外,NTP也通过细胞器损伤相关信号通路,诱导肿瘤细胞凋亡.Zhao等[37]研究发现NTP导致细胞内ROS和 RNS大量积累,进一步导致细胞线粒体功能障碍和内质网应激反应,介导细胞凋亡.Kumara等[22]证实NTP可激活内质网应激相关通路,导致线粒体钙积累和未折叠蛋白反应增加,进而诱导结肠癌细胞发生凋亡.同时NTP还通过干预线粒体相关蛋白表达,改变线粒体膜通透性,下调BCL2抗凋亡通路,最终导致肿瘤细胞发生凋亡[34-35].
NTP对肿瘤细胞凋亡诱导作用已有大量的研究,NTP不仅可通过诱导凋亡等方式直接杀死肿瘤细胞,还可配合放化疗手段,协同发挥更显著的抗肿瘤效果[9].
2.2 细胞自噬
自噬(autophage)是希腊语“自我”(auto)和“吞噬”(phagy)的术语组合,指细胞在相关基因调控下,通过形成自噬泡将受损细胞器和大分子转运到溶酶体内降解的过程[38-39],是进化上高度保守的细胞自身消耗过程[40].自噬与凋亡、坏死不同,但对细胞生存同样具有重要的调控作用.在外界压力、营养缺乏、内质网应激等极端应激情况下,细胞通过自噬提供生存所需最低能量[41].而且自噬介导异常胞质成分清除(例如异常蛋白质或受损细胞器)可保护细胞免受进一步损伤[42].然而,当自噬无法通过消耗自身促进细胞存活时,会启动细胞死亡相关信号通路,即自噬依赖性细胞死亡(autophagy-dependent cell death)[43],以胞内大量自噬泡聚集为显著特征[44].
目前,关于NTP诱导细胞自噬的研究较少.2017年,Shi等[45]首次证实NTP产生的ROS可诱导间皮瘤细胞发生应激反应,胞内溶酶体含量上升,促进细胞内吞作用,进而导致自噬发生,但该研究并未明确提出NTP可通过诱导自噬达到抗肿瘤的效果.2020年,Zhen等[46]发现NTP通过抑制AKT通路,促进ROS依赖性自噬,诱导胰腺癌细胞死亡;Yoshikawa等[47]证实NTP可抑制肿瘤细胞内mTOR和AKT信号通路,促进自噬小体产生,介导子宫内膜癌细胞的自噬依赖性死亡.但Ma等[48]也报道NTP可诱导胃癌和乳腺癌细胞发生保护性自噬,通过激活JNK信号通路,促进肿瘤细胞生存.
NTP诱导的肿瘤细胞自噬在死亡和促生存方面具有“两面性”,这可能与肿瘤类型、细胞内自噬关键调控基因的表达水平等诸多因素有关,其具体机制仍有待研究.通过NTP诱导肿瘤细胞发生自噬依赖性细胞死亡,并抑制细胞内保护性自噬发生,以达到抗肿瘤目的,可能需要依赖于对肿瘤遗传背景以及NTP相关生物效应的深入探索.
2.3 细胞焦亡
细胞焦亡(pyroptosis)又称细胞炎性坏死,表现为细胞不断膨胀直至细胞膜破裂,导致细胞内容物释放并引发强烈的炎症反应.1986年,Friedlander等[49]发现炭疽致死毒素可诱导小鼠巨噬细胞死亡,但一直把这种死亡方式归为凋亡.2001年,Cookson和Brennan[50]首次提出细胞焦亡的概念,并将其与凋亡区分开来.细胞焦亡以炎症小体形成、Caspase和Gasdermin家族蛋白激活、大量促炎因子释放为特征,其发生快于凋亡.邵峰团队[51]对细胞焦亡的关键分子机制进行了深入研究,证实Caspases特异性切割GSDMD[52]或GSDME[53]蛋白,产生的N端结构域在细胞膜上寡聚成孔进而破坏细胞膜的完整性,导致细胞焦亡发生.2020年,邵峰等[54]进一步证实,少量肿瘤细胞发生焦亡,即可调节肿瘤免疫微环境,从而激活T细胞介导的抗肿瘤免疫反应,揭示了细胞焦亡的抗肿瘤作用.
2020年,Yang等[55]首次报道NTP可有效诱导多类肿瘤细胞发生焦亡,GSDME高表达肿瘤细胞对NTP敏感性更高,证明GSDME表达水平在NTP诱导细胞焦亡中起决定作用.机理研究发现NTP处理引起细胞内ROS水平显著上升,激活线粒体下游蛋白Caspase 9和Caspase 3,特异性切割GSDME蛋白,导致GSDME-N端结构域在细胞膜上聚集成孔,从而诱导焦亡发生.
焦亡在肿瘤免疫微环境中的重要作用,使其逐渐成为研究热点.NTP处理可有效诱导肿瘤细胞发生焦亡,为其在癌症治疗领域的进一步研究提供了新思路,也拓宽了NTP的临床应用前景.
2.4 细胞铁死亡
铁死亡(ferroptosis)是一种依赖于细胞内脂质过氧化积累并需要亚铁离子催化的一种新型死亡方式[56].由于胞内脂质氧化代谢发生障碍,在铁离子催化下发生芬顿反应(fenton reaction),产生大量脂质过氧化物和自由基,破坏胞内氧化还原平衡,并攻击DNA、蛋白质、脂质等生物大分子,导致细胞死亡[56].细胞铁死亡形态变化主要表现在线粒体体积缩小,膜密度高,嵴显著减少甚至消失[57],最终由于脂质过氧化导致膜结构崩解和细胞死亡.在临床上,多种化疗药物如Sulfasalazine,Lanperisone,Cisplatin等都可通过诱导肿瘤细胞铁死亡起到治疗作用[58].
目前,并无直接证据表明NTP可诱导肿瘤细胞发生铁死亡,仅有少量研究间接提出NTP具有诱导铁死亡的潜力.2018年,Furuta等[59]证实NTP可促进储铁蛋白内Fe2+释放,从理论上推测NTP可能具有诱导铁死亡发生的能力.2019年,Sato等[60]发现利用铁螯合剂去除Fe2+会削弱NTP对口腔鳞癌细胞的杀伤作用,说明NTP诱导口腔鳞癌细胞死亡具有Fe2+依赖性.另外,Toyokuni等[61]也提出了NTP干扰胞内铁代谢平衡进而诱导铁死亡的猜想.
NTP诱导肿瘤细胞发生铁死亡,近年内有望发现其直接证据及相关机制,为NTP致肿瘤细胞死亡模式的研究增添新的理论[62-63].
2.5 免疫原性细胞死亡
一直以来,程序性细胞死亡被认为对机体是免疫耐受的.但近来研究表明,部分程序性死亡的肿瘤细胞具有免疫原性[64].程序性死亡肿瘤细胞释放或在细胞膜表面表达免疫原性相关蛋白,激活机体抗肿瘤免疫反应,诱导细胞毒性T细胞更有效杀伤肿瘤细胞,增强了抗肿瘤作用,这一现象被称为肿瘤细胞免疫原性死亡(immunogenic cell death,简称ICD)[65].肿瘤细胞免疫原性死亡是个较为宽泛的概念,导致免疫系统响应的死亡方式有很多,如前文提到的焦亡和铁死亡.
2015年,Lin等[66-67]首次证实NTP可显著杀伤鼻咽癌细胞,刺激细胞外ATP分泌并提高免疫原性,从而增强抗肿瘤效果.后续多项研究也证实NTP可通过引起ROS和RNS水平上升,诱导鼻咽癌[66]、肺癌[68]、黑色素瘤[69-71]等多种肿瘤细胞发生免疫原性死亡.在体内实验中,Lin等在小鼠结直肠癌模型[72]和黑色素瘤模型[73]中均证实,NTP可诱导肿瘤细胞表达和释放损伤相关分子模式,促进体内巨噬细胞募集和成熟,激活T细胞介导的抗肿瘤免疫应答,有效缩小肿瘤体积.2020年,Chen等[74]利用NTP处理小鼠黑色素瘤模型,系统探究了NTP激活机体免疫系统、抑制肿瘤生长的作用机制,并首次报道了NTP处理诱发的远端效应(abscopal effect).研究发现,NTP处理可诱导黑色素瘤细胞发生免疫原性死亡,激活机体免疫应答,有效缩小移植瘤的体积,甚至抑制远端未处理黑色素瘤的生长,有效提高了小鼠的全身抗肿瘤能力.

目前已知放疗与部分化疗药物均可诱导免疫系统响应,探索NTP诱导的免疫原性死亡机制,可为临床提升抗肿瘤免疫反应提供更多的选择[71].
2.6 细胞衰老
正常细胞经历有限的分裂次数后,细胞形态和生理代谢活性会发生显著改变,称为“Hayflick界限”[76].达到分裂界限的细胞会从活跃增殖状态转变为周期停滞状态,即细胞衰老,表现为细胞体积增大,染色质重构,特定基因表达改变,以及衰老相关分泌表型出现等[77].研究发现,在正常细胞和肿瘤细胞中,由某些原癌基因过表达或抑癌基因缺失所引发的致癌突变也会诱导细胞衰老[76].而肿瘤细胞衰老的发生,会阻止肿瘤的增殖和发展.因此,诱导细胞衰老也是一种有效的抗肿瘤机制.
目前,关于NTP诱导肿瘤细胞衰老的研究逐渐成为热点.2013年,Arndt等[78]率先发现低剂量NTP处理黑色素瘤细胞后,β-半乳糖苷酶阳性细胞比例显著升高,证实NTP可诱导肿瘤细胞发生衰老.随后,Schneider等[79]证实NTP处理会诱导内质网和线粒体Ca2+释放,提高细胞质中游离Ca2+含量,从而导致黑色素瘤细胞发生衰老.Hara等[80]进一步证实,低剂量NTP处理可显著提高肺癌细胞内游离Zn2+水平,进而激活ATM/P53途径,将细胞周期阻滞于G2/M期,诱导肺癌细胞发生衰老.然而,研究发现NTP对肿瘤细胞的衰老诱导作用无“选择性”,正常组织和细胞也会受影响.Bourdens等[81]证实低剂量NTP处理会导致皮肤成纤维细胞和脂肪间充质干细胞发生周期阻滞,并出现衰老相关分泌表型.
因此,低剂量NTP可有效诱导肿瘤细胞衰老,抑制肿瘤细胞增殖,但具体分子机制仍有待研究.同时,NTP也可诱导正常细胞发生衰老,这可能是NTP的潜在毒性之一,也是NTP在临床应用上需要避免和解决的关键问题.
2.7 NTP联合使用诱导肿瘤细胞死亡
除了NTP单独作用于肿瘤的研究外,亦有不少研究探索NTP与其他治疗方式联合使用的可行性.Lin等[82]证实NTP可增强多种肿瘤细胞的放射敏感性,Lafontaine等[83]证实NTP显著增强了放疗对部分乳腺癌细胞的杀伤效果,表明二者联用具有协同作用.另外,Lafontaine等[83]将NTP与Olaparib联用,显著提高对三阴乳腺癌细胞的生长抑制效果;Hwang等[84]证实NTP与TRAIL联用治疗可诱导多种TRAIL抗性肿瘤细胞发生凋亡,提高耐药肿瘤细胞的治疗效果且不影响正常细胞;Kaushik等[85]将NTP与2-DG联用,协同降低多种肿瘤细胞代谢活力,抑制糖酵解并促进肿瘤细胞凋亡;Cui等[86]也证实NTP与二甲双胍联合使用,可提高线粒体氧化损伤程度,促进结肠癌细胞发生凋亡;Bagati等[87]将NTP与Lapatinib联用,通过提高胞内氧化水平并诱导肿瘤细胞凋亡,显著提高了对黑色素瘤的治疗效果.
NTP与纳米材料的联用也有研究.Choi等[88]证实,纳米金颗粒与NTP联用可在短时间内将肿瘤治疗效果提高数倍,靶向诱导黑色素瘤细胞迅速发生凋亡,极大提高了治疗效果并缩短了治疗时间.Kim等[89]将NTP与纳米金颗粒联用,显著提高肿瘤细胞内DNA损伤水平,并诱导多种肺癌细胞发生凋亡;Kaushik等[90]在体内实验中也证实NTP与纳米金颗粒联用的协同抗肿瘤效果.
NTP与放、化疗及纳米技术等治疗技术的联合使用,为将来的临床应用提供了更多的“出口”和可行性.
3 结束语
现有研究表明,NTP诱导细胞死亡主要是通过提高细胞内ROS水平造成氧化胁迫,引起DNA单/双链断裂和细胞器损伤等,进而导致细胞死亡.临床化疗药物诱导肿瘤细胞死亡的分子机制各异,如紫杉醇(paclitaxel)可抑制有丝分裂,诱导肿瘤细胞发生凋亡;而柳氮磺吡啶(sulfasalazine)通过抑制细胞胱氨酸摄取,诱导肿瘤细胞发生铁死亡从而达到抗癌效果[91].在分子机制上,NTP诱导肿瘤细胞死亡的类型及可能机制虽与上述化疗药物有近似之处,但NTP有其自身特点和独特的优越性.NTP中富含多种活性成分,并且可以通过改变发生条件,有效调控关键活性成分,从而更有效地诱导肿瘤细胞死亡,且死亡类型更趋多样化,有望成为现有临床治疗方法以外新型肿瘤治疗技术.同时,NTP能够与放射、化疗药物和纳米药物等联合使用,达到协同抗肿瘤的效果,这也增加了NTP临床应用的价值和多样性.
但是,NTP肿瘤治疗仍有很多关键性问题亟须解决,如NTP对正常细胞的潜在毒性,NTP选择性杀死肿瘤细胞的深层次机制,NTP诱导肿瘤细胞死亡方式的机制等.这些问题既是NTP治疗面临的挑战,亦是其快速发展的可能突破点,解决这些问题可为NTP的应用提供有利的理论支撑与指导.
