草氨酸钠对人黑色素瘤细胞的非热等离子体增敏作用研究
2022-05-06彭胜杰陈国栋
许 袁 ,马 洁,彭胜杰,曹 威,陈国栋,韩 伟*
(1.中国科学院合肥物质科学研究院 健康与医学技术研究所,安徽 合肥 230031;2.中国科学技术大学 研究生院 科学岛分院,安徽 合肥 230026;3.皖南医学院 公共卫生学院,安徽 芜湖 241002;4.中国科学院合肥肿瘤医院 放疗中心,安徽 合肥 230031)
恶性黑色素瘤是由体表或黏膜黑色素细胞发生恶变、无限制增殖导致的肿瘤.其恶性程度高、易转移,早期无不适感,不易发觉,且晚期预后极差,5年生存率不足10%[1].近年来黑色素瘤在我国发病率迅速增长,年新增病例近2万,日益成为人民群众生命健康的重要威胁[2].目前临床上对于早期黑色素瘤可采用手术治疗,但是由于发病位置、恶变面积不同等,手术治疗可能会产生患者难以接受的痛苦.寻找更多安全稳定、可直接接触皮肤、二次伤害程度轻的治疗方式,对于黑色素瘤治疗是十分有价值的.
等离子体是由电子、带正电荷的离子、中性粒子组成,宏观上呈电中性的离子化气体状物质.根据温度的不同,可以把等离子体分成高温等离子体以及低温等离子体,低温等离子体又分为热等离子体和非热等离子体(non-thermal plasma, 简称NTP).NTP因具有温度接近室温,可与人体友好接触,安全性高等优点,在生物医学领域取得一系列应用成果[3].近年来,NTP陆续被证明在多种癌细胞中均具有抑癌作用[4],2007年美国科学家Fridman等[5]发现NTP能有效杀死皮肤癌细胞,且对周围正常皮肤组织没有显著损伤.2016年,NTP首个临床医疗研究发布,证实其有效减缓了头颈癌病人的疾病进程,并提高了患者生活质量,可能是一种新型的肿瘤治疗方法[6].多年研究发现,NTP处理会显著提高细胞内活性自由基ROS/RNS(reactive oxygen species/reactive nitrogen species)水平,进而引发DNA损伤、周期阻滞、线粒体损伤、能量代谢抑制等,同时也会削弱内源性抗氧化系统的功能,最终激活细胞死亡信号通路,诱导肿瘤细胞死亡.NTP处理可以诱导多种细胞死亡方式,例如凋亡、焦亡、坏死和自噬等.一些药物如阿霉素、替莫唑胺等,可显著增强肿瘤细胞的NTP敏感性[7].
小分子药物草氨酸钠系乳酸脱氢酶A(lactate dehydrogenase-A,简称LDH-A)的特异性抑制剂,而LDH-A在肿瘤的生长、侵袭、免疫逃逸、血管生成等方面具有重要的调控作用,抑制LDH-A可有效限制肿瘤细胞的能量供给,促使肿瘤细胞死亡[8].近年来草氨酸钠被证明在抑制肿瘤细胞生长、迁移和杀伤癌细胞方面有良好效果,如草氨酸钠可抑制鼻咽癌、非小细胞肺癌、胆管癌等肿瘤细胞生长、迁移,促进细胞凋亡、自噬,增强肿瘤细胞放射敏感性[9].
该研究将探究草氨酸钠与NTP联合使用能否对黑色素瘤细胞有更强的杀伤效果以及可能的机制.
1 材料和方法
1.1 细胞株与培养
人黑色素瘤细胞株A375、A875分别购自中科院上海细胞研究所和武汉普诺赛生命科技有限公司,MEL-RM黑色素瘤细胞由中国科学技术大学梅一德教授赠予.所有细胞均使用含10%胎牛血清和1‰抗生素的DMEM培养基培养,置于37 ℃、5% CO2培养箱培养.
1.2 主要仪器与试剂
实验仪器:恒温CO2培养箱(FORMA 3111)、酶标仪(ThermoVarioskan Flash)购自美国Thermo公司;双色红外激光成像分析仪(Odyssey CLx)购自美国LICOR公司;生物能量测定仪(XFe24)购自美国Seahorse公司;流式细胞仪(Accuri C6)购自美国BD公司;蛋白印迹电泳仪(EPS300)购自中国上海天能仪器;倒置荧光显微镜(DMI4000B)购自德国Leica公司.
实验试剂:草氨酸钠购自美国APExBIO公司;DMEM培养基购自武汉赛维尔生物科技有限公司;胎牛血清(FBS)购自美国Gibco公司;线粒体膜电位检测试剂盒(JC-1)、BCA蛋白浓度测定试剂盒、ROS清除剂N-Acetyl-L-cysteine(NAC)均购自碧云天生物科技公司;Annexin V-FITC/PI凋亡检测试剂盒购自美国BD公司;β-actin抗体购自华安生物技术有限公司;Caspase-3抗体、PARP抗体、AMPK抗体、p-AMPK抗体购自美国Cell Signaling Technology公司;IRDye© 800CW Goat anti-Rabbit荧光二抗、IRDye© 680 RD Goat anti-Mouse荧光二抗购自美国LI-COR公司;Dihydroethidium(DHE)荧光探针购自美国Thermo Fisher Scientific公司.
1.3 NTP处理
该研究采用DBD作为等离子体发生装置,由中国科学院等离子体物理研究所研制.如图1所示,装置主要由高频高压电源、气体源以及等离子体发生室3个部分组成.等离子体发生室由中空有机玻璃作为反应室腔,上方和侧面分别有进气孔和出气孔,内含4个反应器.每个反应器含直径32 mm的铜柱作为高压电极,表面覆盖1 mm厚的石英玻璃作为绝缘介质屏障,石英玻璃底部与样品表面的放电间隙为5 mm,接地电极为直径37 mm的铜柱.高频高压电源工作频率在10~42 kHz之间,输出电压在0~50 kV之间可变.设定电源工作电压为12 kV,频率为28 kHz.工作气体为氦气(纯度99.99%,气体流量计控制流速至120 L·h-1),氦气经高压气瓶和塑胶软管由发生室上盖进气口进入,通过发生室底座侧面出气口排出,处理前需通气2~3 min.
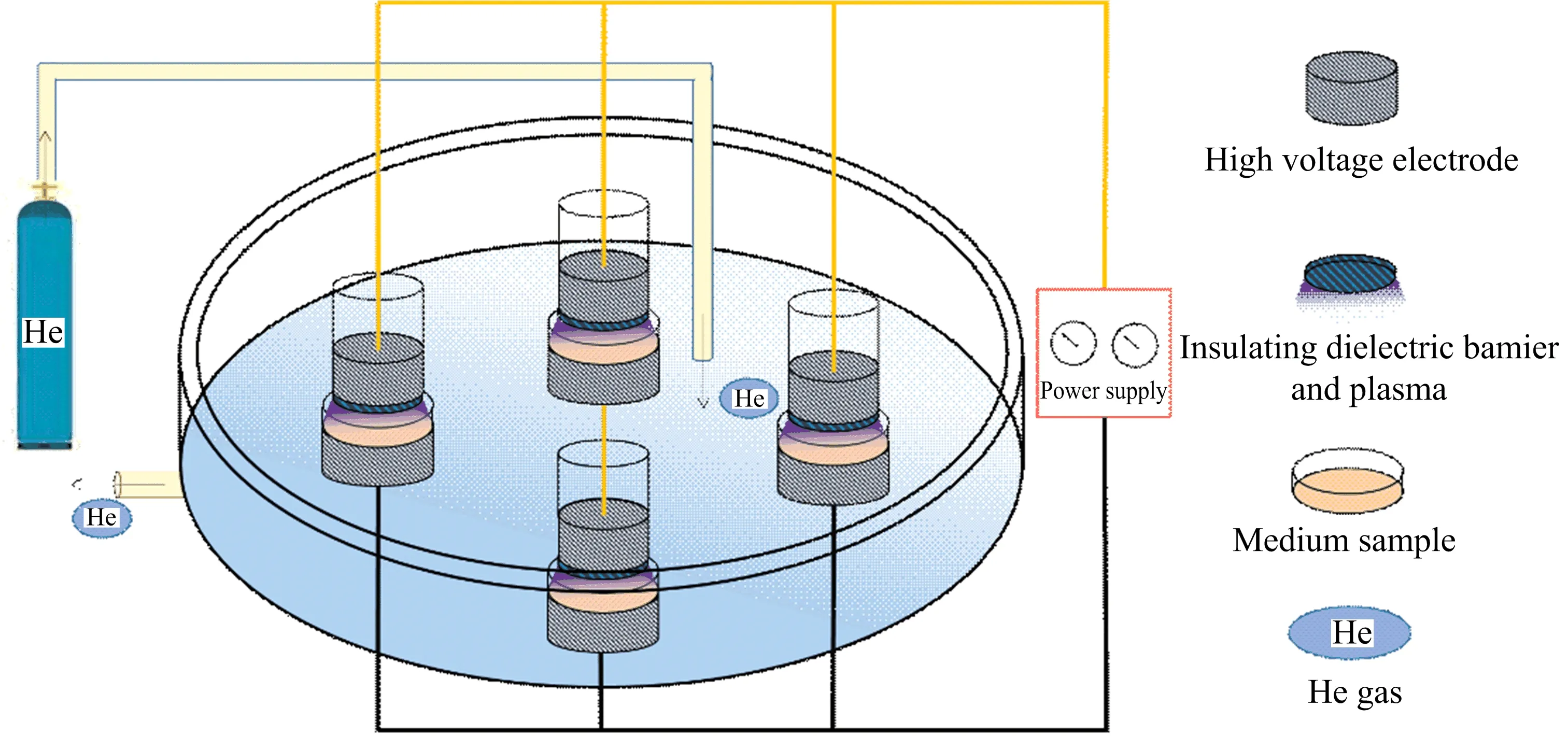
图1 介质阻挡放电装置示意图
1.4 CCK-8法检测细胞活力变化
取对数生长期的细胞接种于35 mm培养皿(3×105细胞/皿),待细胞贴壁后加入草氨酸钠处理24 h,再进行NTP处理;24 h后弃上清,加入800 μL含10% CCK-8溶液的DMEM培养基,37 ℃避光孵育30 min后取100 μL转移至96孔板,酶标仪检测450 nm下吸光值.
1.5 Annexin V-FITC /PI双染法检测细胞凋亡
NTP处理后12 h,消化细胞制备悬液,离心(4 ℃,1 000 r·min-1,5 min)后,弃上清,PBS重悬;再次离心(参数同上)后,弃上清.加入Annexin V-FITC /PI染料,避光染色15 min,流式细胞仪检测(PI:激发波长为488 nm,发射波长为515 nm;FITC:激发波长为488 nm,发射波长为560 nm).
1.6 细胞内ROS水平检测
NTP处理后12 h,弃培养基,PBS清洗,加入含DHE的DMEM培养基,37 ℃避光孵育30 min.染色结束后,弃上清,酶解消化制备单细胞悬液,800 r·min-1离心5 min,PBS重悬,重复2遍,流式细胞术检测(激发波长:518 nm,发射波长:606 nm).
1.7 线粒体膜电位(JC-1)检测
JC-1工作液配制:取JC-1储存液(50 μL, 200×),加入8 mL超纯水,避光条件下用涡旋仪涡旋20 s;再加入JC-1染色缓冲液2 mL,混匀即为JC-1染色工作液.洗涤液配制:将5×染色缓冲液用蒸馏水稀释至1×即可.
NTP处理后4 h,酶解细胞制备悬液,离心(1 000 r·min-1, 5 min),弃上清,PBS重悬;重复1次后,用DMEM培养基(500 μL)重悬.加入JC-1工作液(500 μL),37 ℃避光孵育20 min.染色结束后离心(4 ℃,2 000 r·min-1, 5 min),弃上清,洗涤液洗2遍,最后用1 mL洗涤液重悬,进行流式细胞术检测(JC-1单体激发波长514 nm,发射波长529 nm;聚合体激发波长585 nm,发射波长590 nm).
1.8 Western blot检测相关蛋白表达变化
将细胞酶解制备悬液,离心(4 ℃, 1 000 r·min-1, 5 min)后用PBS洗涤1次,加入RIPA裂解液置于冰上裂解10 min,超声破碎,离心(4 ℃, 14 000 r·min-1, 10 min)后BCA法定量,加入相应5×loading buffer,混匀后100 ℃煮沸10 min,置-20 ℃备用.
配置10%聚丙烯酰胺凝胶,加入蛋白样后进行电泳(150 V, 55 min).电泳结束后转膜2 h,再用5%脱脂牛奶封闭1 h,TBST清洗1遍,一抗(Beta-actin稀释比例为1∶5 000,其他抗体稀释比例1∶500)4 ℃孵育过夜.次日室温复温10 min,TBST洗3次,加入二抗(1∶500)室温孵育2 h,TBST洗3次,双色激光扫描仪扫描.
1.9 细胞能量代谢变化检测
将待测细胞接种于Seahorse XFe24专用培养板中(4×104细胞/孔),按操作手册对细胞进行处理,上机运行程序,检测细胞能量代谢相关参数的变化(NTP处理时间为30 s).
1.10 统计学方法
数据统计采用SPSS 16.0完成,作图采用GraphPad Prism 8.0完成;样本间数据显著性分析采用Student’st检验.p<0.05表示两样本之间差异有统计学意义.
2 结果与分析
2.1 草氨酸钠促进NTP诱导的黑色素瘤细胞活力改变
取3种人黑色素瘤细胞(A375,MEL-RM,A875),接种于35 mm培养皿(3×106细胞/皿),细胞贴壁后使用不同浓度草氨酸钠预处理24 h,再进行NTP暴露,24 h后检测细胞活力变化,结果如图2所示.


相较于NTP单独处理组,*p<0.05;**p<0.01;***p<0.001.图2 不同浓度草氨酸钠联合NTP处理后,A375(a)、MEL-RM(b)和A875(c)细胞活力变化
如图2(a)所示,在A375细胞中,在不同处理时间下,与2 mmol·L-1以上浓度的草氨酸钠联用可显著降低细胞活力,如在NTP处理90 s时,联用组细胞活力为40.6%±1.7% (2 mmol·L-1),18.7%±2.4% (4 mmol·L-1),15.8%±1.6% (6 mmol·L-1)和14.3%±2.0% (8 mmol·L-1),均显著低于NTP单独处理组(74.7%±4.4%);在MEL-RM细胞中,如图2(b)所示,在不同处理时间下,使用20 mmol·L-1以上浓度的草氨酸钠进行联用可显著降低细胞活力,如在NTP处理90 s时,联用组细胞活力为9.2%±3.2% (20 mmol·L-1)和6.4%±0.5% (30 mmol·L-1),均显著低于NTP单独处理组(21.2%±3.4%);在A875细胞中,如图2(c)所示,使用20 mmol·L-1以上浓度的草氨酸钠进行联用可显著降低细胞活力,如NTP处理90 s时,联用组细胞活力为52.6%±5.8% (20 mmol·L-1)和44.7%±3.7% (30 mmol·L-1),均显著低于NTP单独处理组(75.9%±5.2%).
2.2 草氨酸钠促进NTP诱导的黑色素瘤细胞凋亡
细胞凋亡由Annexin V/PI双染法联合流式细胞术检测,结果如图3(a)~(c)所示;线粒体膜电位(mitochondrial membrane potential, 简称MMP)的检测结果如图3(d)所示;Western Blot进一步检测凋亡相关蛋白PARP,Caspase-3的表达,结果如图3(e)~(f)所示.
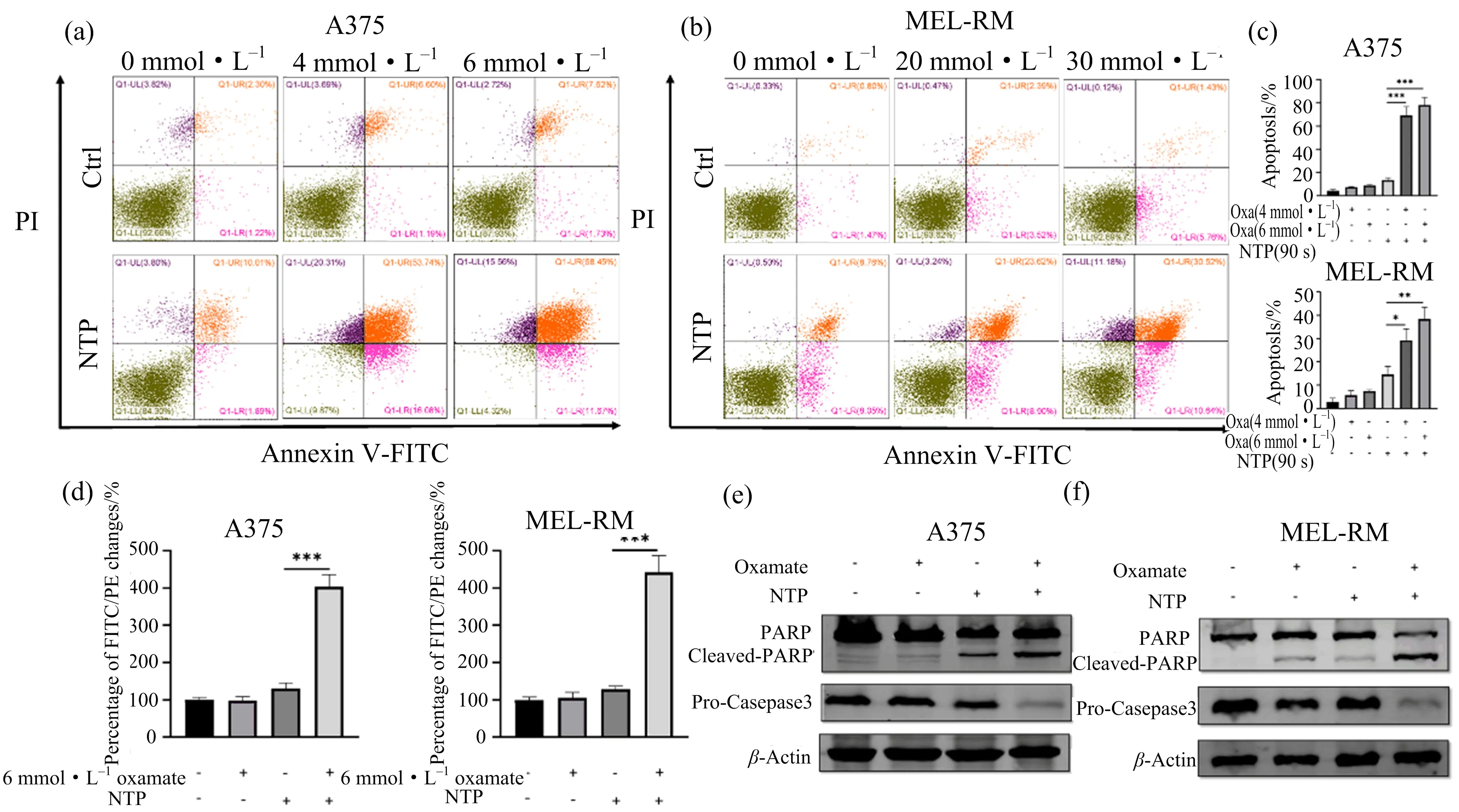
(a)A375凋亡流式图;(b)MEL-RM凋亡流式图;(c)凋亡率量化结果;(d)A375,MEL-RM线粒体膜电位量化结果;(e, f)A375,MEL-RM凋亡相关蛋白检测;*p<0.05,**p<0.01,***p<0.001.图3 草氨酸钠联合NTP处理后A375、MEL-RM细胞凋亡相关指标检测
图3(a)~(c)显示,在A375细胞中,草氨酸钠与NTP联用组的细胞凋亡率为69.2%±6.2%(4mmol·L-1,90 s)和78.2%±5.3%(6 mmol·L-1,90 s),显著高于NTP单独处理组(13.4%±1.6%);在MEL-RM细胞中,草氨酸钠与NTP联用组的细胞凋亡率为29.2%±4.0%(20 mmol·L-1,90 s)和38.4%±4.2%(30 mmol·L-1,90 s),显著高于NTP单独处理组(14.5%±2.8%).MMP下降是凋亡的早期事件之一,如图3(d)所示,在A375和MEL-RM细胞中,单独使用NTP或者草氨酸钠处理,膜电位去极化作用较弱,与对照组无明显差异;草氨酸钠预处理后进行NTP暴露,线粒体膜电位去极化显著增强.Western Blot检测的凋亡相关蛋白PARP,Caspase-3的表达结果显示(图3(e)~(f)),在A375和MEL-RM细胞中,联用组中凋亡执行蛋白Caspase-3原带显著低于草氨酸钠或NTP单独处理组.虽然NTP单独处理组和联用组均出现cleaved-PARP,但联用组cleaved-PARP条带显著增强.以上结果表明,草氨酸钠与NTP联合使用可显著诱导凋亡.
2.3 草氨酸钠联合NTP处理对黑色素瘤细胞能量代谢的影响
如图4所示,在A375细胞中,单独使用草氨酸钠处理,细胞氧耗量、基础呼吸、最大呼吸和ATP产量均出现一定程度的下降.单独使用NTP处理,细胞氧耗量、基础呼吸、最大呼吸和ATP产量均无明显变化.而联用组中,细胞的氧耗量、基础呼吸、最大呼吸和ATP产生量相较于两者单独处理组均显著降低,表明草氨酸钠与NTP联合使用可进一步显著抑制黑色素瘤细胞的能量代谢水平.
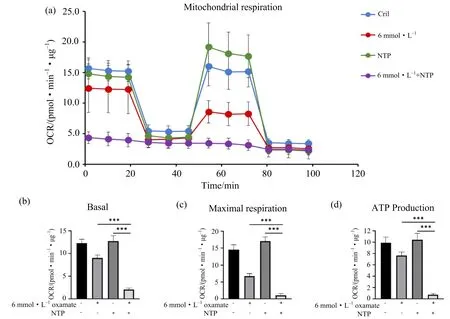
(a)氧耗率;(b)基础呼吸;(c)最大呼吸;(d)ATP产量;*p<0.05,**p<0.01,*** p<0.001.图4 草氨酸钠联合NTP处理显著抑制黑色素瘤细胞的能量代谢
2.4 草氨酸钠联合NTP激活AMPK
在A375和MEL-RM细胞中,Western blot检测AMPK及p-AMPK蛋白表达情况,结果如图5所示.

(a)A375细胞中AMPK原带及磷酸化带;(b)MEL-RM细胞中AMPK原带及磷酸化带.图5 草氨酸钠联合NTP处理显著增强AMPK磷酸化
图5显示,在A375细胞中,AMPK原带在各组均有明显条带,但只有联用组出现p-AMPK条带.在MEL-RM细胞中,AMPK原带在各组均有明显条带,NTP单独处理组和联用组均有p-AMPK表达,但联用组中p-AMPK条带更强.以上结果提示,草氨酸钠和NTP联用能显著促进AMPK的磷酸化.
2.5 草氨酸钠联合NTP导致细胞中ROS水平升高,引起AMPK磷酸化
草氨酸钠处理细胞24 h后进行NTP暴露,ROS检测结果如图6(a)~(b)及(d)~(e)所示;为了进一步研究ROS的具体作用,在NTP处理前4 h使用ROS清除剂NAC预处理细胞,细胞活力及AMPK磷酸化检测结果如图6(c),(f)及(g)所示.
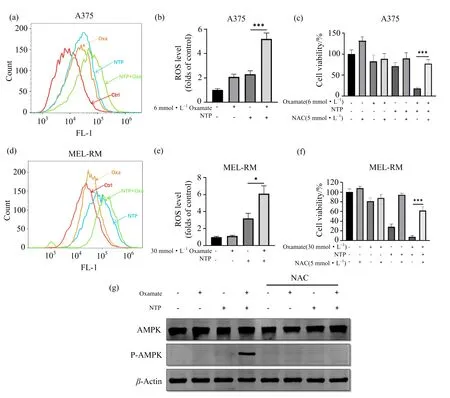
(a, d):A375,MEL-RM细胞内ROS峰图;(b, e):A375,MEL-RM细胞内ROS水平统计图;(c, f):NAC挽救A375,MEL-RM细胞活力实验;(g)NAC预处理对AMPK磷酸化的影响;*p<0.05,**p<0.01,*** p<0.001.图6 草氨酸钠预处理促进NTP诱导的A375、MEL-RM细胞内ROS水平升高,进而激活AMPK
图6(a)~(b)及(d)~(e)显示,在A375细胞中,尽管草氨酸钠和NTP单独处理组胞内ROS较对照组有所升高,但联用组胞内ROS水平显著高于NTP单独处理组.在MEL-RM细胞中,草氨酸钠单独处理未显著改变胞内ROS水平,NTP单独处理使胞内ROS有所升高,但联用组胞内ROS水平较NTP单独处理组显著升高.图6(c)及(f)显示,在NTP处理前4 h使用ROS清除剂NAC预处理细胞可显著提高联用组细胞活力;另外,在A375细胞中,NAC处理使联用组中p-AMPK带明显减弱(图6(g)所示),说明NAC处理对联用组中AMPK磷酸化也有抑制作用,提示胞内ROS水平上升导致了AMPK磷酸化.
3 讨 论
ROS是细胞内氧相关的代谢产物,外界刺激因素如紫外线、电离辐射、化疗药物可导致胞内ROS水平显著升高,发生氧化应激,损伤细胞内功能分子,甚至导致细胞死亡[9].引起胞内ROS升高是NTP杀伤肿瘤细胞的重要机制.癌细胞的代谢率较高,胞内ROS的本底水平显著高于正常细胞,且过氧化氢酶等表达显著低于正常细胞.因此当发生氧化胁迫时,肿瘤细胞内ROS水平比正常细胞更容易达到阈值,引起线粒体受损、DNA损伤,诱发细胞凋亡,从而达到选择性杀伤癌细胞的效果[10].该研究中使用NTP处理黑色素瘤细胞后,细胞内ROS水平显著上升,与既往研究报道[4]一致.
小分子药物草氨酸钠是一种公认的LDH特异性抑制剂,近年来在癌症治疗方向被广泛研究,体外实验中它能够有效抑制肿瘤细胞的能量供给、生长和迁移,动物实验中抑制肿瘤细胞的成瘤能力,影响肿瘤相关巨噬细胞的极化,进而起到抗肿瘤的效果[11].国外有研究发现抑制LDH会引起胰腺癌细胞内ROS爆发,从而起到抑制细胞生长甚至杀伤细胞的作用[19].国内也有研究报道草氨酸钠可与放射联合使用,通过抑制细胞生长、DNA修复、增强细胞周期阻滞提高鼻咽癌、非小细胞肺癌的放射敏感性[12].笔者将草氨酸钠与NTP联合使用,发现其联合使用能够显著增强对黑色素瘤细胞A375,A875和MEL-RM的杀伤作用,初步探究其可能的机制,发现相对于对照组、药物单独处理组、NTP单独处理组,联用组能够显著增强细胞内ROS,降低线粒体膜电位和能量代谢水平,显著提高凋亡相关蛋白的表达和凋亡细胞比率.
AMPK是一种丝氨酸/苏氨酸蛋白激酶复合物,是生物体内维持营养和能量平衡的传感器,由负责催化的α亚基和负责调节的β和γ亚基组成异三聚体复合物,通过感知胞内AMP/ATP或ADP/ATP比率变化来监测细胞能量状态[20].当细胞发生氧化胁迫如ROS升高时,能量代谢受阻,AMP相对含量升高,引起AMPK磷酸化,激活下游凋亡通路,导致细胞死亡[21].笔者研究发现草氨酸钠与NTP联用能够显著增强AMPK的磷酸化水平,经NAC处理后,联用组细胞活力得到显著回升,且AMPK磷酸化水平明显减弱,表明ROS升高是AMPK活化的主要原因,两者联用共同参与对黑色素瘤细胞的促凋亡进程.
4 结束语
综上所述,草氨酸钠与NTP联用能够显著增强对人黑色素瘤细胞的杀伤作用,其机制可能是通过提高胞内ROS水平,引发线粒体结构和功能受损、能量代谢受阻,ADP/ATP比率升高导致AMPK磷酸化显著增强,从而引起下游凋亡相关通路过度激活所致.该研究可为等离子体今后在癌症治疗方面的发展提供一定的理论基础和指导.
* * * * * *
致谢:感谢中国科学院等离子体物理研究所程诚副研究员和奚文灏在等离子体处理方面给予的专业指导.
