大气压冷等离子体在皮肤病学中的应用
2022-05-06刘大伟陈柏寒
刘大伟,陈柏寒
(华中科技大学 电气与电子工程学院 强电磁工程与技术国家重点实验室,湖北 武汉 430074)
等离子体是指气体中放电的物理现象,由于等离子体作为一种基质携带各种不同种类粒子,非常类似于血浆携带红细胞、白细胞和细菌等物质的情况,因此在一开始均匀放电被形象地称为电浆,即等离子体.由于其不同于常见气液固态物质的特性,等离子体被认为是物质的第4态.地球上常见的等离子体包括闪电、极光和火焰.等离子体在低压、大气压和高压条件下均可以产生,产生方法为由电场、辐照或者热激发产生的高能促使中性气体转换为等离子体态,由强电场加速的高能电子与气体分子碰撞,产生强电离,与此同时,在等离子体中会生成包括带电粒子、自由基、亚稳态粒子和光子在内的“混合物”.随着电气工程和材料科学的发展,大气压冷等离子体(cold atmospheric plasma,简称CAP)被开发出来,其在医学领域的应用广泛,包括去污和灭菌、皮肤病治疗和癌细胞治疗等[1-7].
人体的皮肤是人体最大的器官,总面积可达1.5~2 m2,可以保护人体免受热、光照和伤口感染的侵害,但作为人体最外层的屏障,这意味着皮肤也很容易受到病原体或传染源的侵袭.近来,皮肤病愈发成为一类常见病,并且传统治疗手段的治疗作用和经济效益都较为低下,急需研究新的治疗方法.CAP正是其中之一,它的优势在于其不仅可以对常见细菌进行杀灭,而且不会损害皮肤样本的正常细胞[8].CAP在皮肤治疗中的作用方式包括杀死微生物、刺激组织、抗炎和止痒等[9].
等离子体源为CAP在皮肤治疗中的应用提供了物理基础(图1),目前已被广泛应用的技术包括等离子体射流、电晕放电、介质阻挡放电、微波等离子体、微等离子体阵列等.根据接地电极的不同,可以将这些等离子体源分为直接和间接等离子体源.这些等离子体源产生的等离子体体积通常为数mm3至数cm3,电功率为数W.
CAP是进行皮肤病学治疗的核心(图1).应用于皮肤和伤口组织的CAP应当具有3个特性:可在气温低于40 ℃的大气压下运行;产生的平均电子能量足够用于电子撞击激发、离解和电离;热传导过程不对皮肤产生热伤害[10].CAP中起作用的物质包括带电粒子(电子和离子)活性氧/氮(reactive oxygen and nitrogen species,简称RONS)、紫外线(100~380 nm)以及电场.CAP主要是通过诱导凋亡(程序性细胞死亡)、刺激新陈代谢以及对哺乳动物细胞的特定作用等在细胞内外诱导细胞效应,如灭活/消杀具有抗生素抗性的微生物以及癌细胞等[11].CAP应用于临床有更严格的要求,比如尽量便携的等离子体源、更大的有效作用区域,还有适当的单次治疗的强度和时间以及长期治疗的持续时间和频率等.
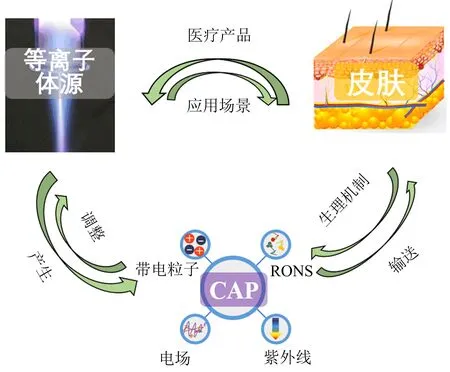
图1 CAP的来源及其在皮肤病学中的应用(资料来源:文献[11])
1 大气压冷等离子体(CAP)的产生
1.1 CAP来源
在皮肤病学中,CAP的主要作用是杀菌,诱导细胞凋亡,促进生长因子和细胞迁移,调节微循环、血管生成和调节免疫反应等[9,12-13],这些作用依赖于RONS、电场、带电粒子和紫外线辐射(UVR)[11,14].CAP在大气压下可以根据所需效果灵活更改其组成和电特性.适用于皮肤治疗的CAP源可分为2种主要类型:间接和直接等离子体源.
与直接等离子体源不同,间接等离子体源包含电源电极和接地电极.等离子体主要在两个电极之间产生,部分等离子体可以通过电场迁移、对流和扩散到达目标表面[15].等离子体射流是最常见的间接等离子体源.图2(a)是一个典型的介质阻挡放电(dielectric barrier discharge,简称DBD)等离子体射流.功率电极是由电介质管环绕的针电极,一端闭合,管的环形电极接地[15-16].当稀有气体(如氦气、氩气等)通入电介质管,放电后在周围的空气中产生等离子体射流,气体温度接近室温.尽管气体流速仅为20~50 m·s-1,但等离子体射流由速度大于10 km·s-1的等离子体子弹组成,而沿等离子体羽流的强电场进一步促进了更长的等离子体羽流的形成和更活跃的等离子物质的产生[17].
其余等离子体源包括:直流电源用于带有单个针状电极[15]或空心针状电极(注射器)[18]的直接等离子体源.施加的直流电压通常为5~20 kV.当这种等离子体应用于人体时,需要接地以避免带电效应[18].脉冲直流电源用于以稀有气体为工作气体驱动的所有DBD直接/间接等离子体源,这种等离子体射流具有更长的等离子体羽流,并且活性更高[19].还有另一种射频等离子体,尽管其运行过程中的高温气体限制了其生物医学应用,但是采用脉冲式射频电源可以将等离子体的气体温度降低到室温.这种等离子体具有长且稳定的等离子体羽流,可快速响应射频场,且脉冲射频等离子体更为活跃[20].
在直接等离子体源中,被处理的皮肤或伤口组织充当对电极,因此放电电流(位移或传导电流)会流经人体,常见例子是介质阻挡放电(DBD).功率电极上覆盖着一层厚度不超过1 mm的薄绝缘层,功率电极与被治疗的皮肤或组织之间相距数mm.放电可以在均匀(扩散)模式下进行(图2(c)),当工作气体为空气时,放电产生许多直径不超过200 μm的丝状放电,这些丝状放电随机分布在整个介质阻挡面上,且会转移电介质表面累积的电荷,从而导致放电在10-8~10-7s内快速自终止.图2(b)所示功率电极采用针状电极,其与皮肤间隙增加到数cm,当手指等靠近针电极即可产生脉冲放电,其中限流电阻可以限制放电电流以避免产生电弧过渡[21].直接等离子体源通常直接在空气中放电,所以等离子体化学以氧和氮族物质为基础.当直接等离子体源被用于治疗受伤的组织时,带电粒子和强电场可能会引起轻微的电击,因此,直接等离子体源只适用于具有结构完整性的皮肤疾病,例如湿疹、特应性皮炎等.

(a)为间接等离子体源;(b)(c)为直接等离子体源.图2 直接和间接等离子体源的产生机理
1.2 等离子体源与皮肤之间CAP射流的发展过程
生物体的复杂结构要求等离子体源具有较长的工作距离和更大的作用区域,这样可以提高CAP的处理效率.等离子体源与皮肤之间CAP射流的发展过程如图3所示.图3(a)显示了具有3个等离子体羽流的脉冲直流等离子体射流阵列.图3(b)~(e)表明了等离子体子弹的存在,其最大速度为7.5×106cm·s-1[20].等离子体子弹的发展包括两个阶段:第一阶段,介电管内部的强电场触发放电,电离波沿着内壁移动.第二阶段,等离子体子弹离开管子后沿着稀有气体和环境空气的混合层传播,等离子体羽流整体方向沿管轴.等离子体子弹前面的初始电子是由强电场区域(等离子体子弹头)发出的高能光子通过气体的电离而产生的[21].返回子弹头的电子在放电的等离子体通道前产生密集的正电荷和强电场的放电,这些放电有助于通道的延长.

(a) 脉冲直流等离子体射流阵列;(b)~(e) 等离子体子弹的发展;(f) 脉冲射频等离子体射流阵列;(g)~(j) 射频等离子体射流阵列的传播过程;(k) 覆盖有电介质阻挡层的功率电极和细菌生物膜之间的单根空气丝放电;(l)~(o) 空气丝以等离子体子弹模式传播;(p)~(r) 空气丝放电到达生物膜表面及膜腔中.图3 等离子体源与皮肤之间CAP的发展动态过程
图3(f)表示脉冲射频等离子体射流阵列,与等离子体子弹传播机制不同,图3(g)~(j)所示的射频等离子体射流阵列的传播过程显示了射频周期内的等离子体通道发生扩展.大量的长寿命的离子和亚稳态物质积累在通道中,使整个等离子体羽流对所施加的射频电压做出快速响应.图3(h)显示,当施加的射频电压为正峰值时,等离子体羽流的结构为负辉光、法拉第暗空间和从等离子体羽流尖端到管出口的正流注[20].图3(j)显示等离子体羽流的结构包括阳极辉光、阳极暗空间以及在负射频电压峰值处从等离子体羽尖到管出口的正流注[20].整个等离子体通道扩展是射频等离子体射流的主要传播机制,因为等离子体羽在负电压峰值处比在正电压峰值处更长.
电子能量守恒方程(等式(1))可以用来分析脉冲射频等离子体射流阵列的施加功率分布.
(1)
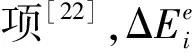
管内的放电实际上是在负射频峰值电压下的空心阴极放电.电子汇聚到管轴并从管中冲出.等离子体通道的高电导率和强电场有利于通过等式(1)所示的焦耳加热将施加的功率耦合到等离子体[22-24].放电产生了许多高能电子,这些高能电子流不仅增强了正极柱的电离和激发(等式(1)中的非弹性碰撞加热),而且还沿着等离子体通道进一步传播.图3(k)为覆盖有电介质阻挡层的功率电极和细菌生物膜之间的单根空气丝放电及其峰值电子密度.图3(l)~(o)显示了空气丝以等离子体子弹模式传播,并在开始放电后的0.3 ns内到达生物膜.图3(m)所示为发生在生物膜的顶部的局部电离,其为等离子体子弹提供了预电离区域,这既加速了空气等离子体子弹的传播,又增加了耦合至生物膜的施加功率[10].图3(p)中的放大图片表明,当空气丝放电到达表面时,生物膜上的电子密度为5.43×1013cm-3.空气丝放电的德拜长度仅为5~10 μm,这远小于生物膜腔的宽度和深度(约50 μm),因此空气丝放电会更加深入生物膜腔中,腔中的电子密度约为1.81×1014cm-3(图3(q))[10-11].高电子密度会使生物膜表面产生强电场,生物膜上的电场(图3(r))为83.2 kV· cm-1.这种强电场可能会导致电穿孔和随后的细胞凋亡[10].
当等离子体到达皮肤/伤口表面时,其在径向上产生扩散,这会扩大CAP的治疗范围.这种扩散通常发生在顶部电介质上,在边界层中产生近1016cm-3的电子密度[25].进一步地,其速度由下面的介电电容的充电速率决定.有效面积可以增加等离子体穿孔的总数,并改善皮肤组织对RONS和带电粒子的吸收.
1.3 CAP的带电种类和电场
带电物质是等离子体应用于生物医学的重要因素.它们不仅可以直接作用于有机物,而且是一种天然的能量载体.诸如Langmuir探针、质谱法等与带电粒子有关的等离子体诊断方法主要用于低压放电,其主要特征是较大的均匀等离子体体积和较低的碰撞频率.然而,大气压等离子体的高碰撞猝灭限制了上述测量技术的应用.
该节中讨论的电荷和电场效应对等离子体应用于皮肤病学非常重要,一方面,包含电子和离子的高能带电粒子可以改变细胞膜的表面形态、接触角和电特性;另一方面,等离子体在很大程度上会增加细胞膜的渗透性,从而允许分子跨细胞膜转移.在ns范围内较短的等离子体脉冲可能会产生小孔,这些小孔不允许大分子通过,但允许离子通过[30].因此,带电物质和电场会对细胞结构产生重大影响,这为后面讨论的等离子体产生活性物质的透皮递送提供了技术基础.
1.4 CAP的活性物质
活性物质是对促进伤口愈合和减轻银屑病症状具有重要作用的活性成分之一.高能电子与CAP中气体分子的碰撞会产生原始活性物质,包括电子和振动激发的O2和N2分子,处于基态和激发态的N,O和H原子以及OH自由基[11,27,31].这些原始物质之间的进一步反应会产生RONS,例如OH,NO,NO2,HNO2,HNO3,H2O2等.对关键活性物质如O,O2(1△g),O3,OH和NO的实验和数值诊断将有助于调整处理剂量,并有助于优化等离子体工艺以用作特定用途.

等离子体产生大量的原子氧,它们可以通过强氧化作用改变细胞膜化学性质和细胞的通透性.测量原子氧的绝对密度是一大难题,其中微波等离子体射流的原子氧(O)的绝对密度可以通过两光子吸收激光诱导的荧光(TALIF)来测量[32].
臭氧(O3)是一种活性氧化剂,在皮肤病学中特别适用于治疗慢性肢体缺血和多种皮肤感染[33].当向工作气体中添加少量O2或环境气体为周围的空气时,CAP源会生成O3,可以通过紫外吸收光谱法测量O3.对于采用稀有工作气体的等离子体射流,O3聚集在稀有气体与空气之间的混合层中,其峰值O3浓度为16×1014cm-3.间接空气CAP源的O3峰值浓度为78×1015cm-3,这远高于前者[34]并且随着喷嘴与CAP源距离的增加,峰值O3浓度会降低.显然主导O3生成的反应为:O+O2→O3.
CAP产生的一氧化氮(NO)可能导致细胞凋亡、坏死或反过来保持细胞活性,这和细胞类型,自由基浓度以及暴露的持续时间、特定区域密切相关.NO可以通过促进血管和成纤维细胞的生长来促进伤口愈合,这种效应对于皮肤病学非常重要.NO浓度决定了CAP治疗时间和剂量,它可以通过质谱法、光吸收光谱法、光发射光谱法和激光诱导荧光(LIF)来测量.空气混合比对以稀有气体为工作气体的等离子体射流产生的NO浓度有显著影响,NO浓度还受湿度影响.NO主要通过Zel’dovich反应生成:N2+O→NO+N以及N+O2→NO+O,而与O3的反应和反向Zel’dovich反应NO+O→N + O2将NO转化为NO2主导了NO的衰变[35-36].
伤口治疗中的一个常见问题是生物膜阻碍伤口愈合,生物膜附近等离子体产生的高浓度RONS可以诱导电穿孔和膜表面改性[10].活性自由基(NO,OH和超氧化物)或强氧化剂(H2O2和O3)可以渗透到微生物中[12],在细胞质内部发生进一步的化学反应.然后,所有成分都会氧化细胞蛋白或微生物DNA.另外,这些RONS还可以通过脂质过氧化作用破坏微生物细胞膜结构的完整性,导致膜损伤[6,37].因此,在强电场的帮助下,RONS可以杀死伤口生物膜中生长的耐药细菌.
这些实验和数值结果表明,直接和间接等离子体源都可以将具有高电荷密度和强电场的等离子体输送到皮肤上.电极结构、施加的电压、间隙等会影响等离子体的强度.等离子体可能会挤进活组织表面生物膜内部的狭窄空间(μm级),CAP产生的带电物质、电场和活性物质的共同作用有助于提高皮肤疾病的治疗效率,这些效果对于具有耐药菌感染和复杂结构性病变的皮肤疾病也同样非常有用.
2 活性粒子的运输
非侵入式治疗,即不破坏皮肤的医疗程序,被广泛应用于皮肤治疗.近来,微针经常用于通过破坏角质层结构来改善透皮药物递送.而等离子体是一种二合一的工具,可实现RONS的有效透皮递送以及可恢复的角质层破坏.截至目前,许多直接和间接等离子体源已被证明可安全用于伤口愈合和炎性疾病的治疗[2,38].等离子体处理的协同作用使得使用等离子体治疗皮肤疾病优于采用脉冲电场治疗或光疗,这些作用包括灭菌、增加微循环和皮肤酸化等.进一步的研究集中于了解等离子体在单个分子水平或细胞水平上的作用,这种深入的了解可以促进等离子体在皮肤病学中的应用.
2.1 透皮等离子体递送(等离子体穿孔)
药剂和药膏在数百年来被广泛用于治疗皮肤疾病,但是皮肤屏障阻止了大多数活性物质到达目标结构,导致传统药物药效不尽人意.因此,需要进一步采用各种物理技术破坏皮肤屏障,如微针阵列、超声波治疗等增加局部应用透化剂的渗透性,但是这些技术发展至今依然存在着各种各样的问题.而最近发现等离子体在伤口愈合或炎症治疗中会结合活性物质、电场、电流和光子等产生综合效应,具有很大的应用前景,如何最大化或控制活性物质的渗透从而改善治疗效率是一个值得深入讨论的问题.
皮肤分为3层(图4(a)):即表皮、真皮和较深的皮下组织.表皮是皮肤的最外层,可提供防水屏障[11].表皮下方的真皮包含坚韧的结缔组织、毛囊和汗腺.较深的皮下组织由脂肪和结缔组织组成.角质层(stratum corneum,简称SC)是表皮的最外层边界,形成了对环境的主要保护屏障,在SC上成孔是等离子体透皮递送的先决条件.

(a) 皮肤的三层结构示意图;(b) 皮肤上产生电场的场强为170 kV·cm-1,穿透皮肤组织深度为1 mm;(c) CAP处理后诱导皮肤表面角质细胞的结构变化图像,由激光扫描显微镜拍摄;(d) CAP处理后的表皮图像,由激光扫描显微镜拍摄;(e) 激光扫描显微镜下的CAP处理后乳头状真皮上的染色;(f)~(g) 表示等离子体处理后在角质层形成的导电区域;(f)为等离子体处理后5 min的图像;(g) 为处理24 h后的图像;(h) 表明CAP处理促进红色右旋糖酐的透皮递送;(i) 表明CAP处理增强脂质体的透皮递送.图4 等离子体透皮运输
“等离子体穿孔”的关键因素包含电场、热效应和RONS.与电穿孔类似,等离子体的电场会在皮肤上产生电压降,而大部分电压降会施加在高电阻SC上,长期运行后,表面电势达到与驱动电压相同的值,此电压分布导致SC电击穿.直接施加在皮肤上的DBD空气等离子体在皮肤表面和下层间产生约170 kV·cm-1的电场(图4(b))[39],并最终穿透皮肤形成孔洞.图4(c)所示的图像显示了经等离子体处理后SC的蜂窝结构破坏.
角质层的渗透性可以通过加热皮肤来增加.通过升高温度,SC脂质的结构发生变化,从而改善透皮递送.皮肤表面上空气流束的功率密度为6.4×1011W·m-3,人体的比热容仅为3 470 J·(kg·℃)-1,所以等离子体处理可以改变由组织良好的角质细胞形成的均匀蜂窝结构,甚至可以使皮肤局部温度升高至100 ℃以上.图4(d)所示的激光扫描显微镜图像表明脂质层融化且角质细胞受到热损伤[40].表皮中的结构损伤有利于等离子体透皮输送至更深的皮层.图4(e)显示了等离子体处理后乳头状真皮上的荧光染色,低于75 ℃的转变是可逆的[41].为了防止皮肤灼伤,需要控制CAP的治疗时间,等离子体的快速但温和的加热过程可以增加皮肤的渗透性却不破坏更深层的组织.更重要的是,等离子体穿孔对皮肤屏障性质的影响在很大程度上是完全可逆的.图4(f)和(g)表明,SC样品经过90 s CAP处理后在其上产生的孔在处理后的24 h内减少了50%以上,这表明SC没有受到持久的破坏.
等离子体中生成的RONS与脂肪酸可以通过一系列复杂的反应来增加皮肤的渗透性,这对于透皮给药尤其重要.图4(h)表明3 kDa右旋糖酐分子在CAP处理后1 h内到达表皮层,深度约为0.3 mm,而未经过CAP处理的样品中右旋糖酐分子仍保留在皮肤表面.进一步的实验表明,暴露于CAP 1 min后,大分子葡聚糖的透皮递送深度约为0.6 mm.图4(i)表明,与电穿孔相比,CAP可以将更多的药物递送到更深的皮肤处.等离子体穿孔是等离子体治疗皮肤病背后的基本机制.等离子体穿孔促进了皮肤表面上方生成的NO的转运,最终导致血管扩张、血流量增加和组织氧合.等离子体穿孔还促进了对细菌的消杀,并有助于抑制银屑病病变中的炎症浸润和血管生成[42].在第3部分将讨论CAP治疗机制的更多详细信息.
2.2 向组织中输送活性粒子
等离子体在伤口愈合和皮肤病治疗中的应用仍处于早期阶段,并且处于进行临床研究的活跃领域.至今为止,至少有4种等离子体设备已获得医疗设备认证.例如,SteriPlas(日本AdTec有限公司)被证明可有效杀菌和促进伤口中的生长因子产生[43].PlasmaDerm(德国Cinogy GmbH)也已被临床试验证明其在治疗慢性腿部溃疡方面是安全有效的[2].
许多此类应用涉及直接或间接等离子体源与覆盖有液体的受损组织接触.重要的是,大多数伤口在其早期发展阶段都被水状液体层覆盖,该液体层通常为数百μm厚,为了提高修复和重建受损组织的效率,需要确定等离子体产生的活性物质被递送到皮下.
在等离子体产生的RONS渗入细胞之前,活性粒子必须克服3道屏障(见图5(a)~(c)).而等离子体通过复杂的机制促进了这些渗透作用.等离子体与液体相互作用期间影响最大的是溶解的RONS、次级水反应和等离子体引起的对流,该部分内容将在下面讨论.
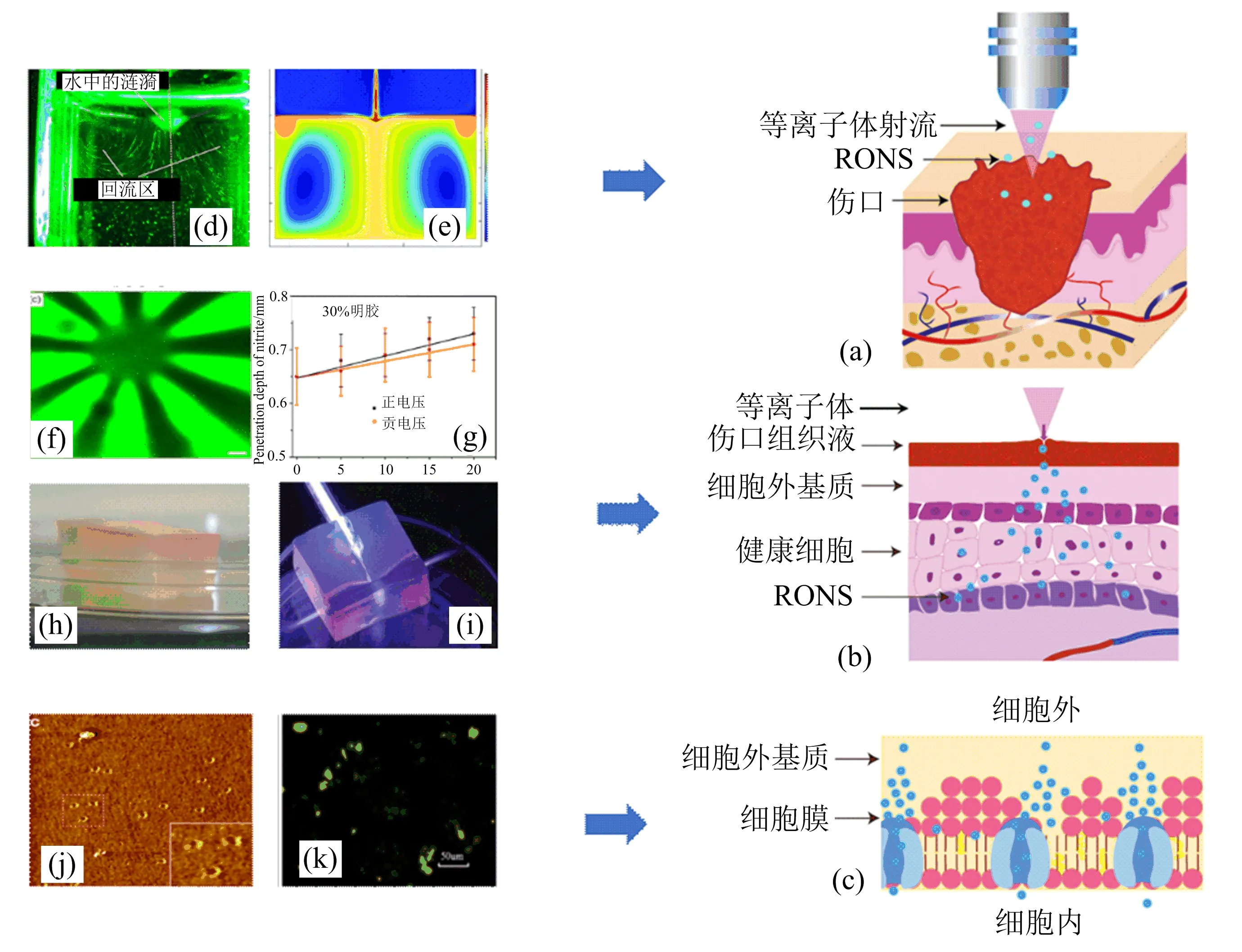
(a) 等离子体-组织液屏障;(b) 组织液-组织屏障;(c) 组织-细胞屏障;(d) CAP诱导的液体流动剖面图,由气泡激光散射可视化;(e) CAP处理后液体上方的H2O2气相图和液体内部的H2O2液相图;(f) CAP垂直于明胶基质表面处理300 s后的合成生物传感器的共聚焦显微镜图像;(g) 表明小电场增强了明胶凝胶中RONS的渗透性;(h) 具有H2O2荧光染料的琼脂糖凝胶经CAP处理后的图像;(i) CAP在T形琼脂糖管内传播;(j) CAP处理后细胞膜上产生纳米孔;(k) CAP处理后细胞内ROS分析,由流式细胞仪测得.图5 RONS到达皮肤内部之前必须穿透的3道屏障
CAP与被渗出液覆盖的伤口接触时会干扰液体.图5(d)显示了CAP产生的液体中的凹痕和流动模式.CAP的离子牵引力和气体加热有助于将动量传递到液体表面,产生这种效应最可能的原因是CAP传递的净电场和离子通量会使液体表面带电[44].由该效应产生的涟漪将液体推下并引起对流,一旦气态等离子体活性物质溶解到液体中,它们就通过对流被运输.液体的流动模式在具有高亨利常数的溶解物质的密度分布图中清晰可见,如图5(e)所示.遵循图5(d)所示的液体流动模式,水溶性等离子体活性物质最初保留在等离子体—液体界面处并累积在反向涡流中,它们也流回液体表面,然后返回到大块液体中.具有较低亨利常数的气态等离子体活性物质在气相中堆积在等离子体—液体界面的正上方,从而导致液相中的活性物质浓度要低得多.
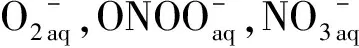
尽管气态RONS寿命短,但其仍显著促进了含水活性成分的产生,这与观察到的液体对流模式是一致的.紫外可见光谱(UV-Vis)、电子自旋共振(ESR)和液体色谱质谱法(LC-MS)通常用于测量液体中由等离子体产生的RONS.CAP产生的液体中的短寿命RONS包括超氧化物(O2)、氢过氧自由基(HOO)、OH和过氧亚硝酸(ONOOH),实际上,这些寿命较短的RONS在产生后迅速转变为寿命更长且更稳定的次级RONS,例如H2O2、硝酸盐(NO3)和亚硝酸盐(NO2).这些长寿命的RONS可以与组织液及组织本身中的成分发生反应,并最终促进RONS的细胞内生成,这可能会增加等离子体向组织液中传递的原始RONS剂量[46-48].
当渗出液较少时,等离子体可以直接与皮肤组织相互作用.通常使用两种组织模型来研究如何将RONS递送到组织中.第一种模型是明胶,具有嵌入的磷脂囊泡.当CAP射流垂直于明胶表面时,CAP处理会在明胶基质中形成从治疗区域中心放射出的星形微通道图案,并使明胶表面下方150 μm深度处的微通道内的囊泡局部受损(图5(f)).这些结果表明,电场促进了进入真实生物组织的RONS的运输(图5(g)).第二组织模型是琼脂糖凝胶模型.紫外可见光谱用于鉴定CAP产生的RONS遍历琼脂糖凝胶模型.等离子体效应(例如增加H2O2浓度和降低pH)被转移到组织内部约4 mm深处(图5(h)),这种效应与大鼠皮肤组织和鸡胸组织中的等离子体效应非常相似.图5(i)显示了沿T形管在琼脂糖凝胶中传播的等离子体射流.
磷脂膜是外源RONS的最后障碍.CAP产生的RONS与细胞膜之间相互作用的研究可以帮助理解CAP如何刺激细胞.使用原子力显微镜和荧光显微镜观察发现,一定剂量的ROS在磷脂双分子层中产生了直径为10~50 nm的纳米级孔,并最终破坏了双层结构(图5(j))[49].脂质双分子层(phospholipid bilayer,简称PLB)中脂质的氧化会增加其对ROS的渗透性,尽管渗透自由能垒仍保持在相对较高的水平.脂质的氧化导致PLB中孔形成所需的电场阈值下降,膜上产生的孔促进了RONS深入细胞内部.另一个重要因素是细胞膜上的纳米孔,它们可能有助于促进RONS进入细胞.图5(k)中显示的绿色荧光更强,表明用CAP处理的HaCaT细胞内ROS增加更多[50],ROS的增加可以增强角质形成细胞凋亡并随后减少表皮增殖.这些观察结果证明CAP在银屑病治疗中具有良好的潜力.
尽管这些初步研究为RONS与细胞膜中脂质和胆固醇之间的相互作用提供了有价值的见解,但目前的研究仍存在局限性.例如,细胞膜等在真实条件下是动态的并且是可以自我修复的,细胞膜具有将分子移入和移出的通道,并且细胞膜中包含蛋白质并由复合糖修饰,这些都未包含在研究所用的模型中[46].后续的数值研究将帮助人们更全面地了解等离子体如何刺激细胞,特别是在多层异质皮肤层中.
3 皮肤病学中的应用
最近,关于等离子体对活体和非生命体表面的灭菌作用,促进伤口愈合和治疗各种皮肤疾病的一系列临床试验,都显示出了等离子体在临床上的巨大潜力.等离子体处理的优点包括良好的耐受性、生物相容性和生物安全性.等离子体通过其活性成分(包括RONS、带电粒子、电场和紫外线)影响生物的生化过程.目前对等离子体和生物组织的复杂成分之间相互作用的细节和作用机理的理解仍然有限.现分析在伤口和银屑病上应用CAP的治疗过程、特定活性成分和初步治疗机制(图6),并提出更标准化的治疗方法.

图6 CAP在皮肤疾病治疗中的治疗机制
3.1 CAP对伤口愈合的影响
皮肤伤口愈合是一个复杂的过程,涉及各种细胞和细胞因子.它通常分为3个阶段:炎症、增殖和重塑阶段.由于其复杂性和多阶段性,伤口愈合很容易受到皮肤内部或外部干扰的影响,最终导致慢性伤口的产生[51].这些慢性伤口的治疗不仅占用医疗资源,而且加重患者的经济负担.例如,许多人的小腿患有慢性伤口(溃疡),除动脉疾病或糖尿病外,其主要病因是静脉曲张病和其他静脉疾病,尤其是老年人患有的静脉溃疡.因此,需要有低成本的替代性溃疡治疗方案.
CAP(图6(a))具有很大的替代前景,不仅因为它的生产成本很低,而且其容易用于皮肤伤口处理.CAP在伤口愈合过程中的优势(图6(b))包括:1)强大的抗菌作用加快伤口愈合;2)刺激内皮细胞的增殖;3)CAP处理可以降低伤口内组织液的pH.
大多数皮肤伤口会被细菌定殖,特别是在慢性伤口上经常形成生物膜,这会损害伤口的愈合,其中最常见的细菌是葡萄球菌.坏死组织和渗出物会促进细菌的繁殖和传播,因此治疗的第一步是彻底清创,其次需要消除细菌[11].等离子体可以深入细菌生物膜内部,并杀死它们(图3(p)~(r)),CAP可以通过等离子体物理化学作用的结合,在数分钟内灭活广谱感染性微生物而不引起皮肤过敏反应,这会在很大程度上抑制因使用常规抗菌剂导致的耐多药细菌的快速繁殖[12-13].
基于MicroPlaSter α和β设备(结构与图2(c)相似)的临床试验表明,对14例患者的慢性伤口进行70次等离子体治疗可显著降低细菌数量,并且治疗过程没有副作用且耐受性良好[43].等离子体使细菌失活的机制包括:细菌存活但不可培养的状态(viablebutnon-culturablestate,简称VBNC);脂质、蛋白质和DNA的过氧化损伤;细菌程序性细胞死亡;CAP产生的RONS可以穿透mm范围内的伤口组织(图5(h))[52].等离子体的高灭菌效率减少了细菌消耗的氧气,同时增加了提供给细胞外基质(extracellular matrix,简称ECM)和不断增长的血管的氧气.然而,NO对伤口愈合的贡献是有限的,因为等离子体提供的NO含量低于通过伤口液中扩散所需的NO[52-53].另一方面,巨噬细胞影响了损伤后肌成纤维细胞的数量和ECM的沉积[54],因此需要进一步研究.
CAP与内皮细胞、成纤维细胞、角质形成细胞和免疫细胞等细胞之间的相互作用是影响伤口愈合和组织再生的重要因素之一.用MicroPlaSter β处理的人成纤维细胞进行的体外细胞培养研究表明,CAP处理会诱导利于伤口愈合反应的关键基因的表达,例如IL-6,IL-8,MCP-1,TGF-β1,TGF-β2,并促进I型胶原和α-SMA的产生[12].划痕伤口愈合试验显示出细胞迁移得到改善.CAP也可以改善伤口部位的血管化,CAP增加了内皮细胞数量、迁移距离和血管形成,这归因于等离子体产生的ROS诱导的成纤维细胞生长因子2(FGF-2)释放[55].CAP可显著增加组织氧饱和度、毛细血管后静脉充盈压力和营养供应,从而促进伤口愈合[56].
近期,在26例患者的3项观察研究中测试了KINPen MED对慢性伤口治疗的疗效[57].Octenisept是慢性伤口处理中最具生物相容性和最有效的防腐剂之一,被用来与KINPen进行疗效比较.在2周的治疗期内,每周有16例慢性腿溃疡患者接受3次等离子体治疗.等离子体处理使伤口表面减少了56%,而Octenisept组仅减少了19%,这表明等离子体在伤口愈合中具有促进作用.在另一项研究中,等离子体治疗的疗效仍优于使用Octenisept或涉及两种治疗方案的联合治疗.另外,用共聚焦激光扫描显微镜观察等离子体处理的伤口,观察到伤口愈合初期的增生,这也表明炎症期缩短[58].
3.2 CAP对银屑病的影响
银屑病是一种免疫介导的复发性疾病,主要影响皮肤和关节.到目前为止,还没有有效的治疗方法可以治愈或完全控制该疾病.银屑病皮损的主要病理特征是表皮角质形成细胞的终末分化和过度增殖、明显的炎症浸润和病理性血管生成.
CAP处理可改善咪喹莫特(IMQ)诱发的小鼠模型中的银屑病样皮炎和增生[50].与对照组相比,用IMQ处理的小鼠的背部皮肤在3 d后出现红斑、结垢和增厚的迹象,并且这些病变可通过延长IMQ给药逐渐加重[12,50].CAP治疗组的小鼠每天接受CAP治疗,治疗方式为每2 min处理后停顿1 min,连续处理2次,这组小鼠没有观察到明显的皮肤损伤.CAP显著减少了IMQ + CAP组小鼠的整体皮肤病变,包括鳞片缩小、红斑减少和增厚减少.对照组银屑病面积和严重程度指数(psoriasis area and severity index,简称PASI)得分无明显变化,IMQ+CAP组小鼠的PASI得分低于IMQ组.苏木精-伊红染色法 ( hematoxylin-eosin staining,简称HE染色法)进行组织病理学分析,结果表明通过CAP治疗可以改善表皮增生、棘皮症和IMQ引起的角化不全症状[50].
下面对银屑病患者的CAP和常规治疗进行进一步的比较.对6个银屑病患者的3个斑块进行3组治疗(A组:CAP,盐水浴(BB)+ 5%水杨酸软膏(SAO); B组:BB + SAO; C组:BB,UV辐照,SAO +蒽林(dithranol))[42].结果显示A和C组的渗透和发红减少,C组的鳞屑减少,说明CAP暂时减少了皮肤病灶上的细菌定殖.尽管在这种情况下用CAP治疗银屑病斑块没有显示出比常规治疗明显的优势,但是通过增加放电功率或在工作气体中添加O2/H2O来提高RONS的浓度可以改善CAP的治疗效果[51].
CAP对银屑病的作用主要集中在两个方面(图6(c)):首先,等离子体穿孔产生了穿过角质层的转运通道(图4),从而增强了RONS的透皮递送.通过皮肤屏障后,这些RONS可以抑制过度增殖,诱导病变表皮细胞凋亡,从而清除斑块.细胞培养实验表明,长期的CAP处理可以诱导HaCaT角质形成细胞的细胞周期停滞和凋亡[59].E-cadherin和表皮生长因子受体(EGFR)等表面分子的表达也被下调,从而减少了刺激性和增殖性[60].其次,CAP产生的RONS具有免疫调节特性.例如,ROS改善了小鼠模型中咪喹莫特诱导的银屑病并增强了调节性T细胞功能.此外,等离子体中高水平的外源NO具有抗增殖作用,并且在慢性炎症过程的控制中起着重要作用[61].总体而言,这些初步研究显示CAP在银屑病治疗中具有良好的潜力.
等离子体与其他治疗方式相结合也为皮肤病治疗提供了一条新路径.尤其是利用等离子体处理皮肤产生大量的可恢复孔,然后马上使用常规药物处理,这样就能有效提高药物的透皮输运,从而大幅增强治疗效果.
4 结 论
CAP在皮肤病学中的应用基于物理、化学、生物和工程科学的知识、方法和技术,是一个非常令人兴奋的多学科研究领域.该综述介绍了CAP的产生、运输和治疗效果.迄今为止取得的进展令人兴奋,期望在不久的将来可以更好地了解等离子体对皮肤疾病治疗的整个过程.由于电气工程和材料科学的进步,CAP源的可靠性、经济性和安全性不断提高.CAP和生物学对象之间相互作用的实验和数值诊断方面的改进为等离子体医学的进一步发展提供了重要的理论基础.CAP在皮肤病学中的应用现已被公认为是等离子体医学中最成熟的领域之一,目前许多结果已转化为临床应用,例如慢性伤口和常见的皮肤病治疗.
许多近期的工作表明,CAP和纳米粒子技术等的综合作用可能会产生全新的疾病治疗方式,全球多个研究小组都取得了进展.因此,基于CAP的设备具有极好的前景,最终将成为在生物医学领域被广泛接受的普通工业和消费产品.接下来科研人员的共同努力有望进一步扩大等离子体应用的范围.
