基于血清药物化学的花椒温中止痛的质量标志物研究
2022-05-06张萌萌魏大能庞文强吴纯洁
张萌萌,王 丹,魏大能,叶 洵,何 林,庞文强,彭 伟,吴纯洁
基于血清药物化学的花椒温中止痛的质量标志物研究
张萌萌,王 丹,魏大能,叶 洵,何 林,庞文强,彭 伟*,吴纯洁*
成都中医药大学药学院,四川 成都 611137
基于中药质量标志物(quality marker,Q-Marker)概念,在验证花椒温中止痛功效的基础上,分析花椒提取物在正常大鼠及模型大鼠的血中移行成分。采用ig冰水结合冰浴方式建立寒邪犯胃型胃脘痛大鼠模型,并连续ig花椒提取物2周,观察大鼠一般情况,并对全血血细胞计数、脏器指数和胃组织病理变化进行检测。应用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱对对照组、模型组、空白给药组、花椒高剂量组大鼠的血清样本数据进行采集,通过主成分分析和正交偏最小二乘判别法分析花椒温中止痛的潜在物质基础。通过PharmMapper反向对接筛选入血成分的作用靶点,并进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析;构建成分-靶点-通路网络图;应用分子对接技术对主要作用通路进行验证。与模型组比较,花椒组大鼠耳廓颜色明显变红,全血白细胞、淋巴细胞及单核巨噬细胞计数明显升高(<0.05),胸腺指数明显增加(<0.01);胃组织局部坏死脱落和变性细胞减少。从空白给药组、花椒高剂量组大鼠血清中共鉴定出7个入血成分,其中4个为原型成分(羟基-α-山椒素、羟基-β-山椒素、羟基-ε-山椒素、二羟基-α-山椒素),3个为代谢产物;其中二羟基-α-山椒素仅存在于花椒高剂量组大鼠血清。花椒入血成分可以通过氢键等形式与过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPAR)信号通路、Th17细胞分化相关的靶点蛋白[脂肪酸结合蛋白3(fatty acid binding protein 3,FABP3)、视黄醇类X受体β(retinoid X receptor beta,RXRB)、FABP7、Janus激酶3(Janus kinase 3,JAK3)]良好结合。花椒可能是通过PPAR、Th17细胞分化信号通路调节免疫系统发挥温中止痛功效;羟基山椒素类化合物可作为花椒温中止痛功效的潜在Q-Marker进行深入研究。
花椒;温中止痛;血清药物化学;质量标志物;羟基-α-山椒素;羟基-β-山椒素;羟基-ε-山椒素;二羟基-α-山椒素
花椒为芸香科花椒属植物花椒Maxim.或青椒Sieb.et Zucc.的干燥成熟果皮,是重要的中药材和调味品,以四川汉源、甘肃武都、陕西韩城等为主要产区[1-2]。花椒富含丰富的化学成分,主要包括酰胺类、萜类、黄酮、香豆素、木脂素和脂肪酸等[3-5]。东汉时期,花椒就已广泛用于治疗脘腹冷痛、呕吐泄泻等症。张仲景《金匮要略》记载的大建中汤方(《古代经典名方目录》(第一批)),是以蜀椒为君药的温里剂,具有温中补虚、降逆止痛的功效,主治心胸中大寒痛、呕不能饮食、腹中寒等症[6]。王为群等[7]从本草文献中筛选治疗胃脘痛的有效方药,发现花椒等温里药是治疗胃脘痛的常用方药。黄燕琼等[8]、秦华珍等[9]研究发现花椒等温中散寒药可以通过改善大鼠胃黏膜及血流变等发挥治疗胃实寒证的药效。尽管花椒温中止痛功效有一定研究,但仍多集中在理论探讨方面,并未见对功效相关的物质基础进行深入研究。
中药质量标志物(quality marker,Q-Marker)是中药质量控制的新概念,有效性是Q-Marker的核心要素[10]。中药血清药物化学依据中药经口给药的特点,通过分析给药后进入血液的化学成分及其代谢产物,从血中移行成分的角度,研究中药功效相关物质基础[11]。正常及病理状态下动物对同一种中药或提取物的吸收存在较为明显的差异[12],因此,有必要对花椒在正常及病理状态下的血清药物化学进行同步分析。本研究通过建立寒邪犯胃型胃脘痛大鼠模型,对花椒传统功效温中止痛进行验证;采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(ultra performance liquid chromatography-quadrupole/ orbitrap high resolution mass spectrometry,UPLC-Q-Exactive Orbitrap MS)技术,结合多元统计分析,对正常大鼠和模型大鼠给予花椒的含药血清进行分析,分析并鉴定正常和病理状态下血中移行成分。
1 材料
1.1 仪器
VanquishTM超高效液相色谱仪、Q-Exactive Orbitrap高分辨质谱仪(美国Thermo Fisher Scientific公司);十万分之一电子天平(德国赛多利斯科学仪器有限公司);H1850R型台式离心机(湘仪离心机仪器有限公司);BC-6800型血液细胞分析仪(深圳迈瑞生物医疗电子有限公司)。
1.2 药品与试剂
花椒超临界提取物(批号2020072201)购自吉安中香天然植物有限公司;对照品羟基-α-山椒素(批号RP200528,质量分数>98%)、羟基-β-山椒素(批号RP201110,质量分数>99%)、羟基-ε-山椒素(批号RP201031,质量分数>99%)购自成都麦德生科技有限公司;附子理中丸(批号20011316,9 g/丸)购自北京同仁堂科技发展股份有限公司;色谱级甲醇、乙腈购自美国Merck公司。
1.3 动物
SPF级雄性Wistar大鼠,体质量(200±20)g,6~7周龄,购自北京斯贝福生物技术有限公司,动物许可证号SCXK(京)2019-0010。动物饲养于温度(25±2)℃、湿度50%~60%、12 h/12 h昼夜交替光照的环境中,自由进食饮水。动物实验经成都中医药大学实验动物伦理委员会批准(批准号2020-18)。
1.4 数据库及软件
PharmMapper数据库(http://www.lilab-ecust.cn/pharmmapper/);PubChem数据库(https:// pubchem.ncbi.nlm.nih.gov/);Metascape数据库(http://metascape.org/gp/index.html#/main/step1);UniProt数据库(https://www.uniprot.org/);RCSB PDB数据库(http://www.rcsb.org/);Cytoscape 3.9.0软件;Discovery Studio软件。
2 方法
2.1 供试药液的制备
精密称取适量花椒超临界提取物,加入0.1%泊洛沙姆188研磨均匀,少量多次加入0.5%羧甲基纤维素钠溶液(carboxymethylcellulose sodium,CMC-Na)配制成质量浓度分别为2.0、1.0、0.5 mg/mL的药液,4 ℃冰箱密闭储存备用。
取附子理中丸适量,加入0.5% CMC-Na溶液(含0.1%泊洛沙姆)研磨均匀,配制成质量浓度为100 mg/mL的药液,4 ℃冰箱密闭储存备用。
2.2 动物分组与给药
大鼠适应性喂养1周后,随机分为对照组(0.5% CMC-Na溶液)、空白给药组(花椒溶液20 mg/kg)、模型组(0.5% CMC-Na溶液)、附子理中丸组(附子理中丸溶液1 g/kg)和花椒低、中、高剂量组(花椒溶液5、10、20 mg/kg),每组6只。各给药组ig相应药物(10 mL/kg),1次/d,连续2周。
2.3 动物模型的制备
参考文献方法[13],造模同时给药。除对照组和空白给药组外,其余大鼠ig 0 ℃冰水(20 mL/kg),2次/d(分别为9: 00时和21: 00时),并增加10 ℃凉水泡浴(13: 00时),1次/d,15 min/次,连续2周,制备寒邪犯胃型胃脘痛模型。
2.4 动物标本采集及处理
末次造模及给药结束后,全部大鼠禁食不禁水18 h。次日,对照组、空白给药组、模型组、花椒高剂量组大鼠ig相应药物,给药结束后0.5、1.0、2.0、4.0 h分别于颈静脉取血0.2 mL,静置2 h,3000 r/min离心15 min,取上层血清50 μL,合并各大鼠4个时间点血清,每组各得6个血清样本,于−80 ℃保存备用。
采血结束后,所有大鼠ip 3%戊巴比妥钠溶液麻醉,用一次性EDTAK2负压管于腹主动脉取血,用于血细胞计数检测;解剖大鼠,结扎胃贲门和幽门,将胃组织完整取下,沿胃大弯剖开,用生理盐水漂洗,置于4%多聚甲醛固定,进行苏木素-伊红(HE)染色,于显微镜下观察大鼠胃组织病理变化;取胸腺、脾脏称定质量,计算脏器指数。
2.5 大鼠血清样品的制备
取血清样品,解冻,加入3倍量沉淀剂[乙腈-醋酸乙酯(2∶3)]涡旋混合3 min,4 ℃静置60 min沉淀蛋白,取出,涡旋1 min,超声5 min,4 ℃、12 000 r/min离心10 min,吸取上清液,37 ℃氮气吹干,加入200 μL乙腈复溶,进行UPLC-Q-Extractive-Orbitrap MS分析。
2.6 UPLC-Q-Exactive Orbitrap MS检测条件
Thermo Fisher Scientific Accucore C18色谱柱(100 mm×2.1 mm,2.6 μm),流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈(B),梯度洗脱:0~15 min,88%~62% A;15~20 min,62%~55% A;20~35 min,55%~34% A;35~50 min,34%~2% A;50~60 min,2% A;体积流量为0.3 mL/min;进样量为10 μL;柱温为30 ℃。
采用正离子模式采集,热喷雾离子源(HESI),喷雾电压为+3500 V;毛细管温度为320 ℃;鞘气流速35 arb;辅助气流速10 arb;采集范围100~1000。
2.7 数据分析
将对照组、空白给药组、模型组、花椒高剂量组的原始质谱数据导入Compound Discoverer 3.0软件中,导入目标成分,建立代谢产物预测流程,分析各成分代谢途径及代谢产物,并结合目标成分的相对分子质量、二级碎片离子等进行鉴定。通过主成分分析(principal component analysis,PCA)和偏最小二乘分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)等多元统计比较组间差异,并筛选VIP>1.0且<0.05的成分。
2.8 花椒入血成分作用靶点筛选及验证
以代表性入血成分为研究对象,采用PharmMapper反向对接筛选各成分的作用靶点。通过PubChem数据库检索成分英文名,获取并下载2D结构的sdf文件,将其导入PharmMapper数据库,预测可能匹配和对接的体内药物靶标。选取分子-靶点匹配度(fit Score)≥3的药物靶点作为潜在作用靶标[14],通过UniProt数据库校正靶点名称。通过Metascape数据库对标准化的靶点进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
应用分子对接技术对KEGG通路进行验证。将RCSB PDB数据库下载的蛋白靶点及入血成分mol格式导入Discovery studio 4.5软件,利用LibDock模块进行分子对接,以LibDock Score值作为评价指标。
2.9 数据处理
3 结果
3.1 花椒提取物对寒邪犯胃型胃脘痛大鼠一般情况的影响
造模过程中,模型组大鼠出现明显寒相,症见大鼠蜷缩、扎堆、耳廓颜色淡红无华,甚至苍白;经花椒提取物或附子理中丸干预后,大鼠状态明显改善,耳廓颜色变红。各组大鼠代表性耳廓颜色见图1-A。
3.2 花椒提取物对寒邪犯胃型胃脘痛大鼠胃组织病理及脏器指数的影响
如图1-B所示,对照组大鼠胃组织黏膜层、黏膜下层、肌层和浆膜层组织结构完整,细胞结构清晰,细胞排列整齐;模型组大鼠胃黏膜上皮细胞见局部坏死脱落和细胞变性,固有膜内局部见少量嗜酸性粒细胞;花椒高、中剂量组及附子理中丸组大鼠的胃组织病理状态较模型组有明显改善,仅见少量细胞核变大;花椒低剂量组仍有胃黏膜层上皮细胞坏死脱落现象。
如图1-C所示,与对照组比较,模型组大鼠胸腺指数明显降低(<0.01),表明造模后大鼠免疫器官受到一定影响;与模型组比较,各给药组大鼠胸腺指数均显著增加(<0.01),基本趋近正常组。各组大鼠脾脏指数没有明显差异。
3.3 花椒提取物对寒邪犯胃型胃脘痛大鼠全血血细胞的影响
各组大鼠全血血细胞分析结果见表1。与对照组比较,模型组大鼠全血白细胞、淋巴细胞、中性粒细胞、单核巨噬细胞及嗜碱性粒细胞计数均明显降低(<0.05、0.01);与模型组比较,附子理中丸组和花椒中、高剂量组大鼠白细胞、淋巴细胞和单核巨噬细胞计数明显升高(<0.05、0.01),附子理中丸组中性粒细胞明显升高(<0.05)。花椒低剂量组各血细胞计数均无显著差异。
3.4 生物样本色谱图的建立与分析
对照组、空白给药组、模型组及花椒高剂量组的大鼠血清样本检测发现各成分及代谢物在60 min内得到较好的分离,各组血清样本的正离子模式下的总离子流图见图2。结果显示,血清中的内源性物质响应值非常高,对花椒的入血成分的鉴定存在干扰,故考虑采用多元统计分析,即PCA结合OPLS-DA分析辨识花椒的血中移行成分。
3.5 多元统计分析
PCA结果(图3-A)表明,在正离子模式下,对照组、空白给药组、模型组及花椒高剂量组大鼠血清轮廓均有一定的分离趋势,说明各组样本之间存在差异。在明确了组间差异的基础上,进一步采用OPLS-DA筛选组间差异成分及代谢产物,如图3-B所示,对照组与空白给药组、模型组与花椒高剂量组大鼠血清样本被分成2个离散群,表现出良好的组间差异。OPLS-DA模型的2>0.989,2>0.904,表明所建立的统计模型具有良好的解释能力和预测能力。

与对照组比较:**P<0.01;与模型组比较:##P<0.01
表1 花椒提取物对寒邪犯胃型胃脘痛大鼠全血血细胞的影响(, n = 6)
Table 1 Effect of Zanthoxyli Pericarpium on whole blood cells of rats with epigastric pain caused by cold evil invading (, n = 6)
组别剂量/(mg·kg−1)数目/(1×109个·L−1) 全血白细胞淋巴细胞中性粒细胞单核巨噬细胞嗜碱性粒细胞 对照—11.96±3.838.59±2.142.78±1.220.56±0.220.032±0.008 模型—4.44±1.68**3.06±1.13**1.00±0.23**0.17±0.05**0.014±0.005* 附子理中丸100010.11±4.59##9.12±4.67##1.83±0.44#0.39±0.13##0.024±0.014 花椒57.67±0.616.25±1.241.67±0.430.29±0.060.014±0.011 108.75±2.42#7.01±0.89#1.75±0.410.38±0.12#0.024±0.009 209.31±2.94#6.94±2.72#1.55±0.380.33±0.06#0.014±0.011
与对照组比较:*<0.05**<0.01;与模型组比较:#<0.05##<0.01
*< 0.05**< 0.01control group;#< 0.05##< 0.01model group
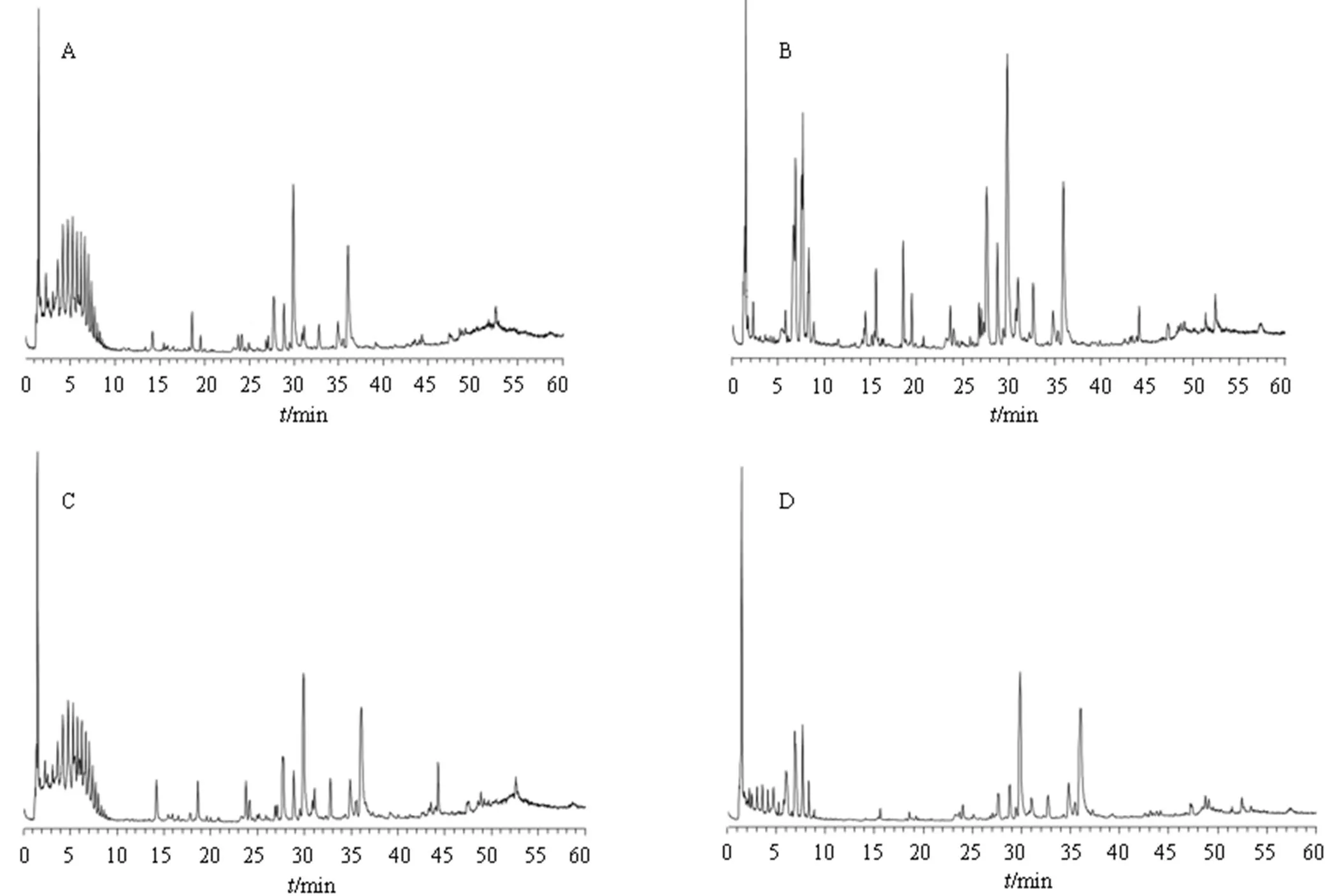
图2 正离子模式下对照组 (A)、空白给药组 (B)、模型组 (C) 及花椒高剂量组 (D)大鼠的代表性血清样品总离子流图

图3 正离子模式下各组大鼠血清轮廓的PCA (A)及OPLS-DA (B)图
3.6 原型成分的鉴定
本课题组前期采用UPLC-Q-Extractive-Orbitrap MS技术,通过对照品及文献报道,对花椒提取物进行成分分析,共鉴定出19个化学成分,主要包括羟基山椒素、花椒素等不饱和脂肪酸酰胺。在花椒血清药物化学研究中,根据对照品及各化学成分的保留时间(R)、精确相对分子质量和二级质谱信息,共检测出4个原型成分,详细信息见表2,各化合物相对丰度见图4。花椒高剂量组中羟基-α-山椒素、羟基-α-山椒素和羟基-β-山椒素氧化产物的相对丰度均高于空白给药组,而羟基-ε-山椒素、羟基-β-山椒素和羟基-γ-山椒素的代谢产物相对丰度较低;空白给药组仅有2个样本检测到二羟基-α-山椒素。
化合物H1:正离子模式扫描下,R为16.86 min,检测到准分子离子峰为302.171 8 [M+Na]+,计算化合物分子式为C16H25NO3。在二级质谱图中,母离子连续丢失1分子H2O(18)、C5H9O2N(115)、C3H4(40)、C2H4(28),分别形成碎片离子262.180 1、147.116 3、107.085 5、79.054 6。结合相关参考文献[15],鉴定化合物H1为二羟基-α-山椒素。
化合物H3:正离子模式扫描下,R为19.34 min,检测到准分子离子峰为264.195 3 [M+H]+,计算化合物分子式为C16H25NO2。在二级质谱图中,母离子连续丢失1分子H2O(18)和1分子C5H9NO(99),分别形成碎片离子246.184 4、147.116 3;在碎片离子147.116 3基础上,分别丢失1分子C3H4(40)、1分子C5H8(68),形成碎片离子107.085 5、79.054 6。通过对照品比对及查询相关参考文献[15],鉴定化合物H3为羟基-α-山椒素,其二级质谱图及其可能裂解途径见图5。
表2 花椒的入血成分及代谢产物的鉴定
Table 2 Identification of components and metabolites of Zanthoxyli Pericarpium absorbed in serum
编号tR/min化合物名称m/z质量偏差加和离子分子式 实测值理论值 HM111.79羟基-α-山椒素的氧化产物280.189 9280.190 7−2.86[M+H]+C16H25NO3 HM213.07羟基-β-山椒素的氧化产物280.190 1280.190 7−2.14[M+H]+C16H25NO3 H116.86二羟基-α-山椒素302.171 8302.172 6−2.65[M+Na]+C16H25NO3 H218.88羟基-ε-山椒素*264.195 8264.195 70.38[M+H]+C16H25NO2 H319.34羟基-α-山椒素*264.195 3264.195 8−2.65[M+H]+C16H25NO2 H419.81羟基-β-山椒素*264.195 1264.195 8−2.65[M+H]+C16H25NO2 HM323.57羟基-γ-山椒素的甲基化和乙酰化产物346.330 4346.331 5−3.17[M+H]+C20H43NO3
*经过对照品比对鉴定
*identified by comparison with reference substances

图4 各组大鼠血中移行成分的相对丰度
化合物H2、H4:正离子模式扫描下,R分别为18.88、19.81 min,检测到准分子离子峰为264.195 8、264.195 1 [M+H]+,计算化合物分子式为C16H25NO2,其一级和二级质谱信息与化合物H3基本相同。通过对照品比对及查询相关参考文献[16],推测化合物H2、H4分别为羟基-α-山椒素的同分异构体羟基-ε-山椒素、羟基-β-山椒素。
3.7 代谢产物的鉴定
通过软件分析并参考原型成分二级质谱信息,进一步鉴定羟基-α-山椒素、羟基-β-山椒素和羟基-γ-山椒素的代谢产物,代谢途径主要包括氧化、甲基化、乙酰化反应等,详细信息见表2,化合物相对丰度值见图4。
化合物HM1、HM2:正离子模式扫描下,R分别为11.79、13.07 min,检测到准分子离子峰为280.189 9、280.190 1 [M+H]+,计算分子式为C16H25NO3,与化合物H3和H4相差16(O),并且出现了化合物H3和H4的特征碎片离子147.116 3、79.054 6、67.054 7,结合R,推断HM1、HM2分别为羟基-α-山椒素的氧化产物和羟基-β-山椒素的氧化产物。
化合物HM3:正离子模式扫描下,R为23.57 min,检测到准分子离子峰346.330 4 [M+H]+,计算化合物分子式为C20H43NO3。在二级质谱图中,母离子连续丢掉1分子CH2(14)与C2H2O(42),形成二级碎片离子290.210 7。还检测到羟基-γ-山椒素的特征碎片离子57.070 4,推测HM3为羟基-γ-山椒素的甲基化和乙酰化产物。
3.8 花椒入血成分潜在靶点的通路注释及分子对接验证
通过PharmMapper反向对接,各入血成分羟基-α-山椒素、羟基-β-山椒素、羟基-ε-山椒素分别匹配到83、93、65个作用靶点。成分-靶点-通路网络图结果(图6-A)显示,各成分作用靶点主要富集在肿瘤通路、过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPAR)信号通路、Th17细胞分化等信号通路,提示花椒温中止痛功效与免疫系统调节有关,与本实验结果互为验证。
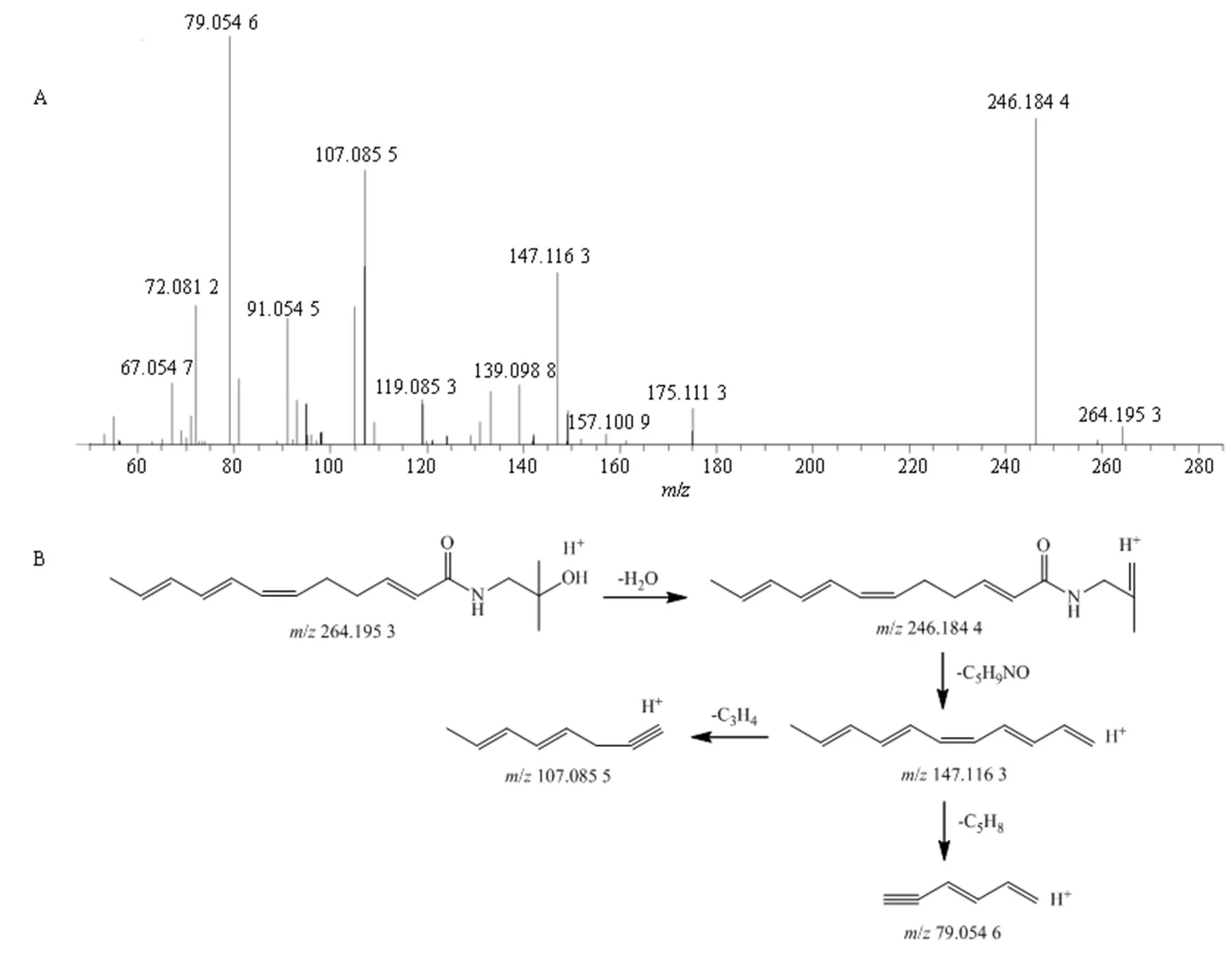
图5 羟基-α-山椒素的二级质谱图(A) 以及可能的裂解途径(B)

图6 成分-靶点-通路网络图 (A)及成分-靶点结合模式图 (B)
选取共同调控Th17细胞分化与PPAR信号通路的作用靶点进行通路验证:丝裂原激活蛋白激酶14(mitogen-activated protein kinase 14,MAPK14,PDB ID 7BDO)、白细胞介素-2(interleukin-2,IL-2,PDB ID 4ZF7)、JAK激酶3(Janus kinase 3,JAK3,PDB ID 6GLB)、脂肪酸结合蛋白3(fatty acid binding protein 3,FABP3,PDB ID 6AQ1)、FABP6(PDB ID 518O)、FABP7(PDB ID 7E25)、视黄酸X受体β(retinoid X receptor beta,RXRB,PDB ID 7A78)。以原配体与蛋白靶点得分为阈值,3个原型成分与FABP3、RXRB、FABP7、JAK3对接的LibDock score值基本一致,分别为87.94、111.87、100.47、103.65,且均高于原配体或与原配体差异不大(83.37、102.20、87.39、103.87)。以羟基-α-山椒素与FABP3、FABP7蛋白靶点对接为例(图6-B),活性成分与靶点蛋白的氨基酸残基主要通过氢键、碳氢键结合。
4 讨论
胃脘痛是以上腹胃脘部近心窝处发生疼痛为主症,多伴脘腹痞满、嗳腐吞酸、不思饮食等症状的一种常见病证,温胃散寒、理气止痛是基本治法之一[17]。寒邪犯胃型胃脘痛多因过食生冷或寒邪直中,损伤脾胃,脾失健运所致,故常见形寒肢冷、毛发枯槁等症,故本研究采用ig冰水结合冰浴法复制大鼠寒邪犯胃型胃脘痛动物模型,发现大鼠多表现出明显寒相,表明大鼠的免疫系统等功能受到明显影响,因此进一步对大鼠全血血细胞计数及免疫器官指数进行检测。结果显示,花椒提取物对大鼠白细胞、淋巴细胞、单核巨噬细胞等血细胞计数及胸腺指数有明显提高作用,表明花椒可以通过调节免疫系统发挥温中止痛功效。
在血清样品处理中考察了沉淀剂乙腈和醋酸乙酯的比例,乙腈-醋酸乙酯(2∶3)为沉淀剂时,化合物丰度相对较高,故本实验使用乙腈-醋酸乙酯(2∶3)沉淀蛋白。考虑到各成分在体内的吸收、消除过程并不一致,为检测到更多的入血成分,将多时间点的血清样品混合后进行进样检测[18]。空白给药组和花椒高剂量组大鼠血清中有6个相同的特征峰,其中包括3个原型吸收成分和3个代谢产物,主要为酰胺类成分,且多数化学成分在病理状态下的入血相对量高于正常组,羟基-ε-山椒素、羟基-β-山椒素和羟基-γ-山椒素的代谢产物相对丰度较低,这也说明正常和病理状态下,动物对于药物的吸收可能存在明显的差异,药物代谢的速率和程度也可能不同[19],但入血成分的含量变化还需对其进行定量分析才能说明。网络药理学及分子对接技术结果表明,山椒素成分可以和PPAR信号通路、Th17细胞分化等免疫系统相关的通路靶点蛋白良好结合,这也说明山椒素可以通过调节免疫系统发挥温中止痛功效。本研究鉴定出的成分都是花椒中含量比较高的成分,也是主要的风味成分,这可能是花椒温中止痛功效的潜在活性成分,为Q-Marker的研究提供科学基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S].一部.2020: 166.
[2] 王丽华, 赵卫红, 彭晓曦, 等.四川花椒产业发展现状及对策分析研究 [J].四川林业科技, 2018, 39(2): 50-55.
[3] Zhang M M, Wang J L, Zhu L,.Maxim.(Rutaceae): A systematic review of its traditional uses, botany, phytochemistry, pharmacology, pharmacokinetics, and toxicology [J]., 2017, 18(10): E2172.
[4] Ji Y, Li S M, Ho C T.Chemical composition, sensory properties and application of Sichuan pepper (genus) [J]., 2019, 8(2): 115-125.
[5] 李春丽, 孟宪华, 尚贤毅, 等.花椒化学成分及其抗氧化活性[J].中草药, 2021, 52(10): 2869-2875.
[6] 沈桢巍, 雷撼, 高鹏飞.日本汉方大建中汤在消化道外科领域的基础与临床研究进展 [J].世界中西医结合杂志, 2011, 6(3): 261-264.
[7] 王为群, 程茜, 薛博瑜.胃脘痛方药的整理分析 [J].南京中医药大学学报, 2010, 26(6): 418-420.
[8] 黄燕琼, 刘颖, 秦华珍, 等.10味温中散寒药对胃实寒证大鼠胃黏膜组织病理学的影响 [J].中国实验方剂学杂志, 2014, 20(2): 105-108.
[9] 秦华珍, 刘颖, 柳俊辉, 等.10味温中散寒药对胃实寒证大鼠血液流变学的影响 [J].中华中医药学刊, 2014, 32(2): 237-239.
[10] 刘昌孝, 陈士林, 肖小河, 等.中药质量标志物(Q-Marker):中药产品质量控制的新概念[J] 中草药, 2016, 47(9): 1443-1457.
[11] 张灵娜, 林兵, 宋洪涛.中药血清药理学、血清药物化学的研究概况及展望 [J].中草药, 2015, 46(17): 2662-2666.
[12] 董婉茹, 丁雅光, 荆雷, 等.病理及生理状态下的栀子血清药物化学对比研究 [J].中草药, 2011, 42(11): 2270-2274.
[13] 杨万斌, 文彬, 张凌杭, 等.大鼠胃寒证模型造模方法探索 [J].中国中药杂志, 2015, 40(20): 4031-4036.
[14] 王伟, 刘星雨, 尚云龙, 等.基于血清药物化学与网络药理学探究麝香通心滴丸治疗冠心病的机制 [J].中成药, 2020, 42(10): 2768-2777.
[15] Sun X X, Zhang D, Zhao L,.Antagonistic interaction of phenols and alkaloids in Sichuan pepper () pericarp [J]., 2020, 152: 112551.
[16] Li W L, Wu Y, Liu Y S,.Chemical profiles and screening of potential α-glucosidase inhibitors from Sichuan pepper using ultra-filtration combined with UHPLC-Q-TOF [J]., 2020, 143: 111874.
[17] 张声生, 周强.胃脘痛中医诊疗专家共识意见(2017) [J].中医杂志, 2017, 58(13): 1166-1170.
[18] 刘建庭, 仉瑜, 卜睿臻, 等.基于UPLC-Q/TOF-MS的痹祺胶囊化学物质组及入血成分的研究[J].中草药, 2021, 52(18): 5496-5513.
[19] Liu P, Li W, Li Z H,.Comparisons of pharmacokinetic and tissue distribution profile of four major bioactive components after oral administration of Xiang-Fu-Si-Wu Decoction effective fraction in normal and dysmenorrheal symptom rats [J]., 2014, 154(3): 696-703.
Study on quality markers ofon warming middle-energizer to alleviate pain based on serum medicinal chemistry
ZHANG Meng-meng, WANG Dan, WEI Da-neng, YE Xun, HE Lin, PANG Wen-qiang, PENG Wei, WU Chun-jie
School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
Based on concept of quality marker (Q-Marker) of traditional Chinese medicine, middle-warming and pain- alleviating efficacy of Huajiao () was verified, and then the migration components of its in blood of normal rats and model rats were analyzed.Rat model of epigastric pain caused by cold pathogens invading the stomach was established by ig ice water combined with ice bath, andextract was ig for 2 weeks.Pathological changes were detected, including rats in general, whole blood count, organ index and gastric tissue.UPLC-Q-Extractive-Orbitrap MS was used to collect the data of serum samples in control group, model group, blank administration group, andhigh-dose group.Principal component and orthogonal partial least squares discriminant method were employed to analyze the potential effective compound ofon effect of middle-warming and analgesic efficacy.Furthermore, protein target of component in blood was screened by reverse docking with PharmMapper, and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis was performed; Component-target-pathway network was constructed; Molecular docking was applied to verify the main pathway.Compared with model group, auricles color of rats ingroup was obviously reddened, and counts of leukocytes, lymphocytes and mononuclear macrophages in blood were significantly increased (< 0.05), and thymus index was increased (< 0.01).Local necrotic exfoliation and cellular denaturation of gastric tissue were reduced.Seven components were identified from serum of rats in blank administration group andhigh-dose group, among which four were prototype components (hydroxy-α-sanshool, hydroxy-β-sanshool, hydroxy-ε-sanshool, dihydroxy-α-sanshool), three of which were metabolites; Among them, dihydroxy-α-sanshool was only present in serum of rats inhigh-dose group.The blood components ofcould bind well to peroxisome proliferator activated receptor (PPAR) signaling pathway and Th17 cell differentiation-related target proteins of fatty acid binding protein 3 (FABP3), retinoid X receptor β (RXRB), FABP7, Janus kinase 3 (JAK3) through hydrogen bonds.may regulate the immune system through PPAR and Th17 cell differentiation signaling pathways to exert its middle-warming and pain-alleviating effect.Hydroxy-sanshool components can be used as Q-Marker for the effect offor in-depth research.
; warm middle-to alleviate pain; serum pharmacochemistry; quality markers; hydroxy-α-sanshool; hydroxy-β-sanshool; hydroxy-ε-sanshool; dihydroxy-α-sanshool
R285.5
A
0253 - 2670(2022)09 - 2731 - 09
10.7501/j.issn.0253-2670.2022.09.016
2021-12-22
四川省中医药管理局项目(2020HJZX001)
张萌萌,女,博士研究生,研究方向为中药炮制与制剂。E-mail: garita119@163.com
通信作者:吴纯洁,男,博士,研究员,研究方向为中药炮制与制剂。E-mail: wcj-one@263.net
彭 伟,男,博士,副教授,研究方向为中药炮制与制剂。E-mail: pengwei@cdutcm.edu.cn
[责任编辑 李亚楠]
