基于UPLC-Triple-TOF-MS和网络药理学快速建立郁金潜在中药质量标志物成分库
2022-05-06张宽永张巧艳蒙雄裕葛志伟严斌俊秦路平
张宽永,沈 燚,张 璐,张巧艳,蒙雄裕,葛志伟,严斌俊*,秦路平*
基于UPLC-Triple-TOF-MS和网络药理学快速建立郁金潜在中药质量标志物成分库
张宽永,沈 燚1,张 璐1,张巧艳1,蒙雄裕1,葛志伟2,严斌俊1*,秦路平1*
1.浙江中医药大学药学院,浙江杭州 310053 2.浙江大学农生环测中心,浙江杭州 310058
根据中药质量标志物(quality marker,Q-Marker)的理念,建立不同基源郁金的潜在Q-Marker库。采用超高效液相色谱-三重四极杆-飞行时间质谱联用(UPLC-Triple-TOF-MS)技术,建立郁金化学成分高分辨质谱数据库,通过网络药理学等方法构建“化学成分-靶点-通路”预测郁金潜在的Q-Marker。郁金药材中共鉴定出46个化学成分,其中共有成分12个。以共有成分为Q-Marker候选物进行网络药理学分析,预测姜黄酮、莪术双环烯酮、莪术二酮、莪术烯醇、莪术醇、二氢姜黄素、去甲氧基姜黄素和莪术呋喃二烯酮可作用于5羟色胺受体(HTR1A、HTR2A、HTR1D、HTR1B)、阿片受体(OPRK1、OPRM1、OPRD1、OPRL1)等靶点,通过调控神经活性配体-受体相互作用、血清素能突触、钙信号通路、cAMP信号通路、逆行内源性大麻素信号等重要通路发挥抗抑郁的作用。通过UPLC-Triple-TOF-MS技术和网络药理学方法,可以快速分析和确定中药郁金的化学成分,建立郁金的潜在Q-Marker库。
郁金;质量标志物;网络药理学;姜黄酮;莪术双环烯酮;莪术二酮;莪术烯醇;莪术醇;二氢姜黄素;去甲氧基姜黄素;莪术呋喃二烯酮
郁金为姜科植物温郁金Y.H.Chen & C.Ling、姜黄L.、广西莪术S.G.Lee et C.F.Liang、蓬莪术Val.的干燥块根,具有活血止痛、行气解郁、清心凉血、利胆退黄的功效[1]。现代研究表明郁金主要含有挥发油类、姜黄素类和多糖类等成分[2],具有抗抑郁[3-4]、抗肿瘤[5-6]、抗炎[7]、促进消化[8-9]、保肝利胆[10]等药理作用。《中国药典》2020年版一部中收载了4种基原植物均可作为郁金临床药用,但并未收载关于郁金的含量测定方法。刘昌孝院士[11]于2016年首次提出了中药质量标志物(quality marker,Q-Marker)的新概念,用于完善药材的质量控制标准。因此找出郁金药材的Q-Marker成为现在郁金药材及相关制剂质控的迫切需求。
郁金是中医治疗抑郁症的常用药,李涛等[12]通过对70位从事中医药防治抑郁症当面的专家进行问卷统计发现郁金是中医临床治疗抑郁症最常用的9种中药之一。有文献报道郁金对不同抑郁症模型大、小鼠均有显著的抗抑郁作用[13-14],作为郁金同源的姜黄和莪术却未见抗抑郁的相关报道。经检索发现对4种郁金共同研究的报道较少,王雪梅等[15]通过气相质谱检测了4种郁金石油醚提取物中的成分差异。但郁金中的倍半萜类成分受热易分解,有文献报道莪术双环烯酮受热易发生重排[16],吉玛烷型倍半萜受热易发生环化反应[17]。故本实验拟采用超高效液相色谱-三重四极杆-飞行时间质谱联用(UPLC-Triple-TOF-MS)对不同基原郁金饮片的化学成分进行快速识别,系统分析4种基原郁金化学成分的异同,筛选出4种基原郁金共有化学成分作为标记化合物,通过网络药理学研究方法分析相关成分的作用靶点和作用机制,确定郁金潜在的Q-Marker,为郁金药材Q-Marker系统质控方法奠定基础。
1 材料
12批不同基原和产地的郁金饮片,经浙江中医药大学张巧艳教授鉴定为温郁金Y.H.Chen & C.Ling、姜黄L.、广西莪术S.G.Lee et C.F.Liang、蓬莪术Val.的干燥块根。具体批号和来源见表1。
表1 郁金样品来源信息
Table 1 Source information of Curcuma Radix samples
产地批号样品类型样品来源 浙江ZY0307温郁金浙江中医药大学饮片厂 ZY0207温郁金浙江中医药大学饮片厂 ZY1112温郁金浙江中医药大学饮片厂 广西GY0412广西莪术亳州中药材市场 GY0317广西莪术亳州中药材市场 GY1115广西莪术亳州中药材市场 四川CY0409蓬莪术亳州中药材市场 CY0503蓬莪术亳州中药材市场 CY1107蓬莪术亳州中药材市场 HY1011姜黄四川新荷花中药饮片厂 HY0421姜黄四川新荷花中药饮片厂 HY0722姜黄四川新荷花中药饮片厂
AcquityTMultra型高效液相色谱仪和Triple TOF 5600+型飞行时间质谱(Waters公司,美国);电喷雾离子源(AB SCIEX公司,美国);GL224-1SCN万分之一电子天平(赛多利斯仪器有限公司)。
对照品姜黄素(批号CFS201901)、双去甲氧基姜黄素(批号CFS201901)购自武汉天植生物科技有限公司,质量分数≥98%。莪术烯醇(批号201603,质量分数≥98%)购自青岛捷世康生物科技有限公司。莪术二酮(批号150610,质量分数>95%)、莪术醇(批号150129,质量分数>95%)、吉马酮(批号151027,,质量分数>98%)购自成都植标化纯生物技术有限公司。莪术酮(批号T13D7Z26820,质量分数≥98%)购自上海源叶生物科技有限公司。莪术呋喃二烯酮(批号160121,质量分数≥98%)购自四川维克奇生物技术公司。实验室从温郁金馏份中分离得到莪术双环烯酮,质量分数>98%(峰面积归一化法在254 nm波长处测定),其结构经1H-和13C-NMR(核磁共振谱)确证,并与文献数据进行了比较[18]。甲醇和乙腈(色谱纯,美国天地试剂公司)。
2 方法
2.1 供试品溶液的制备
取不同基原的郁金粉末各1 g, 精密称定,置于锥形瓶中精密加入甲醇15 mL,称定质量,超声处理30 min,取出,放冷后用甲醇补足质量,摇匀,滤过。取滤液在离心机中以10 000 r/min离心5 min,取上清液待用。
2.2 对照品溶液的制备
莪术双环烯酮、莪术烯醇、莪术二酮、莪术酮、莪术呋喃二烯酮、莪术醇、吉马酮、姜黄素和双去甲基姜黄素各对照品分别制成质量浓度为2780、346、458、2094、482、232、260、452和228 μg/mL的对照品甲醇溶液,于−20 ℃冰箱保存备用。实验前取上述对照品储备液各200 μL置于10 mL量瓶中,配成混合对照品溶液待用。
2.3 色谱条件和质谱条件
2.3.1 色谱条件 色谱柱为Waters ACQUITY UPLC HSS-C18柱(100 mm×2.1 mm,1.7 μm);以水溶液为流动相A,乙腈为流动相B,梯度洗脱,0~8 min,10%~41% B;8~10 min,41%B;10~16 min,41%~95%B;体积流量为0.4 mL/min;柱温为40 ℃;检测波长为214 nm;进样量2 µL。
2.3.2 质谱条件 UPLC-Triple-TOF 5600+飞行时间液质联用仪:正离子扫描模式;扫描范围/100~1500;雾化气(GS1):379 kPa;雾化气(GS2):379 kPa;气帘气(CUR):241 kpa;离子源温度(TEM):600 ℃;离子源电压(IS):5500 V;一级扫描:去簇电压(DP):100 V;聚焦电压(CE):10 V;二级扫描:使用TOF MS~Product Ion~IDA模式采集质谱数据,CID能量为20、40 eV,进样前,用CDS泵做质量轴校正,使质量轴误差小于2×10−6。
2.4 数据处理
根据国内外郁金及其近属植物的化学成分研究的相关文献和报道,借助Scifinder、Reaxys和Pubchem数据库整理出郁金化学成分数据库。利用液质联用仪采集4种郁金正离子下的总离子流图数据,使用Peakview1.2软件(Sciex公司,美国)对总离子进行提取。将数据库导入PeakView的XIC Manager模块中,通过XIC计算功能构建目标化合物的列表。方法参数设置如下:强度>500,信噪比(/)>10,同位素比率≤20%,质量误差≤1×10−5。进行计算后,符合数据库要求的化合物被提取并突出显示。根据分子离子峰和碎片离子峰的相对强度获得每种化合物的离子流质谱图。通过比较对照品或者文献信息,例如保留时间和质谱二级碎片离子,最终鉴定郁金提取物中的化合物。
2.5 网络药理学预测郁金化合物对抗抑郁的作用机制
2.5.1 成分-靶点-疾病网络构建 根据质谱化合物成分分析,选出标记化合物作为潜在的Q-Marker,通过Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)和Swiss Target Prediction数据库(http:// www.swisstargetprediction.ch/),获得化合物靶点(得分>0)。通过OMIM数据库(https://omim.org/)、Genecards数据库(https://www.genecards.org/)、TTD数据库(http://db.idrblab.net/ttd/)搜索“depression”,获得疾病靶点。最后将化合物-靶点信息导入Cytoscape 3.7.2软件得到化合物-疾病靶点网络图。
2.5.2 蛋白质相互作用(protein protein interaction,PPI)网络构建及核心靶点分析 将上述药物-疾病共同靶点输入STRING数据库(https://string- db.org/)进行检索,设置蛋白种类为“Homo sapiens”,最低相互作用阈值为0.4,构建PPI网络。
2.5.3 功能富集分析与通路分析 基于R软件使用Bioconductor生物信息软件包以值<0.05,值<0.05进行关键靶基因GO与KEGG功能富集分析。
3 结果与分析
3.1 UPLC-Triple-TOF-MS的采集
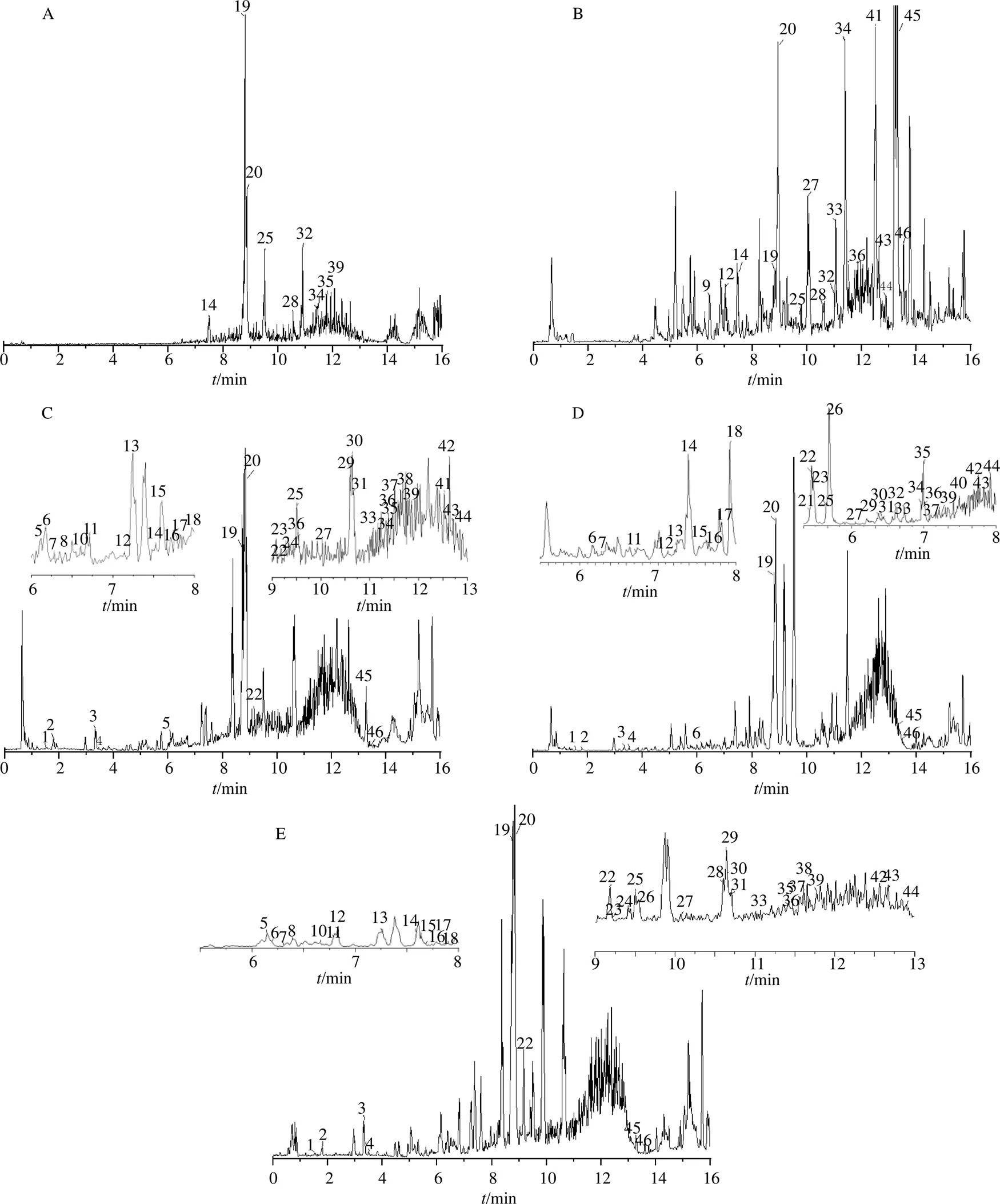
利用“2.3”项下建立的分析方法在正离子模式下采集的4种基原郁金饮片的总离子流图见图1。
3.2 化合物分析
根据总结郁金药材中的9个对照品质谱碎片离子和裂解规律等信息,分别鉴别出姜黄素类成分和10种结构类型的倍半萜类成分,见表2。共46中化合物,其中温郁金39种、广西莪术40种、蓬莪术40种、姜黄17种。
3.2.1 姜黄素类 4种基原郁金中鉴别出4种成分,化合物27、28、33、34,化合物27(R=10.08 min)在正离子模式下/371.1518 [M+H]+,质谱软件计算出精确分子式为C21H22O6,观察二级质谱离子碎片,主要离子碎片为177.054 4 [M+H-C11H13O3]+、145.028 6 [M+H-C11H13O3-CH3O]+、137.060 1 [M+H-C13H13O4]+,根据Scifinder和Reaxy数据库检索,鉴定化合物27为二氢姜黄素,推测其裂解途径见图2。化合物28、34通过对照品对比确定为双去甲氧基姜黄素和姜黄素。化合物33(R=11.08 min)在正离子模式下/339.123 4 [M+H]+,质谱软件计算出精确相对分子质量,确定分子式为C20H18O5,观察二级质谱离子碎片,主要离子碎片为/177.055 1 [M+H-C10H9O2]+,根据Scifinder和Reaxy数据库检索及文献报道[20],推测化合物33为去甲氧基姜黄素。
A-对照品 B-姜黄 C-广西莪术 D-温郁金 E-蓬莪术
3.2.2 倍半萜类 4种基原郁金中鉴别出愈创木烷型12个、桉烷型3个、檀香烷型2个、吉玛烷型8个、榄烷型3个、卡布达烷型4个,杜松烷型2个、没药烷型7个、拉松烷型1个、艾里莫酚烷型1个。
表2 郁金饮片化学成分分析
Table 2 Identification analysis of components of Curcuma Radix
编号tR/minm/z偏差(×10−6)二级离子(m/z)分子式化合物名称化合物分类理论值实测值 11.56281.138 35281.138 530.7 281.138 2, 245.118 4, 157.102 1, 107.050 4C15H20O5zedoalactone B[19]愈创木烷型 21.79283.154 00283.153 83−0.6 229.123 0, 201.125 6, 173.113 1, 145.100 4C15H22O5zedoarolide B[19]愈创木烷型 33.35267.159 09267.159 240.6 249.148 3, 231.138 7, 203.142 6, 173.095 5C15H22O4zedoalactone A[19]愈创木烷型 43.51253.179 82253.179 75−0.3 253.181 0, 235.171 6, 177.125 7, 159.116 9C15H24O3莪术奥酮二醇[20]愈创木烷型 56.14247.132 87247.132 72−0.6 247.134 0, 229.122 9, 201.122 8C15H18O3姜黄醇酮[21]桉烷型 66.16265.143 44265.143 430.0 265.142 8, 247.133 0, 229.122 4, 201.122 8C15H20O4姜油酚[20]桉烷型 76.29253.179 82253.179 43−1.6 235.179 4, 235.170 8, 217.159 7, 151.113 1C15H24O3异莪术奥酮二醇愈创木烷型 86.41245.117 22245.117 461.0 245.117 1, 229.085 9, 181.101 4、C15H16O3cucumin C檀香烷型 96.45233.153 61233.153 660.2 135.080 7, 115.055 0, 107.086 4, 91.056 0C15H20O2姜黄酮醇A[22]没药烷型 106.66229.122 31229.122 430.6 229.122 3, 201.127 4, 187.075 4, 159.080 4C15H16O2cucumin A[20]檀香烷型 116.70251.164 17251.164 270.4 233.151 1, 215.141 5, 191.142 3, 109.066 3C15H22O3莪术二醇[19]愈创木烷型 127.10265.143 44265.143 39−0.2 265.144 4, 247.134 9, 205.086 0, 105.071 7C15H20O4姜黄内酯C蒈烷型 137.25249.148 52249.148 540.1 249.148 3, 204.143 3, 143.085 8, 105.071 3C15H20O3姜黄内酯A[19]蒈烷型 147.51237.184 91237.185 100.8 237.177 6C15H24O2莪术二酮*吉玛烷型 157.62247.132 87247.132 920.2 247.134 3, 229.122 0, 189.092 0, 183.117 7C15H18O3蓬莪术环氧酮[20]吉玛烷型 167.65265.143 44265.143 440 247.129 1, 229.123 7, 121.102 7, 91.056 3C15H20O4zedoarofuran[20]桉烷型 177.80249.148 52249.148 520 249.149 6, 189.127 6, 107.087 7C15H20O3germaerone-4,5-epoxide[20-21]吉玛烷型 187.89251.164 17251.164 230.2 251.170 6, 233.154 3, 215.144 6, 205.160 1C15H22O3原莪术二醇[20-21]愈创木烷型 198.81235.169 26235.169 400.6 217.158 4, 189.162 9, 161.096 5, 133.109 9C15H22O2莪术烯醇*愈创木烷型 208.81235.169 26235.169 400.6 235.169 8, 177.127 9, 161.096 5, 133.100 9C15H22O2莪术双环烯酮*蒈烷型 219.18229.122 31229.122 480.8 229.123 5, 211.112 1, 201.127 5C15H16O2莪术酮[19]杜松烷型 229.18247.132 87247.133 171.2 229.121 1, 159.079 9, 139.039 2, 123.044 9C15H18O3zedoarol[20]愈创木烷型 239.20237.184 91237.185 251.4 237.185 3, 219.174 5, 135.117 1, 107.086 8C15H24O2新莪术二酮[19, 21]吉玛烷型 249.43217.158 69217.158 941.1 217.159 4, 189.163 7, 105.107 8C15H20OcomosoneII[20]杜松烷型 259.52237.184 91237.185 090.8 237.185 0, 219.174 2, 191.179 2, 135.117 1C15H24O2莪术醇*愈创木烷型 269.53219.174 34219.174 420.3 219.178 6, 201.164 0, 163.124 1, 147.117 4C15H22O甜没药姜黄醇没药烷型 2710.08371.148 92371.149 561.7 219.174 2, 177.054 7, 145.028 6, 137.060 1C21H22O6二氢姜黄素姜黄素类 2810.62309.112 14309.112 320.6 309.112 8, 225.091 0, 147.044 1C19H16O4双去甲氧基姜黄素*姜黄素类 2910.64215.143 04215.142 92−0.6 215.142 6, 197.132 3, 173.095 6, 167.084 7C15H18Oagassizin[20]愈创木烷型 3010.64233.153 61233.153 52−0.4 233.153 7, 215.143 5, 175.112 9, 147.079 6C15H20O2呋喃大牻牛儿酮[19]吉玛烷型 3110.69221.189 99221.189 96−0.2 221.191 1, 203.184 3, 123.118 2, 109.103 5C15H24O莪术油[19]没药烷型 3210.93231.137 96231.138 040.4 231.138 4, 213.127 6, 249.060 5, 135.081 4C15H18O2莪术呋喃烯酮*榄烷型 3311.08339.122 7339.123 542.2 255.101 8, 223.076 0, 177.055 1, 147.044 4C20H18O5去甲氧基姜黄素姜黄素类 3411.44369.133 27369.133 570.8 253.086 1, 177.054 4, 161.059 9C21H20O6姜黄素*姜黄素类 3511.47217.158 69217.158 880.9 217.159 0, 199.148 5, 161.096 6, 105.071 6C15H20O莪术呋喃二烯吉玛烷型 3611.40231.137 96231.138 120.7 231.138 3, 213.127 3, 173.096 1, 161.059 6C15H18O2莪术呋喃二烯酮*吉玛烷型 3711.56213.127 39213.127 601.0 233.153 0, 205.158 5C15H16Opyrocurzerenone[20]拉松烷型 3811.63229.122 31229.122 29−0.1 229.122 2, 214.098 7, 167.084 9C15H16O2桂莪术内酯[20]愈创木烷型 3911.78219.174 34219.174 510.8 219.174 1, 159.116 5, 145.101 1, 91.056 0C15H22O吉玛酮*吉玛烷型 4011.87231.137 96231.138 321.6 231.137 5, 213.127 1, 203.143 7, 137.060 1C15H18O2表莪术酮[19]榄烷型 4112.52217.158 69217.158 890.9 119.086 3, 91.056 3, 77.041 7C15H20O芳姜黄酮[22]没药烷型 4212.63219.174 34219.174 26−0.4 219.174 8, 109.102 5, 67.058 3C15H22O诺卡酮[20]艾里莫酚烷型 4312.67203.179 43203.179 460.2 203.179 1, 147.116 7, 119.086 6, 105.072 2C15H22姜黄烯[20]没药烷型 4412.88205.195 08205.195 130.2 205.195 2, 149.130 2, 135.114 6, 109.102 9C15H24β-榄烯香[20]榄烷型 4513.30219.174 34219.174 400.3 121.101 7, 105.071 3, 93.071 5, 83.051 7C15H22O姜黄酮[21]没药烷型 4613.51205.195 08205.195 090.1 149.132 5, 121.101 7, 107.086 7, 93.071 8C15H24α-姜烯[20]没药烷型
*与对照品进一步确认
*further confirmed with reference substances
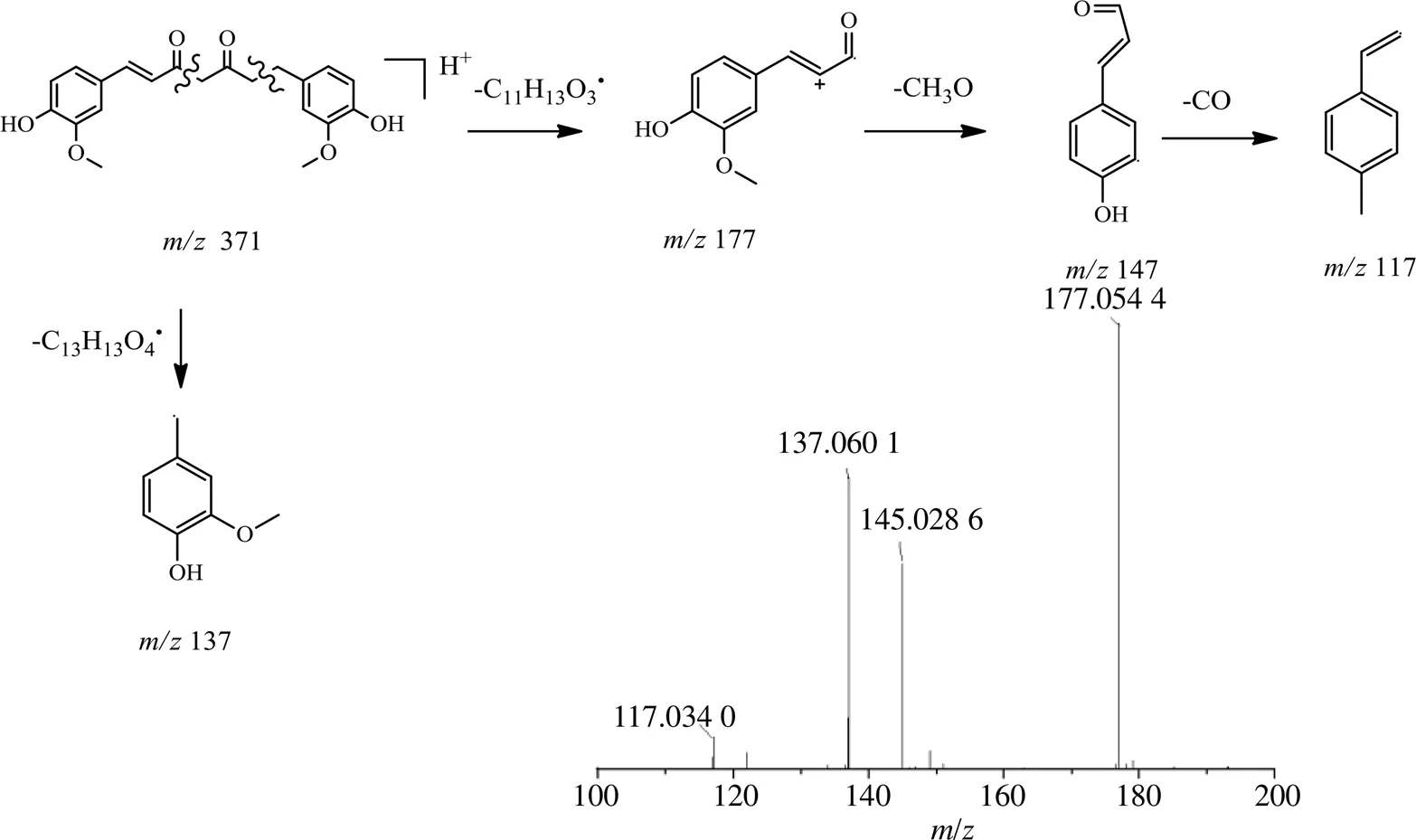
图2 二氢姜黄素裂解过程
(1)愈创木烷型:化合物22(R=9.18 min)在正离子模式下/237.185 1 [M+H]+,质谱软件计算出精确分子式为C15H18O3,观察二级质谱离子碎片,主要碎片离子为/229.121 1 [M-H2O]+,与文献数据比对,鉴定化合物为zedoarol。化合物19、25通过对照品对照分别确定为莪术烯醇、莪术醇。
(2)吉玛烷型:郁金样品中,化合物14、15、17、24、30、35、36、39为吉玛烷型倍半萜。分别为莪术二酮、蓬莪术环氧酮、germaerone-4,5- epoxide、新莪术二酮、呋喃大牻牛儿酮、莪术呋喃二烯、莪术呋喃二烯酮、吉玛酮。以莪术二酮和吉马酮为例,莪术二酮在正离子模式下/237.184 7 [M+H]+,质谱软件计算出精确分子式为C15H24O2,观察二级质谱离子碎片,主要碎片离子为/219.174 2 [M+H-H2O]+,双键进一步裂解得到135.117 4、107.087 4,与对照品比对,鉴定化合物14为莪术二酮。在正离子模式下/219.174 2 [M+H]+,质谱软件计算出精确分子式为C15H22O,观察二级质谱离子碎片,主要碎片离子为/201.165 0 [M+H-H2O]+,双键进一步裂解得到/177.127 4、135.116 7、107.086 1与对照品比对,鉴定化合物39为吉马酮。质谱裂解途径见图3。吉玛烷型倍半萜多以酮类为主,易发生麦氏重排脱去-H2O,然后主要以双键的α裂解为主要裂解途径。
(3)没药烷型:共鉴定了8种没药烷型倍半萜被,以化合物31(R=10.69 min)为例,正离子模式下/221.191 1 [M+H]+,计算出精确分子式为C15H24O,观察二级质谱离子碎片,主要碎片离子为/221.191 1、203.184 3、109.103 5、81.075 7,根据Scifinder和Reaxy数据库检索和参考文献数据[19]鉴定化合物为bisacurol。化合物45(R=13.3 min),正离子模式下/219.174 4 [M+H]+,计算出精确分子式为C15H22O,观察二级质谱离子碎片,主要碎片离子为/121.101 0、105.107 1、93.070 6、53.050 8,根据Scifinder和Reaxy数据库检索鉴定化合物为姜黄酮,裂解途径见图4。没药烷型倍半萜易在环外C-C键处发生裂解也易在双键处发生α裂解。
3.3 共有成分分析
4种郁金进行共有成分分析,得到12种共有成分,分别为姜黄内酯C、莪术二酮、莪术双环烯酮、莪术烯醇、莪术醇、二氢姜黄素、去甲氧基姜黄素、莪术呋喃二烯酮、姜黄烯、β-榄烯香、姜黄酮和姜烯。见表3。
3.4 潜在Q-Marker预测
3.4.1 “成分-靶点-疾病”网络构建 将4种郁金12个共有成分作为化学标记物进行网络药理学分析,确定郁金治疗抑郁的潜在Q-Marker。得到326个化学成分相关靶点及430个疾病靶点。两者取交集后获得药物-疾病共同靶点77个。
3.4.2 PPI网络构建 对12个潜在活性成分与77个药物-疾病共同靶点进行分析,得到“成分-靶点-疾病”PPI的网络图并构建蛋白相互作用的PPI网络(图5)。图中绿色代表药物成分中的9种活性成分为姜黄内酯C、莪术二酮、莪术双环烯酮、莪术烯醇、莪术醇、二氢姜黄素、去甲氧基姜黄素、莪术呋喃二烯酮和姜黄酮(姜黄烯、β-榄烯香和姜烯3个活性成分靶点与疾病靶点无交集,予删除),蓝色代表77个共同靶点,红色代表疾病。PPI图中节点表示蛋白,边表示蛋白之间的关联,节点的边越密集,表明degree值越大,说明其在郁金抗抑郁的过程中就发挥更重要的作用。其中姜黄酮degree值为37,莪术双环烯酮degree值为30,莪术二酮degree值为24,莪术烯醇degree值为10,二氢姜黄素degree值为14,去甲氧基姜黄素degree值为14,莪术醇degree值为13,莪术呋喃二烯酮degree值为8,姜黄内酯C degree值为6。姜黄酮、莪术双环烯酮和莪术二酮对应的靶点更多作用更大。

图3 莪术二酮(A) 和吉玛酮(B) 裂解过程

图4 Bisacurol (A)和姜黄酮裂解过程(B)
表3 不同药材来源郁金饮片共有成分和交叉存在成分分析
Table 3 Common and cross-existent components analysis of Curcuma Radix pieces from four different sources
不同基原植物数量/个共有成分名称 温郁金、广西莪术、姜黄、蓬莪术12姜黄内酯C、莪术二酮、莪术双环烯酮、莪术烯醇、莪术醇、二氢姜黄素、去甲氧基姜黄素、莪术呋喃二烯酮、姜黄烯、β-榄烯香、姜黄酮和α-姜烯 温郁金、广西莪术、蓬莪术21zedoalactone B 、zedoarolide B、zedoalactone A、莪术奥酮二醇、姜油酚、异莪术奥酮二醇、姜黄内酯A、蓬莪术环氧酮、zedoarofuran、germaerone-4,5-epoxide、原莪术二醇、zedoarol、comosone II、新莪术二酮、甜没药姜黄醇、agassizin、呋喃大牻牛儿酮、莪术油、莪术呋喃二烯、pyrocurzerenone、吉玛酮 广西莪术、蓬莪术5姜黄醇酮、姜黄素C、姜黄素A、桂莪术内酯、诺卡酮 温郁金、姜黄2莪术呋喃烯酮、姜黄素 广西莪术、姜黄1芳姜黄酮 蓬莪术、姜黄2双去甲氧基姜黄素 温郁金2莪术酮、表莪术酮 姜黄1姜黄酮醇
图5 成分-靶点-疾病相互作用的网络图和核心靶点的PPI网络
Fig.5 Network diagram of component-target-disease interaction and PPI network of core targets
3.4.3 核心靶点分析及KEGG富集分析 将PPI网络导入Cystoscap 3.7.2中,通过NetworkAnalyzer工具进行拓扑分析,以degree、betweenness centrality、average shortest path length和closeness centrality这4个参数为参考标准,通过degree排序,选取分值大于平均分的基因作为核心靶点,将前30个靶点使用R 3.6.1绘制条形图。根据拓扑分析进行核心靶点筛选,主要包括5羟色胺受体(HTR1A、HTR2A、HTR1D、HTR1B)、阿片受体(OPRK1、OPRM1、OPRD1、OPRL1)等主要靶点。将77个共同靶点进行KEGG通路分析,Padjust代表富集的显著性,颜色越红则显著性越高。由图6可知,4个标记化合物抗抑郁关键靶点主要涉及神经活性配体-受体相互作用、血清素能突触、钙信号通路、cAMP信号通路、逆行内源性大麻素信号等15条信号通路。
4 讨论
郁金在临床中应用十分广泛[23],有很多关于其在治疗抑郁症的研究和报道[4,13,24],《中国药典》2020年版中4种基原郁金药材均可作为正品郁金药用,但由于郁金在外观和内在质量均存在较大差异。迄今为止郁金药材和饮片尚未建立合适的质量评价标准。

图6 核心靶点及KEGG富集分析
本研究基于刘昌孝院士提出的Q-Marker概念,通过UPLC-Triple-TOF-MS技术对4种基原郁金中的化合物进行了定性分析。通过UPLC-Triple-TOF- MS技术对4种基原郁金的化学成分进行快速鉴别,共检测到46个化合物,其中温郁金共鉴别出39个,广西莪术鉴别出40个,蓬莪术鉴别出40个,姜黄鉴别出17个。主要包括姜黄素类成分和10种不同结构类型的倍半萜类成分。初步找出4种郁金的12个共有化合物为姜黄内酯C、莪术二酮、莪术双环烯酮、莪术烯醇、莪术醇、二氢姜黄素、去甲氧基姜黄素、莪术呋喃二烯酮、姜黄烯、β-榄烯香、姜黄酮和姜烯。并基于找出的共有化合物作为郁金潜在的化学标记物进行网络药理学研究,发现姜黄内酯C、莪术二酮、莪术双环烯酮、莪术烯醇、莪术醇、二氢姜黄素、去甲氧基姜黄素、莪术呋喃二烯酮和姜黄酮9个化合物可通过5羟色胺受体(HTR1A、HTR2A、HTR1D、HTR1B)、阿片受体(OPRK1、OPRM1、OPRD1、OPRL1)等主要靶点对抑郁症中的神经活性配体-受体相互作用、钙信号通路等关键信号通路发挥药理作用。
有实验研究表明姜黄酮在小鼠绝望实验中具有明显的抗抑郁活性,可以降低血液中皮质酮水平,同时增加皮质、纹状体、海马体和下丘脑中5-羟色胺水平,达到抗抑郁效果[25-26]。有文献报道莪术双环烯酮和莪术烯醇具有抗氧化活性和神经保护作用,可以改善过氧化氢诱导的小鼠神经母细胞瘤-大鼠神经胶质瘤杂交瘤细胞的氧化应激[27]。细胞体外实验表明莪术二酮、莪术醇和莪术呋喃烯酮可以通过剂量相关的方式抑制跨膜蛋白16A介导的电流流入,同时能抑制细胞内钙离子浓度和钾离子通道[28]。二氢姜黄素和双去甲氧基姜黄素为姜黄素类似物,有很多关于姜黄素抗抑郁的报道[29-31]。Li等[32]通过细胞胞吐实验,发现姜黄素和双去甲基姜黄素可以可调节PC12细胞中单胺的释放而改善记忆和学习。二氢姜黄素是姜黄素的主要代谢产物之一,可以抗氧化、调血脂和保护肝脏等,Yu等[33]通过细胞实验发现二氢姜黄素可以通过调节甾醇调节元件结合蛋白-1C、Patatin样磷脂酶结构域蛋白3和过氧化物酶体增殖物激活受体-α的mRNA和蛋白质表达水平来降低细胞三酰甘油的水平,同时通过增加pAKT和PI3K的蛋白质表达水平来改善肝细胞葡萄糖摄取。姜黄内酯C未见有抗抑郁的报道,但有文献报道其对小鼠的急性肝损伤有保护作用[34]。结合Q-Marker“五原则”的可测性和文献有效性佐证,将姜黄酮、莪术双环烯酮、莪术二酮、莪术烯醇、莪术醇、二氢姜黄素、去甲氧基姜黄素和莪术呋喃二烯酮作为郁金潜在的Q-Marker。
本研究采用UPLC-Triple-TOF-MS技术和网络药理学方法,建立各基原郁金化学成分库可以快速确认其成分,分析预测郁金潜在的Q-Marker,可为全面建立郁金质量评价方法及质量溯源体系提供理论依据,还可为含有郁金的复方Q-Marker的筛选提供参考。本实验在完成多基原,多产区复杂中药成分快速指认方面做出探索,为进一步进行郁金药材 Q-Marker的研究奠定基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S].一部.2020: 217.
[2] Yuan H L, Zhao Y L, Ding C F,.Anti-inflammatory and antinociceptive effects ofand its bioactive terpenoidsand[J]., 2020, 259: 112935.
[3] Li J Q, Zhang D Q, Zhang X,.Research traditional Chinese medicine properties by detecting rats' monoamine neurotransmitter after given two different traditional Chinese medicine [J]., 2010, 35(8): 1022-1024.
[4] 黄世敬, 陈宇霞, 潘菊华.郁金治疗抑郁症的配伍应用及其抗抑郁研究进展 [J].北京中医药, 2014, 33(6): 477-479.
[5] Wang J, Qiu R B, Yuan L J,.Analysis on thekatsumadai components of Zingiberaceae plants and their functions on myeloma resistance [J]., 2015, 28(3 Suppl): 1065-1068.
[6] 张晓梅, 赵玉涛, 王菊美, 等.姜黄素对结直肠癌细胞迁移、侵袭和上皮间质转化的影响及作用机制[J].世界中医药, 2021, 16(17): 2596-2599.
[7] Huang X, Lv B, Zhang S,.Effects ofcurcumae-derived diterpenoid C on-induced inflammation and nuclear factor kappa B signal pathways [J]., 2013, 19(31): 5085-5093.
[8] 姜文典.中药郁金对实验性大鼠消化性溃疡形成及血清表皮生长因子水平的影响。[D].大连: 大连医科大学, 2006.
[9] 刘洋.基于属性偏序方法的现代岭南名中医脾胃病证治规律研究 [D].广州: 广州中医药大学, 2019.
[10] 安月伟.温郁金源三种药材化学成分与药效差异比较研究 [D].北京: 中国中医科学院, 2014.
[11] 刘昌孝.中药质量标志物(Q-marker):提高中药质量标准及质量控制理论和促进中药产业科学发展 [J].中草药, 2019, 50(19): 4517-4518.
[12] 李涛, 梅妍, 张鑫, 等.关于抑郁症辨证分型及用药规律的第一轮专家问卷分析 [J].北京中医药大学学报, 2012, 35(5): 352-354.
[13] 钱海兵, 王毅, 黄国钧.温郁金水提物对卒中后抑郁大鼠行为及血管新生的影响 [J].时珍国医国药, 2012, 23(7): 1709-1711.
[14] 韩珍, 贺弋, 杨艳, 等.郁金抗抑郁作用的实验研究 [J].宁夏医学院学报, 2008, 30(3): 275-276.
[15] 王雪梅, 石典花, 滕颖, 等.4种不同基原郁金饮片水提液的石油醚提取部位GC-MS分析与比较 [J].中国实验方剂学杂志, 2018, 24(11): 9-15.
[16] Baldovini N, Tomi F, Casanova J.Identification and quantitative determination of furanodiene, a heat-sensitive compound, in essential oil by13C-NMR [J]., 2001, 12(1): 58-63.
[17] Kuroyanagi M, Shirota O, Sekita S,.Transannular cyclization of (4, 5)-germacrone-4, 5-epoxide into guaiane and secoguaiane-type sesquiterpenes [J]., 2012, 7(4): 1934578X1200700.
[18] Fang J Y, Yang B, Ge Z W,.Single standard substance for the determination of nine volatile components in the distillate ofand(an intermediate of Xingnaojing Injection) [J]., 2017, 40(20): 3946-3957.
[19] Lu T L, Mao C Q, Hao M,.Metabolic profiling analysis of three processed rhizomes ofY.H.Chen et C.Ling by ultra-performance liquid chromatography/time-of-flight mass spectrometry [J]., 2019, 15(60): 164.
[20] Zhou W J, Guo Z M, Yu L,.On-line comprehensive two-dimensional liquid chromatography tandem mass spectrometry for the analysis of[J]., 2018, 186: 73-79.
[21] Vijayan U K, Varakumar S, Singhal R S.A comparative account of extraction of oleoresin fromSalisb by solvent and supercritical carbon dioxide: Characterization and bioactivities [J]., 2019, 116: 108564.
[22] 胡昌江, 陈志敏, 胡麟.一种基于UPLC-Q-TOF/MS技术快速鉴定黄丝郁金的方法: 中国, CN109212119A [P].2019-01-15.
[23] 杨月红, 潘宇炯, 周昕, 等.姜黄、莪术、郁金三药临床应用情况分析 [J].药学服务与研究, 2019, 19(6): 467-470.
[24] 赵铮蓉, 张萍, 吴月国, 等.温郁金抗抑郁活性部位的筛选 [J].中华中医药杂志, 2011, 26(8): 868-869.
[25] Liao J C, Tsai J C, Liu C Y,.Antidepressant-like activity of turmerone in behavioral despair tests in mice [J]., 2013, 13: 299.
[26] 宋敏, 左政, 李亚楠, 等.中西医治疗中风后抑郁症的概况[J].世界中医药, 2021, 16(10): 1638-1642.
[27] Hamdi O A A, Lo Jia Ye, Kamarudin M N A,.Neuroprotective and antioxidant constituents fromrhizomes [J]., 2015, 9(3): 349-355.
[28] Zhu X J, Zhang W T, Jin L L,.Inhibitory activities of curzerenone, curdione, furanodienone, curcumol and germacrone on Ca2+-activated chloride channels [J]., 2020, 147: 104736.
[29] Kaufmann F N, Gazal M, Bastos C R,.Curcumin in depressive disorders: An overview of potential mechanisms, preclinical and clinical findings [J]., 2016, 784: 192-198.
[30] Wang Z, Zhang Q, Huang H F,.The efficacy and acceptability of curcumin for the treatment of depression or depressive symptoms: A systematic review and meta-analysis [J]., 2021, 282: 242-251.
[31] Matias J N, Achete G, Campanari G S D S,.A systematic review of the antidepressant effects of curcumin: Beyond monoamines theory [J]., 2021, 55(5): 451-462.
[32] Li X C, Mohammadi A S, Ewing A G.Single cell amperometry reveals curcuminoids modulate the release of neurotransmitters during exocytosis from PC12 cells [J].(Lausanne), 2016, 781: 30-35.
[33] Yu Q Q, Liu Y Y, Wu Y F,.Dihydrocurcumin ameliorates the lipid accumulation, oxidative stress and insulin resistance in oleic acid-induced L02 and HepG2 cells [J]., 2018, 103: 1327-1336.
[34] Matsuda H, Morikawa T, Ninomiya K,.Hepatoprotective constituents from: Absolute stereostructures of three new carabrane-type sesquiterpenes, curcumenolactones A, B, and C [J]., 2001, 9(4): 909-916.
Rapid establishment of a database of potential quality markers (Q-Marker) of traditional Chinese medicine inbased on UPLC-Triple-TOF-MS and network pharmacology
ZHANG Kuan-yong1, SHEN Yi1, ZHANG Lu1, ZHANG Qiao-yan1, MENG Xiong-yu1, GE Zhi-wei1, YAN Bin-jun1, QIN Lu-ping1
1.College of Pharmacy, Zhejiang Chinese Medical University, Hangzhou 310053, China 2.Agricultural and Health Environmental Testing Center of Zhejiang University, Hangzhou 310058, China
According to the concept of Q-Marker of traditional Chinese medicine, to establish a potential Q-Marker library of different sources of Yujin ().Ultra-performance liquid chromatography and triple quadrupole time-of-flight mass spectrometry (UPLC-Triple-TOF-MS) technology was used to establish a high-resolution mass spectrometry database of the chemical constituents of, and the chemical constituents-targets were constructed by methods such as network pharmacology.Point-channel prediction ofQ-Marker.A total of 46 chemical components and 12 common components were identified indecoction pieces.Using common components as Q-Marker candidates for network pharmacology analysis, it was predicted that turmerone, curcumenone, curdione, curcumenol, curcumol, dihydrocurcumin, demethoxycurcumin and furanodienone can act on serotonin receptors (HTR1A, HTR2A, HTR1D, HTR1B), opioid receptors (OPRK1, OPRM1, OPRD1, OPRL1) and other targets, through the regulation of neuroactive ligand-receptor interactions, serotonergic synapses, calcium signaling pathways, cAMP signaling pathways, retrograde endocannabinoids important pathways such as signaling play an anti-depressant effect.UPLC-Triple-TOF-MS technology and network pharmacology methods can be used to quickly analyze and determine the chemical components of traditional Chinese medicine, and establish a potential Q-Marker library of.
; quality marker(Q-Marker); network pharmacology; turmerone; curcumenone;curdione; curcumenol; curcumol; dihydrocurcumin; demethoxycurcumin; furanodienone
R284.1
A
0253 - 2670(2022)09 - 2612 - 11
10.7501/j.issn.0253-2670.2022.09.003
2022-01-28
浙江省中医药科技计划项目(2019ZQ012);GK2021年浙江省重点研发项目(21-308)
张宽永(1994—),硕士研究生。Tel: 19157739098 E-mail: 1192572210@qq.com
通信作者:秦路平,博士,教授,主要从事内生菌方向。E-mail: lpqin@zcmu.edu.cn
严斌俊,博士,副教授,主要从事药物分析方向。E-mail: ybinjun@126.com
[责任编辑 王文倩]
