FBXO40对心肌细胞增殖的作用
2022-05-06谢敬仪王琪王涛钱丽丽
谢敬仪 王琪 王涛 钱丽丽


[摘要]目的探究E3泛素連接酶FBXO40在心肌细胞增殖过程中的调控作用。方法转染si-FBXO40小干扰RNA和FBXO40过表达载体分别敲低和过表达原代心肌细胞中的FBXO40,利用实时定量PCR(qPCR)方法检测经上述处理后原代心肌细胞中增殖相关标记基因(cdc20、Cyr61、Ccna2、Aurkb)的表达水平;转染FBXO40过表达载体以及si-FBXO40小干扰RNA,在24 h后利用CCK-8方法进一步检测原代心肌细胞增殖情况。结果与对照组相比,过表达FBXO40的原代心肌细胞中与细胞增殖相关基因Ccna2、Cdc20、Aurkb和Cyr61的表达明显上调,差异具有统计学意义(t=2.20~3.90,P<0.05)。与对照组相比,敲低FBXO40表达的原代心肌细胞中促增殖基因Cyr61的表达明显下降,差异有统计学意义(t=10.96,P<0.05)。CCK-8检测显示,FBXO40过表达组的吸光度值高于对照组,敲低组的吸光度值低于对照组,差异有统计学意义(F=6.72,P<0.05)。结论FBXO40在心肌细胞增殖过程中具有重要的调控作用,可促进心肌细胞增殖。
[关键词]泛素蛋白连接酶类;FBXO40;肌细胞,心脏;细胞增殖
[中图分类号]R345.9;R329.25[文献标志码]A[文章编号]2096-5532(2022)02-0201-04
doi:10.11712/jms.2096-5532.2022.58.047[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220311.1333.003.html;2022-03-1415:16:03
EFFECT OF FBXO40 ON THE PROLIFERATION OF CARDIOMYOCYTES XIE Jingyi, WANG Qi, WANG Tao, QIAN Lili (Institute of Translational Medicine, Qingdao University Meadical College, Qingdao 266021, China)
[ABSTRACT]ObjectiveTo investigate the regulatory role of the E3 ubiquitin ligase FBXO40 in the process of cardiomyocyte proliferation. MethodsPrimary cardiomyocytes were transfected with si-FBXO40 small-interfering RNA or FBXO40 overexpression vector to knock down FBXO40 or induce the overexpression of FBXO40. Quantitative real-time PCR was used to mea-sure the mRNA expression levels of proliferation-related markers (Cdc20, Cyr61, Ccna2, and Aurkb) in the primary cardiomyocytes after the above treatment, and CCK-8 assay was used to measure the proliferation of primary cardiomyocytes at 24 hours after transfection with FBXO40 overexpression vector or si-FBXO40 small-interfering RNA. ResultsCompared with the control group, the primary cardiomyocytes with FBXO40 overexpression had significant increases in the expression of proliferation-related genes (Ccna2, Cdc20, Aurkb, and Cyr61) (t=2.20-3.90,P<0.05), while the primary cardiomyocytes with FBXO40 knock-down had a significant reduction in the expression of the proliferation-promoting gene Cyr61 (t=10.96,P<0.05). CCK-8 assay showed that compared with the control group, the FBXO40 overexpression group had a significantly higher absorbance value and the FBXO40 knock-down group had a significantly lower absorbance value (F=6.72,P<0.05). ConclusionFBXO40 plays an important role in regulating the proliferation of cardiomyocytes and can promote the proliferation of cardiomyocytes.
[KEY WORDS]ubiquitin-protein ligases; FBXO40; myocytes, cardiac; cell proliferation
严格的蛋白质控制在心脏的发育与功能维持方面发挥重要作用,蛋白质代谢或运输异常存在于多种心脏疾病中。泛素蛋白酶体系统在调控错误折叠蛋白或损伤蛋白降解方面发挥重要作用,其中,E3泛素连接酶尤为重要,它通过对细胞关键蛋白的识别、相互作用和泛素化,在细胞增殖和分化等过程中发挥着关键作用[1]。近年来大量研究发现,泛素连接酶参与细胞增殖的调控,细胞周期调节因子(其中许多具有肿瘤抑制或致癌功能)的破坏与癌症的发生进展密切相关;癌抑制蛋白的非正常或快速降解,或者是癌蛋白的大量堆积,都会导致癌细胞的增殖和转化。2006年,NAKAYAMA等[2]发现,Skp1-Cul1-F-box(SCF) E3泛素连接酶复合体的特异性泛素化导致细胞增殖、基因组不稳定甚至是癌症。2016年,LIU等[3]研究表明,泛素蛋白酶FAT10可调控癌细胞的增殖。2020年,GUO等[4]研究表明,泛素蛋白酶HRD1在谷氨酰胺缺乏的条件下可特异性抑制三阴性乳癌细胞增殖。
F-box蛋白是E3泛素连接酶的一种,FBXO40是2007年发现的一种F-box蛋白,其在骨骼肌和心肌中特异性高表达,而且在去神经性肌肉萎缩样本中的表达也显著上调[5]。2011年SHI等[6]研究结果表明,SCF-FBXO40复合体在骨骼肌中通过诱导胰岛素受体底物1(IRS1)蛋白降解来抑制胰岛素样生长因子1(IGF1)诱导的骨骼肌肥大信号通路。然而,FBXO40在心肌中的研究尚未见报道。本研究旨在探讨FBXO40对心肌细胞增殖是否具有调控作用以及发挥怎样的作用,以期为心肌疾病的治疗提供新的思路。
1材料与方法
1.1主要材料
DMEM-F12培养液、PBS缓冲液(美伦生物公司),胎牛血清(BI公司),Trizol总RNA提取试剂、M-MLV逆转录试剂盒、SYBR Green预混型实时定量PCR(qPCR)试剂盒(艾瑞克生物公司),胰液素(美国Sigma公司),Ⅱ型胶原酶(美国Worthington公司),DEPC原液、qPCR引物(擎科生物公司),siRNA序列及NC对照序列(上海吉玛生物科技有限公司),Lipofectamine 3000转染试剂(美国Invitrogen公司),CCK-8试剂盒(同仁化学研究所)。
1.2实验方法
1.2.1原代心肌细胞培养解剖大鼠乳鼠取出心脏,在PBS缓冲液中洗涤至无血污;将心脏剪碎后置于含有胰液素和胶原酶的消化工作液中(用PBS液加到50 mL),在37 ℃恒温水浴锅中消化6~8 min,收集每次消化后的上清液,剩余组织加入5 mL消化液继续消化,直至组织块被完全消化;将上清液收集到离心管中以800~1 000 r/min离心5~6 min,弃上清,将沉淀的细胞加入DMEM-F12培养液(加青霉素/链霉素双抗)中吹打混匀清洗后,再次离心去上清,将剩余沉淀再次悬浮于DMEM-F12培养液(加青霉素/链霉素双抗)中,经260目过滤网过滤到培养皿,在37 ℃细胞培养箱中差速贴壁培养1.5~2.0 h,最后接种于细胞培养皿中。整个过程在超净工作台中进行无菌操作。
1.2.2细胞转染当原代心肌细胞密度达60%~70%时可进行转染。实验分为对照组、敲低组和过表达组。对照组细胞不做处理。敲低组先将溶解的3.5 μL si-FBXO40小干扰RNA加入到125 μL无血清DMEM-F12培养液中混匀(标为1号管),过表达组则先将2.5 μL的FBXO40过表达载体加入到125 μL无血清DMEM-F12培养液中混匀(2号管),置室温3~5 min;将7 μL Lipofectamin 3000加入250 μL无血清DMEM-F12培养液中混匀(3号管),室温放置3~5 min;将3号管中试剂按1∶1的比例分入1号、2号管中混匀,室温下静置20~25 min;敲低组和过表达组分别将1号、2号管中液体加入到细胞培养皿中,于37 ℃恒温培养箱培养24 h,进行后续检测。
1.2.3qPCR检测增殖相关基因的表达用Trizol试剂提取原代心肌细胞总RNA,测定RNA浓度及纯度,进行反转录和qPCR。模板cDNA使用逆转录试剂盒构建,qPCR体系根据试剂盒说明书设置。引物序列见表1。将qPCR的定量结果标准化,以GAPDH为内参对照,计算Cdc20、Ccna2、Cyr61和Aurkb基因的相对表达量。实验至少重复3次。
1.2.4CCK-8法检测细胞增殖将原代心肌细胞悬液接种于96孔板中(每孔约1×104个细胞),分为对照组、敲低组和过表达组,每组设置5个复孔,各组细胞的处理同1.2.2。细胞培养24 h后进行CCK-8检测,每孔加入10 μL CCK-8溶液,37 ℃孵育2 h后,用酶标仪测量450 nm波长处的吸光度值。实验重复3次[7]。
1.3统计学分析
使用GraphPad Prism 8.0软件进行统计学分析。计量资料数据以x±s表示,两组比较采用成组t检验,多组比较采用方差分析。以P<0.05为差异有统计学意义。
2结果
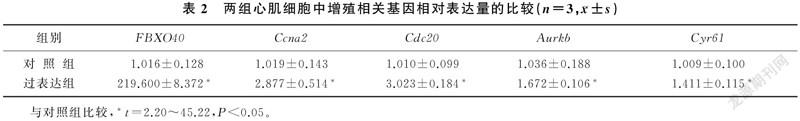
2.1过表达FBXO40后心肌细胞中增殖相关基因的表达变化
qPCR检测结果显示,过表达组细胞成功诱导FBXO40过表达(t=45.22,P<0.01);与对照组相比较,过表达组原代心肌细胞中与细胞增殖相關基因Ccna2、Cdc20、Aurkb和Cyr61的表达均明显上调(t=2.20~3.90,P<0.05)。见表2。
2.2敲低FBXO40后心肌细胞中Cyr61基因的表达变化
qPCR检测结果显示,敲低组的原代心肌细胞中成功转染si-FBXO40小干扰RNA(t=8.27,P<0.05);与对照组相比,敲低组原代心肌细胞中促增殖基因Cyr61的表达明显下降,差异有统计学意义(t=10.96,P<0.05)。见表3。
2.3FBXO40對心肌细胞增殖的影响
转染24 h后CCK-8检测结果显示,对照组、过表达组和敲低组的吸光度值分别为0.191±0.005、0.205±0.002和0.154±0.030(n=3),过表达组的吸光度值高于对照组,敲低组的吸光度值低于对照组,差异有统计学意义(F=6.72,P<0.05)。表明敲低FBXO40会抑制原代心肌细胞增殖,而过表达FBXO40能促进细胞增殖。
3讨论
泛素蛋白酶体系统参与多种细胞过程的调控,如细胞增殖、细胞周期进程、转录和凋亡等[8-11]。在细胞增殖过程中细胞的有丝分裂周期是一个被严格调控的过程,有丝分裂的进程复杂,需要通过泛素连接酶的复杂催化和蛋白酶复合体对底物的降解来调节细胞周期[12]。细胞周期调控过程主要是周期蛋白依赖性激酶(CDKs)的连续性激活,通过CDKs以及周期蛋白激酶抑制剂(CKIs)的泛素介导来实现蛋白质的水解。在真核细胞中,E3泛素连接酶的两个家族,即后期促进复合物和SCF蛋白复合体,负责许多CDKs调节因子的泛素化和蛋白酶体降解,确保细胞周期的精确调控[13-14]。在过去的几十年里,越来越多的证据表明,由于蛋白水解控制不力而导致的细胞周期转变异常,导致细胞增殖失控,最终影响身体功能甚至是发生癌变[15-17]。一些泛素化因子通过调控细胞增殖以及细胞周期进程来参与心血管疾病的治疗[18]。因此,更好地理解细胞增殖,了解细胞周期调控中泛素信号的多样性和复杂性,将为精确控制细胞周期进程和解决癌症或心血管疾病的临床治疗问题提供新的思路。
E3泛素连接酶在蛋白质代谢中发挥重要的作用,F-box蛋白作为一种E3泛素连接酶是SCF的重要组成部分,它通过F-box结构域与Skp1相互作用,并通过其他相互作用区域与蛋白结合并使其泛素化进而介导蛋白水解[19]。F-box蛋白根据其特异性底物识别域可分为3个亚类:FBXW亚类含有WD40重复结构域,由10个成员组成;FBXL亚类富含亮氨酸重复结构域,有22个家族成员;其余37种F-box蛋白被指定为FBXO蛋白,其中包含各种尚未被完全鉴定的结构域[20-23]。FBXO40蛋白是2007年发现的一种F-box蛋白。已经有研究发现,FBXO40在骨骼肌和心肌中特异性高表达[5],然而FBXO40在心肌中的作用未见报道。本研究通过体外实验,初步探究了FBXO40在心肌细胞增殖过程中是否具有调控作用,以及具有怎样的调控作用。本研究首先采用qPCR方法检测过表达FBXO40后原代心肌细胞中增殖相关基因的表达变化,结果显示,在原代心肌细胞中过表达FBXO40后,与细胞增殖相关的基因Ccna2、Cdc20、Aurkb、Cyr61的表达均显著上调,提示FBXO40具有促进心肌细胞增殖的作用。随后,本研究又通过敲低原代心肌细胞中的FBXO40表达,分别采用qPCR和CCK-8方法检测了具有促增殖作用的基因Cyr61相对表达量的变化以及细胞增殖情况,结果显示,与过表达FBXO40相反,敲低FBXO40表现出抑制细胞增殖的作用,进一步验证了FBXO40对细胞增殖具有促进作用。在后续工作中我们将进一步探究FBXO40在心肌细胞增殖中的具体调控通路,为心血管疾病的预防治疗提供新的靶标。
[参考文献]
[1]DENG L, MENG T, CHEN L, et al. The role of ubiquitination in tumorigenesis and targeted drug discovery[J]. Signal Transduction and Targeted Therapy, 2020,5(1):11.
[2]NAKAYAMA K I, NAKAYAMA K. Ubiquitin ligases: cell-cycle control and cancer[J]. Nature Reviews Cancer, 2006,6(5):369-381.
[3]LIU X X, CHEN L F, GE J, et al. The ubiquitin-like protein FAT10 stabilizes eEF1A1 expression to promote tumor proli-feration in a complex manner[J]. Cancer Research, 2016,76(16):4897-4907.
[4]GUO X, WANG A, WANG W, et al. HRD1 inhibits fatty acid oxidation and tumorigenesis by ubiquitinating CPT2 in triple-negative breast cancer[J]. Molecular Oncology, 2021,15(2):642-656.
[5]YE J W, ZHANG Y, XU J L, et al. FBXO40, a gene encoding a novel muscle-specific F-box protein, is upregulated in denervation-related muscle atrophy[J]. Gene, 2007,404(1/2):53-60.
[6]SHI J, LUO L Q, EASH J, et al. The SCF-Fbxo40 complex induces IRS1 ubiquitination in skeletal muscle, limiting IGF1 signaling[J]. Developmental Cell, 2011,21(5):835-847.
[7]SARRI E, RAMOS B, SALIDO G M, et al. The cholecystokinin analogues JMV-180 and CCK-8 stimulate phospholipase C through the same binding site of CCK(A) receptor in rat pancreatic acini[J]. British Journal of Pharmacology, 2001,133(8):1227-1234.
[8]ZOU T T, LIN Z H. The involvement of ubiquitination machinery in cell cycle regulation and cancer progression[J]. International Journal of Molecular Sciences, 2021,22(11):5754.
[9]TIWARI S, ROEL C, WILLS R, et al. Early and late G1/S cyclins and cdks act complementarily to enhance authentic human β-cell proliferation and expansion[J]. Diabetes, 2015,64(10):3485-3498.
[10]BUDHIDARMO R, DAY C L. The ubiquitin-associated domain of cellular inhibitor of apoptosis proteins facilitates ubi-quitylation[J]. The Journal of Biological Chemistry, 2014,289(37):25721-25736.
[11]EE G, LEHMING N. How the ubiquitin proteasome system regulates the regulators of transcription[J]. Transcription, 2012,3(5):235-239.
[12]SWATEK K N, KOMANDER D. Ubiquitin modifications[J]. Cell Research, 2016,26(4):399-422.
[13]WOOD D J, ENDICOTT J A. Structural insights into the functional diversity of the CDK-cyclin family[J]. Open Biology, 2018,8(9):180112.
[14]SURYADINATA R, SADOWSKI M, SARCEVIC B. Control of cell cycle progression by phosphorylation of cyclin-depen-dent kinase (CDK) substrates[J]. Bioscience Reports, 2010,30(4):243-255.
[15]TAKAHASHI H, UEMATSU A, YAMANAKA S, et al. Establishment of a wheat cell-free synthesized protein array containing 250 human and mouse E3 ubiquitin ligases to identify novel interaction between E3 ligases and substrate proteins[J]. PLoS One, 2016,11(6):e0156718.
[16]TUNDO G R, SBARDELLA D, SANTORO A M, et al. The proteasome as a druggable target with multiple therapeutic potentialities: cutting and non-cutting edges[J]. Pharmacology & Therapeutics, 2020,213:107579.
[17]SENFT D, QI J F, RONAI Z A. Ubiquitin ligases in oncoge-nic transformation and cancer therapy[J]. Nature Reviews Cancer, 2018,18(2):69-88.
[18]DREWS O, TAEGTMEYER H. Targeting the ubiquitin-proteasome system in heart disease: the basis for new therapeutic strategies[J]. Antioxidants & Redox Signaling, 2014,21(17):2322-2343.
[19]NGUYEN K M, BUSINO L. The biology of F-box proteins: the SCF family of E3 ubiquitin ligases[J]. Advances in Experimental Medicine and Biology, 2020,1217:111-122.
[20]WANG Z W, LIU P D, INUZUKA H, et al. Roles of F-box proteins in cancer[J]. Nature Reviews Cancer, 2014,14(4):233-247.
[21]LAN R X, JIN B, LIU Y Z, et al. Genome and transcriptome profiling of FBXW family in human prostate cancer[J]. American Journal of Clinical and Experimental Urology, 2020,8(4):116-128.
[22]HONG M J, KIM J B, SEO Y W, et al. Regulation of glycosylphosphatidylinositol-anchored protein (GPI-AP) expression by F-box/LRR-repeat (FBXL) protein in wheat (Triticum aestivum L.)[J]. Plants (Basel, Switzerland), 2021,10(8):1606.
[23]ZOU C B, CHEN Y, SMITH R M, et al. SCF (Fbxw15) mediates histone acetyltransferase binding to origin recognition complex (HBO1) ubiquitin-proteasomal degradation to regulate cell proliferation[J]. The Journal of Biological Chemistry, 2013,288(9):6306-6316.
(本文編辑马伟平)
