全氮多氮含能化合物研究进展与应用前景分析
2022-05-05许元刚林秋汉王鹏程
郎 晴,许元刚,林秋汉,王鹏程,陆 明
(南京理工大学化学与化工学院,江苏 南京 210094)
1 前 言
由于含能材料为武器的发射、推进和破坏提供动力,因此作为炸药、推进剂和烟火等的候选材料,一直备受关注[1-3]。含能化合物的重要性激发了人们对新型含能材料开发和利用的浓厚兴趣,同时,这也是一项长期的战略任务。2,4,6-三硝基甲苯,俗称TNT,在1863年成功合成,被认为是最早的含能材料。目前,TNT仍然作为熔铸炸药在工业中被广泛使用[4]。继这一突破之后,1,3,5-三硝基-1,3,5三氮杂环己烷(RDX,黑索金)、1,3,5,7-四硝基-1,3,5,7四氮杂环辛烷(HMX,奥克托今)和2,4,6,8,10,12-六硝基-2,4,6,8,10,12-六氮杂异伍兹烷(CL-20)相继出现[5]。数十年后,约为TNT当量1.8倍的八硝基立方烷(ONC)成功合成,预示着第三代高能量密度材料的出现[6]。近几年,主要由氮组成的多氮材料作为新的能量释放化合物得到了广泛关注。
多氮化合物是指分子中具有多个含氮结构单元的一类物质,因此具有较高的氮含量以及较低的碳氢含量。这类化合物往往具有高生成热,是目前理想的高能量密度材料[7]。全氮化合物是指分子全部由氮元素组成的一类物质,是多氮化合物中的重要分支[8]。并且,高氮含量使这类化合物在分解时产生更多的氮气,对环境更加友好,催生出了绿色含能材料的概念。多氮化合物的能量主要来自于氮氮单键、双键和三键的键解离能的巨大差异。三键(N2)最稳定,而单键和双键的能量分别明显小于三键键解离能的1/3和2/3。但由于氮三键、氮单键和氮双键的高能量,多氮化合物常常处于亚稳态[9, 10]。因此,这类化合物的合成和处理是一项重大挑战。此外,与C—C或C—N键相比,对N—N键形成的研究较少,这也是多氮化合物实验合成的另一挑战。本文主要综述了全氮含能材料与氮含量80%以上的多氮含能材料的研究进展与应用前景。
2 全氮含能化合物
氮气(N2)作为空气中含量最高的成分,在1772年由Daniel Rutherford发现[11]。它是最早发现的全氮化合物,也是目前发现的唯一在自然界存在的全氮物质。此后,全氮化合物的发展非常缓慢。目前,只有叠氮离子(N3-)、N5+、五唑阴离子(cyclo-N5-)等离子型全氮化合物和高压下的聚合氮可以被批量制备。随着计算化学的发展,国内外研究人员对许多目前还没有合成的全氮化合物的结构与性能进行了预测。本章对于全氮化合物的综述分为氮原子簇化合物(共价型全氮化合物)、离子型全氮化合物、聚合氮3个部分。
2.1 氮原子簇化合物
氮原子簇化合物是指氮原子通过共价键结合的小分子化合物。对这类化合物的研究集中于理论计算,主要有N4、N6、N8、N10、N60等(图1)[12-16]。对N4报道最多的是四氮烯,但由于感度过高,很难扩展其应用。N4的另一种结构,N4立方烷,还处于理论预测阶段:N4立方烷具有四面体结构,理论计算的生成热为798 kJ·mol-1,密度为3 g·cm-3,爆速为15 700 m·s-1,爆压为125 GPa,比冲为430 s,表现出优异的综合性能。目前报道的N6有六元环状和线性两种结构,环状N6的稳定性不如线性N6结构。和N4立方烷类似,N8立方烷也具有非常高的能量,N8立方烷理论计算的密度为2.65 g·cm-3,生成热为1702 kJ·mol-1,爆速为14 570 m·s-1,爆压为137 GPa,比冲为531 s。N10的理论密度为2.21 g·cm-3,生成热为1981 kJ·mol-1,爆速为12 080 m·s-1,爆压为58.05 GPa。随着C60的发现,研究者们开始对N60展开研究。但研究发现,N60即使在亚稳态情况下也难以存在,合成难度大,目前还未见相关合成方面的报道。氮原子簇化合物理论计算的能量很高,爆速基本都高于10 000 m·s-1,但同时,化学合成困难、稳定性差也是制约其发展的重要原因。

图1 几种典型的氮原子簇化合物
2.2 离子型全氮化合物
2.2.1 N5+含能衍生物
和氮原子簇化合物不同,几种离子型全氮化合物已实现批量合成。1890年,Curtius和Radenhausen首次发现了一种稳定的全氮阴离子——叠氮阴离子(N3-)[17]。叠氮化物在军事、医药、农业等领域有着广泛应用。例如,叠氮化铅是一种典型的起爆炸药,起爆能力强,且安全性较好[18]。叠氮化钠是合成多种炸药的重要中间体[19]。1999年,美国南加州大学Christe教授[20]合成了另一种化合物N5+AsF6-,标志着 N5+离子的成功合成(图2,式(1))。N5+离子是一种具有折线型结构的全氮离子,计算的生成热为1469 kJ·mol-1。其合成过程需要在-78 ℃和无水无氧的条件下进行,实验条件相当苛刻。制备的N5+AsF6-是一种白色固体,微溶于无水HF,在超低温下(-78 ℃)可储存数周,但在常温下稳定性不佳。随后,Christe教授等又陆续报道了N5+SbF6-、N5+Sb2F11-、(N5)2SnF6、N5+SnF5-、N5B(CF3)4等十几种N5+全氮离子盐[21, 22]。N5+SbF6-的合成方法与N5+AsF6-类似(图2,式2),其稳定性有所提高,分解温度为70 ℃,但撞击感度较低。将N5+SbF6-与等摩尔SbF5在HF中反应可生成N5+Sb2F11-(图2,式3)。N5+Sb2F11-是首个通过单晶衍射确定结构的N5+衍生物,结果显示,N5+具有折线型(V型)结构,这与理论计算的结果相一致。总体而言,多数N5+含能盐的稳定性欠佳,容易发生爆炸,因而限制了N5+全氮材料的进一步应用。

图2 3种N5+盐(N5+AsF6-, N5+SbF6-, N5+Sb2F11-)的合成路线[20, 21, 22]
2.2.2cyclo-N5-的合成
研究表明,唑类化合物中的杂环的键长和键角都趋于平均化,环张力减小,且结构中的氮氢体系有利于形成氢键,进一步提高分子的稳定性。五唑阴离子(cyclo-N5-)作为唑环家族的重要成员,是含能材料领域的又一个全氮物质。自2016年以来,cyclo-N5-的合成经历了几个突破性的过程,包括在四氢呋喃溶液中检测到的cyclo-N5-,以及批量合成cyclo-N5-、五唑金属盐以及五唑含能有机盐。
通过在低温下对芳基戊唑(ArN5)进行碱金属处理,Haas等[23]2016年首次在四氢呋喃溶液中直接检测到cyclo-N5-。由于碱金属容易给电子,所以是很好的还原剂。在温和的条件下,碱金属将ArN5转化为相应的自由基阴离子,再热解离生成cyclo-N5-。质谱信号中的m/z=70可证明cyclo-N5-的存在。将此信号归于cyclo-N5-还可以通过15N的单次和双次标记证明,这两次分别观察到了m/z为71和72的信号。通过对m/z=70信号进行进一步的质谱分析,观察到了信号为m/z=42的解离产物,该峰应属于N3-。据报道,在低于40 ℃的温度下N3-是极其稳定的,而它在室温下的半衰期仅为几分钟。随后,Haas等进一步研究了该反应,发现催化剂不太可能是碱金属。较高纯度的溶剂和金属钠虽然可以促进反应,但也导致了cyclo-N5-的收率降低。并且,当使用真空管线和超纯溶剂时,没有检测到任何cyclo-N5-。相反,重金属涂层和暴露于空气中可提供最高的cyclo-N5-产量。在整个反应系统中,作为电子源的富电子基质(例如Na)与可弱氧化/还原的活性钝化层(反应部位例如Na2O)结合在一起对于自由基的形成至关重要[24]。
大量的研究表明,在众多合成cyclo-N5-的前体中只有ArN5是稳定存在的。如何使ArN5的C—N键裂解以生成cyclo-N5-而不发生戊唑N—N键断裂是合成cyclo-N5-的一大难点。2017年,南京理工大学作者团队[25]首次在甘氨酸亚铁(Fe(Gly)2)与间氯过氧苯甲酸(m-CPBA)系统中裂解ArN5而合成了第一个cyclo-N5-化合物,即(N5)6(H3O)3(NH4)4Cl(图3)。Fe(Gly)2与m-CPBA形成过氧化物中间体,这是铁和过氧化物基团共存的结果,既充当氧化还原位点又充当电子源。与在乙腈中的非均相Na/Na2O系统相反,Fe(Gly)2/m-CPBA系统可溶于甲醇,因此形成均相反应。在经过细致的后处理和纯化后,实现了ArN5的裂解,最终固体产物的产率为9%左右。以这种方式合成的cyclo-N5-表现出可接受的稳定性,在116.8 ℃时分解,该分解温度高于N5+(约70 ℃)但低于N3-(高于400 ℃)[26]。Ge等[27]提出了该反应体系中涉及自由基阴离子的新质子转移途径,认为ArN5中C—N键直接裂解的过程是由动力学主导的。但迄今为止,尚无合理的机制来解释该过程。

图3 (N5)6(H3O)3(NH4)4Cl的合成路线图[25]
除了通过ArN5中C—N键裂解生成cyclo-N5-外,Oleynik等[28]报道了另一种可能的合成cyclo-N5-的策略,即将氮化物盐和低温液氮在超高压的金刚石砧室中进行激光加热。激光提供了足够高的能量来克服[3+2]环化势垒,而高压阻止了cyclo-N5-的分解。但在这种极端条件下无法进行直接的实验表征。因此,密度泛函理论计算的XRD图谱和拉曼光谱为cyclo-N5-形成提供了证据。但是,当释放金刚石砧室中的压力时,未观察到cyclo-N5-离子盐,这与环境条件下有机合成策略的结果不一致。
2.2.3cyclo-N5-含能离子盐
金属(尤其是过渡金属)通常可有效地与氮配位,进一步实验研究五唑金属盐化合物,可以获得新的cyclo-N5-衍生物。迄今为止,已制备出多种类型的全氮金属配合物,根据其尺寸可将这些配合物分为盐(0D)和金属-无机骨架(1D和3D)。将适量的金属盐溶解于含有cyclo-N5-的乙醇溶液中,通过复分解反应可生成[Mn(H2O)4-(N5)2]·4H2O (1-1)、[Fe(H2O)4(N5)2]·4H2O (1-2)、[Co(H2O)4(N5)2]·4H2O (1-3)、[Zn(H2O)4(N5)2]·4H2O(1-4)或[Mg(H2O)6(N5)2]·4H2O(1-5)[29, 30]。化合物1-1~1-5的单晶结构列于图4。前4种配合物为Fmmm空间群斜方晶系,具有几乎相同的晶胞排列(a:12.144~12.342 Å;b:17.114~17.444 Å;c:6.465~6.570 Å;α:90°;β:90°;γ:90°;z:4)。五边形的cyclo-N5-通过Z1配位键与金属原子(Mn,Fe,Co或Zn)结合,并且看起来是完全共平面的。各种配合物的cyclo-N5-的N—N键长度不相等,平均N—N键长分别为1.320,1.329,1.314和1.328 Å。每个金属离子(sp3d2杂化的Mn,Fe,Co,Zn)贡献6个空轨道,以容纳来自环cyclo-N5-配体的孤对电子,它们在形成轴向位置的四边形双锥体时被协调,轴向面由来自两个cyclo-N5-的两个氮原子组成,赤道面由来自4个配位水分子的4个氧原子形成。配合物1-1~1-4球棒堆积图表明,金属单元与cyclo-N5-单元碎片全部面对面堆叠,层间距离分别为3.269,3.285,3.233和3.268 Å(等于c/2)。配合物1-5的结构包含一个镁原子,该镁原子被6个水分子水合并且不能与五唑环配位。 因此,每个cyclo-N5-中的每个N原子都通过氢键与水相连,周围的水分子提供了一个亲水性和极性环境,有助于稳定和保护晶体中的cyclo-N5-阴离子。

图4 5种cyclo-N5-的配合物的单晶结构示意图[29, 30]
2017年,许元刚等[29]采用C—N键断裂的方法,合成出一种空气中稳定的灰白色NaN5水合物,将其重结晶后生成[Na(H2O)(N5)]·2H2O(1-6)。化合物1-6是具有正交Cmcm对称性的一维MIF结构,五元环N5-单元和钠原子完美地共平面排列,且cyclo-N5-与Na+依次连接,形成了锯齿状1D结构(图5a)。通过在重结晶过程中将pH调整为弱碱性,成功地从一维钠盐骨架构建出3D结构的类沸石MIF,即[Na8(N5)8(H2O)3]n(1-7)[30]:24个钠离子、12个cyclo-N5-和12个氧原子形成了一个鼓状纳米笼,笼子中央有一个钠离子(图5b)。在化合物1-7的单晶结构中仅观察到这一种类型的纳米笼(Na24N60O12)。张庆华等[31]报道了一个类似的3D框架(MPF-1,1-8),该框架展示了两种类型的纳米笼,即Na20N60和Na24N60。Na20N60小型纳米笼直径约为1.2 nm,由12个五边形和28个六边形组成;而较大的Na24N60纳米笼直径约为1.4 nm,包含12个五边形和24个六边形。两种类型的纳米笼组合成具有沸石MEP拓扑的3D框架。从[100],[010],[001]方向观察时,MPF-1的圆形通道具有8.4 Å大小的孔。计算得出化合物1-7和1-8总容纳量分别为33.5%和33.3%。作为多孔材料,它们的N2吸附容量经计算为2.59和2.5 mmol·g-1(105Pa和273 K)。

图5 [Na(H2O)(N5)]·2H2O(1-6)的单晶结构示意图(a)[29],[Na8(N5)8(H2O)3]n(1-7)的结构及3D框架示意图(b)[30]
除了基于金属钠的MIF外,还使用了N5-与N3-或NO3-结合作为配体,自组装合成了其他3D MIFs,例如[Ba(N5)(NO3)(H2O)3]n(1-9)、[NaBa3-(N5)6(NO3)(H2O)3]n(1-10)、[Cu(N5)(N3)]n(1-11)和[Ag(N5)]n(1-12)[32]。化合物1-9和1-10中的每个N5-采用三齿形螯合模式桥接3个Ba+,而在化合物1-11和1-12中,cyclo-N5-采用四齿形螯合模式桥接4个金属阳离子。其中,与其他五唑3D MIF相比,[Ag(N5)]n表现出较高的爆轰性能(爆速D=7.782 m·s-1,爆压P=34.67 GPa),但感度极高。
N5-的金属盐即使在微尺度下也会在一定温度下爆炸。该现象证实了cyclo-N5-是高能结构,并且其衍生物可以用作高能材料。但是,构成这些盐的主要部分金属阳离子对总能量的贡献很小,并且制备的N5-金属盐通常是水合物,爆炸时水会吸收热量。因此,当前的五唑金属盐的能量是有限的。在高能材料领域中金属盐的潜在应用很少,但可将金属盐充当前体,制备具有更高能量密度的cyclo-N5-非金属盐。
(N5)6(H3O)3(NH4)4Cl是首个文献报道的cyclo-N5-非金属离子盐,N5-通过与周围离子之间形成氢键相互作用而稳定存在[25]。随后的研究集中于将N5-与更高能的阳离子结合以形成更高能量的非金属离子盐。目前已有许多五唑非金属盐被成功合成。由五唑银盐与相应的氯化物进行置换反应,即可生成多种五唑非金属盐,此方法简单高效,收率较高。图6展示了五唑铵盐2-1、五唑肼盐2-2、五唑羟胺盐2-3的合成过程[33, 34]。表1为3种盐与传统含能材料的性能对比[35]。3种盐的密度分别为1.487, 1.585, 1.601 g·cm-3,生成热分别为3.06, 4.17, 3.15 kJ·g-1,爆速分别为7511, 8622, 8779 m·s-1,爆压分别为22.1, 29.5, 31.5 GPa。五唑非金属盐的密度集中于1.4~1.6 g·cm-3之间,相比于传统含能材料较低,甚至低于三硝基甲苯(TNT)的密度。但它们的生成热较高,远高于TNT和RDX,三唑衍生物阳离子的N5-离子盐的生成热更是高达7.19 kJ·g-1。总体而言,多数五唑含能离子盐的爆轰性能低于RDX的性能(爆速8748 m·s-1, 爆压34.9 GPa),少数非金属盐的爆速略高于9000 m·s-1,但未达到预想的高性能。

图6 非金属cyclo-N5-含能离子盐2-1~2-3的合成示意图[33, 34]

表1 五唑非金属盐2-1~2-3的物理化学性能[35]
五唑离子盐性能没有预计高的原因可能是因为在这些高氮五唑离子盐中缺少含氧基团,从而影响了它们的氧平衡以及自有的放热分解反应。近几年,许多研究人员都在为提高五唑非金属离子盐的性能而努力。其中较为有效的一种策略是提高五唑离子盐的氧平衡,进而改善其爆轰性能。2020年,张庆华课题组[36]报道了一种由五唑铵盐(NH4N5)与过氧化氢分子结合的新型五唑含能离子盐NH4N5·1/2H2O2。过氧化氢是一种绿色氧化剂,对环境的污染很小,并且它的溶剂化物对冲击或撞击都不敏感。在NH4N5·1/2H2O2晶体结构中,NH4+、N5-、H2O2分子通过氢键相连,形成了致密的氢键网络。并且,cyclo-N5-是逐层堆叠的,NH4+插入层与层的空隙中并通过氢键连接各层,形成了3D网络结构。NH4N5·1/2H2O2在150 K下的密度为1.51 g·cm-3,生成热为2.178 kJ·g-1,理论爆速为8938 m·s-1,爆压为26.37 GPa。和五唑铵盐(NH4N5)相比,NH4N5·1/2H2O2的性能有了明显提升。
使用胍盐阳离子[37],如CN3H6+(Gu+)和3-氨基-1,2,4-三唑C2H4N4(ATz)代替Na+制备非金属盐,但最终生成了配位聚合物,即(NaN5)5[(CN3H6)N5](N5)3和(NaN5)2(C2H4N4)。Na+和N5-配位形成笼形结构,该笼形结构将胍盐阳离子Gu+捕获在(NaN5)5[(CN3H6)N5](N5)3聚合物中。在(NaN5)2(C2H4N4)配合物中观察到混合配体系统:N5-和ATz分别与Na+配合形成两个独立但交织的网络。由于没有形成结晶水,这些五唑配合物具有高生成热(大于800 kJ·mol-1)。两种配位聚合物的氮含量和生成热都比传统的高能材料(TNT,RDX和HMX)高得多。但与TNT、RDX、HMX和CL-20相比,它们的爆轰性能欠佳,这是因为它们具有多孔结构,密度较低。但从另一个角度来看,这些多孔结构可以封装其他较小的高能材料以提高性能。
2.3 聚合氮
2004年,德国化学家Erements等[38]首次通过激光加热微型金刚石小室内的氮气,在2000 K、110 GPa条件下合成了聚合氮(cg-N)。通过拉曼光谱与X射线衍射测试发现,聚合氮具有立方体偏转结构,与金刚石的结构类似,因此聚合氮也被称为氮金刚石。聚合氮的理论性能非常高,密度为3.9 g·cm-3,爆速为30 000 m·s-1,爆压为660 GPa,比冲为516 s。该能量密度高于目前所报道的所有含能化合物。但直至目前,聚合氮的常规合成方法还未见报道,因此,实现聚合氮的应用还需要很长一段时间,这对研究者来说仍是难题。
3 多氮含能化合物
目前广泛应用的猛炸药主要是硝基官能化的CHON类化合物,包括第一代炸药三硝基甲苯(TNT)、第二代炸药黑索金(RDX)和奥克托今(HMX)以及第三代炸药六硝基氮杂异伍兹烷(CL-20)。除了传统的CHON类含能材料,多氮含能化合物近年来受到了巨大关注。多氮含能化合物与传统CHON含能材料相比,其能量不仅来源于氧化还原反应,还包括大量高能键的断裂,如C—N键、N—N键和N—O键,因而具有更高的能量密度[39]。多氮含能化合物主要由高氮杂环单元、高氮桥联单元以及含能取代基团组成。在所有杂环骨架中,四唑环、四嗪环、三嗪环由于本身的高氮含量(分别为80%、68.3%、51.8%),成为合成多氮含能材料的常用骨架。叠氮基、硝基、氨基是3类有效的含能取代基团。将高氮杂环骨架与高能基团结合,出现了一大批多氮化合物(图7),它们的氮含量为68.27%~93.33%,具有一定的发展潜力。本文主要介绍氮含量高于80%的多氮化合物,包含二元碳氮共价化合物、二元碳氮阴离子、四唑类化合物3类。

图7 几种典型的多氮化合物
3.1 二元碳氮共价化合物
在所有含能取代基团中,叠氮基(—N3)具有最高的氮含量。叠氮酸的金属盐,如叠氮化银(AgN3)、叠氮化铅(Pb(N3)2)及叠氮化钠(NaN3)都具有高爆炸性,并在工业上得到了广泛应用[40, 41]。在所有叠氮基官能化的含能化合物中,有一种仅由C,N两种元素组成的共价化合物,称为二元碳氮化合物(图8)。由于其结构的特殊性和极高的氮含量,引起了众多研究者的兴趣。二元杂环碳氮化合物结构中具有大量的C—N和N—N键,加上叠氮基的高生成热(70 kJ·mol-1),这类化合物往往具有高密度和高生成热,可作为高能量密度材料。在氮杂环含能化学发展之前,二元碳氮化合物多以无环结构的形式出现,如二氰(C2N2)、四叠氮甲烷(CN12)等。其中,CN12由4个叠氮基取代甲烷的4个氢原子,具有最高的氮含量(92.33%),也是所有已合成的多氮化合物中氮含量最高的一种化合物。20世纪初,Ott和Ohse[42]报道了第一个二元杂环碳氮化合物:2,4,6-三叠氮基-1,3,5-三嗪(C3N12),随后,对叠氮杂环含能化合物的研究不断深入。除三嗪外,四唑、四嗪的高氮含量结构也是理想的高氮化合物的骨架,例如二叠氮四嗪(C2N10)、4,4′,6,6′-四叠氮基-偶氮-1,3,5-三嗪(C6N20)、1-二叠氮氨基甲酰基-5-叠氮四唑(C2N14)等[43, 44],它们的含氮量高达79.54%~89.09%。
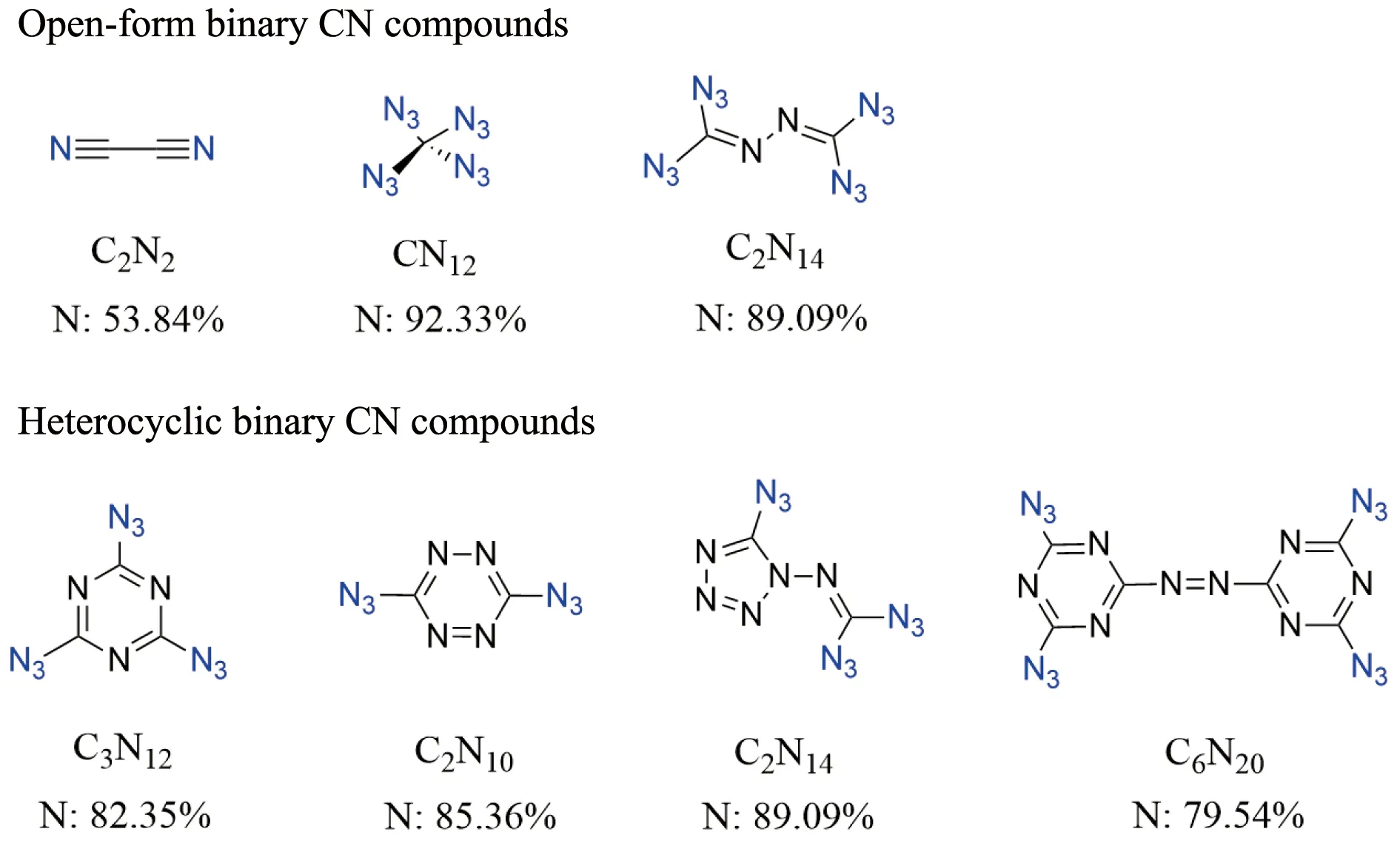
图8 几种典型的二元碳氮化合物
二叠氮四嗪C2N10在1963年由Marcus和Remanick首次报道[45],但未曾有其单晶及物理性质表征。2004年, Huynh等[46]对C2N10的合成进行了研究,并首次得到了单晶结构。由3,6-双(3,5-二甲基吡唑基)-1,2,4,5-四嗪与水合肼发生肼解反应生成3,6-二肼基-1,2,4,5-四嗪后,在酸性条件下进行重氮化反应得到二叠氮四嗪。单晶X射线衍射图谱显示,C2N10呈现出平面结构,且具有人字纹排列的晶胞排布。北京理工大学的庞思平课题组[47]对C2N10的生成热和爆轰性能做了进一步计算研究。在DFT-B3LYP/6-31G*理论水平下,C2N10的生成热为1088 kJ·mol-1,爆速为8450 m·s-1,爆压为31.3 GPa,具有高生成热、高爆速、高爆压的特点。
C2N14是由三氨基胍盐酸盐与二当量的亚硝酸钠反应而成的[44]。在合成过程中,为了引发闭环反应形成四唑环,需要用氢氧化钠溶液调节pH=8。碱性条件对C2N14的合成至关重要,用以防止过量的亚硝酸钠将叠氮基分解,形成胺副产物。测得C2N14熔点为78 ℃,分解温度为110 ℃。该化合物的密度为1.723 g·cm-3,且具有极高的氮含量(89.08%)和高生成热(1495 kJ·mol-1),爆速为8960 m·s-1,爆压为33.9 GPa。但是,由于结构中存在3个叠氮基团,其感度极高,甚至超出了可以测量的范围(撞击感度IS<0.25 J,摩擦感度FS<1 N)。虽然叠氮类的高氮化合物具有高生成热这一高性能特点,但这类化合物的感度偏高,稳定性低,容易分解。因此,目前还无法得到实际应用,需要进一步提高稳定性。
3.2 二元碳氮阴离子
除含能共价化合物外,含能离子盐也是一类具有发展前景的新型含能材料。和二元碳氮化合物相似,二元碳氮阴离子也具有极高的氮含量,由它们衍生出的含能离子盐往往具有较高的生成热与优良的爆轰性能。目前报道过的二元碳氮阴离子主要有5,5′-联四唑阴离子(C2N82-)、偶氮四唑阴离子(C2N102-)、叠氮四唑阴离子(CN7-)以及3,6-双四唑-5-1,2,4,5-四嗪阴离子(C4N122-)等(图9)。

图9 几种典型的二元碳氮阴离子
在所有二元碳氮阴离子中,CN7-因具有最高的氮含量而受到广泛关注。它的前体5-叠氮基-1H-四唑(CHN7)在1939年被首次报道,随后Klapötke等[48]在2008年对CN7-含能离子盐做了系统研究。他们通过去质子化反应合成了5种CN7-金属盐和5种非金属盐,并首次得到了单晶结构。经过计算研究确定了CN7-肼盐、CN7-铵盐与CN7-氨基胍盐的生成热、爆轰性能和比冲性能。和传统炸药RDX相比,这3种CN7-含能离子盐具有优异的爆轰性能(爆速为8424~9231 m·s-1,爆压为24.1~30.6 GPa)。并且,它们也表现出优异的比冲性能(Isp:228~265 s)。但是,CN7-含能离子盐都具有极高的机械敏感度(撞击感度<1 J,摩擦感度:5~7 N)和中等的热分解温度(Td:135~160 ℃)。高感度成为影响CN7-含能化合物发展与应用的重要因素。
2020年,Sun等[49]为了提高CN7-离子盐的稳定性,在羟胺盐CN7-NH3OH+的结构中,又引入了一个NH2OH分子,形成了[NH3OH][CN7][NH2OH]。该化合物在所有已知CN7-含能化合物中具有最优异的性能及最低的感度。它的爆速为9307 m·s-1,爆压为32.5 GPa,整体爆轰性能与HMX相当;撞击感度为10 J,摩擦感度为140 N,优于RDX和HMX。在[NH3OH][CN7][NH2OH]的单晶结构中,NH2OH分子作为连接桥梁,使得其具有3D结构。和CN7-羟胺盐的2D结构相比,这种紧密的3D结构对于分子稳定性以及热稳定性都具有重要作用。并且,该化合物中存在8对氢键,比CN7-羟胺盐多了2对来自N3的氢键和3对来自NH2OH的氢键。这些氢键作用同样表明NH2OH分子的加入对于提高CN7-羟胺盐稳定性的重要意义。

四唑环由于高氮含量,一直是高氮化合物中的常见杂环基团,除其以外,还有另一种高氮骨架,1,2,4,5-四嗪。例如,3,6-二叠氮基1,2,4,5-四嗪是一种高性能的起爆药,3,6-二氨基-1,2,4,5-四嗪-1,4-二氧化物已被作为RDX的替代物进行了研究。将四唑与四嗪相结合是设计高氮含能材料的一种有效策略。3,6-双四唑-5-1,2,4,5-四嗪就是一种典型的四唑与四嗪结合的高氮化合物,且具有较强的酸性。2012年, Klapötke等[52]将它与碱性物质,如氨水、水合肼、三氨基胍等反应合成了一系列C4N122-含能离子盐,包括5种非金属盐和2种金属盐。C4N122-含能离子盐都具有较高的氮含量(57.97%~79.40%)和较高的生成热,因而表现出较好的爆轰性能。其中,C4N122-肼盐具有最高的爆速(8639 m·s-1)和爆压(29.3 GPa),但和RDX相比略显不足。值得注意的是,C4N122-非金属离子盐表现出优异的机械稳定性,撞击感度为35~40 J,摩擦感度为 288~360 N。和前两种二元碳氮离子盐相比,C4N122-含能离子盐的感度得到了明显改善,是理想的低感含能材料。同时研究发现,C4N122-银盐的感度极高,遇火会急速分解爆炸,是一种有发展前景的新型起爆药。
3.3 四唑类含能化合物

由于四唑环的高氮含量,四唑类含能化合物的氧平衡有限。而零氧或正氧平衡对含能材料的密度与性能都具有正向作用。为了提高四唑含能材料的氧平衡,研发了一批四唑N-氧化物衍生物。例如,5-硝基四唑铵盐可以被Oxone氧化为2-N氧化-5-硝基四唑盐,并进一步酸化为2-N氧化-5-硝基四唑,氧平衡为6.10%,密度为1.94 g·cm-3,爆速为9447 m·s-1,爆压为40.4 GPa[59]。Fischer等[60]将叠氮化氰与羟胺反应合成了1-N氧化-5-氨基四唑,其及其羟胺盐均表现出较高的爆速(8609和9056 m·s-1)和较低的机械感度(撞击感度: 10/10 J; 摩擦感度: 108/360 N)。除单环四唑N-氧化物外,双环1N/ 2N-氧化物也相继被报道[61, 62]。1-N氧化-5,5′-联四唑的密度为1.81 g·cm-3,而2-N氧化-5,5′-联四唑的密度为1.95 g·cm-3。2-N氧化物表现出更高的密度与性能,但同时其感度较高。由1-N氧化-5-氨基四唑羟胺盐与高猛酸钾在碱性条件下反应,可生成1,1′-二N氧化-5,5′-偶氮四唑。该N-氧化物的性能比前两种化合物更优异,密度为1.90 g·cm-3,爆速为9548 m·s-1,爆压为42.4 GPa。但其非常敏感(撞击感度<1 J;摩擦感度<5 N),需进一步通过成盐反应提高稳定性。
4 结 语
近年来,全氮与多氮含能材料都取得了一定的研究成果,其中不乏一些高性能、有前景的新型含能化合物。未来全氮、多氮含能材料的发展方向应集中于以下几个方面:
(1)全氮化合物具有高生成热、高爆速爆压的特点,是理想的新一代高能量密度材料。但苛刻的合成条件、极高的合成难度和不稳定性使得全氮含能材料的发展比较缓慢,未来还需要更多的探索。
(2)五唑阴离子仍是研究热点,可对已合成的五唑衍生物进行工艺优化,筛选出综合性能好、稳定性高的含能材料加以应用,并对其真实性能进行评估。
(3)设计和发展更多的高能稳定的全氮离子单元Nx-, Nx+(x=4, 6, 7……),以及组装获得真正意义上的离子型全氮化合物——全氮盐(如N5+N5-, N5+N3-)。
(4)对于聚合氮这类在高压下制备的化合物,应提高目标化合物泄压后的稳定性,并要适当降低合成压力,放大制备规模。前期可对拟高压合成的产物进行理论研究,用理论指导实验。
(5)多氮化合物虽具有优良的爆轰性能,但合成步骤较多,需要寻找更简单、更高效的合成路线。感度与性能之间的矛盾关系,也一直是多氮含能材料急需解决的关键科学问题之一。
总体而言,高性能、高安全性,即高能钝感仍是对未来含能材料的主要要求,既要达到武器装备对含能材料的技术指标要求,又要保障研究人员、生产人员与使用人员的生命安全,含能材料的研究历程艰巨而道远。
