miR-223-3p靶向调控Rbpj转录因子对葡萄膜炎大鼠Th1和Th17细胞分化的影响
2022-05-05周梦贤屈如意殷学伟郭励劼郭大东
周梦贤,屈如意,殷学伟,郭励劼,邱 岩,郭大东
0引言
葡萄膜炎是一种累及到虹膜、睫状肌和脉络膜的临床常见眼内炎症,严重威胁视力,高达35%患者可能会导致视力受损[1]。既往研究表明,自身免疫性葡萄膜炎的主要致炎细胞群有Th1和Th17细胞,两者的细胞比例与葡萄膜炎病程发展密切相关[2-3]。IFN-γ、IL-17分别是Th1、Th17标志性细胞因子,在实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis, EAU)中发挥了重要的致炎作用[4]。Notch信号可通过调控细胞分化和调节炎症反应来维持机体的免疫平衡,并通过诱导初始CD4+T细胞分化为Th1、Th17,从而影响Th细胞之间的比例平衡,进而在葡萄膜炎的病理进程中发挥作用[5]。MicroRNA(miRNA)是一组为18~24个核苷酸长度的非编码RNA分子,主要通过与靶基因的3’UTR结合,以完全或不完全配对的形式降解靶基因的mRNA,或者通过抑制靶基因的翻译,进而调控细胞凋亡、增殖及分化等生理活动[6-8]。研究发现,miR-223-3p能通过抑制转录因子FOXO3的表达促进EAU小鼠中树突状细胞驱动的Th17细胞反应[9]。此外,EAU大鼠虹膜、睫状体和外周血淋巴细胞中均发现与NF-κB信号通路相关的miR-223-3p呈下调表达[10-12],提示miR-223-3p与葡萄膜炎的发生发展关系密切,miR-223-3p有可能成为治疗葡萄膜炎新的作用靶点。Rbpj作为Notch信号通路中一种重要的转录因子,在Notch信号通路的活化中发挥重要作用。生物信息学预测分析表明,Notch信号通路转录因子Rbpj可能为miR-223-3p调控的靶基因,然而miR-223-3p调控Rbpj的表达在葡萄膜炎病理机制中的作用尚不清楚。本研究拟通过双荧光素酶表达报告分析系统,检测荧光强度表达的变化情况,明确miR-223-3p对Rbpj基因的调控作用;实时荧光定量PCR(quantitative PCR, Q-PCR)检测EAU大鼠脾脏、淋巴结和眼组织中miR-223-3p和Rbpj基因的表达情况,ELISA检测Rbpj、IFN-γ、IL-17蛋白的表达水平变化,流式细胞仪检测Th1、Th17细胞水平变化,以初步阐释miR-223-3p对Notch信号通路转录因子Rbpj表达的调控作用以及对葡萄膜炎大鼠Th1、Th17细胞分化的影响,为寻找葡萄膜炎新的治疗靶点、丰富临床基础理论提供帮助。
1材料和方法
1.1材料
1.1.1实验动物选用24只6~8周龄健康雌性Lewis大鼠(北京维通利华公司,北京),体质量160~180g。本研究符合动物伦理学,并经伦理委员会审批通过。
1.1.2主要试剂及仪器高纯度质粒抽提试剂盒(北京天根生化科技有限公司);报告基因检测试剂盒、miRNA转染试剂盒(上海吉满生物科技有限公司);胰蛋白酶、DMEM培养基(美国GIBCO公司);FITC-CD4(北京博奥森生物技术有限公司);PE-IFN-γ,PE-IL-17(美国eBioscience公司);Ficoll淋巴细胞分离液(北京索莱宝公司);RNA组织/细胞快速提取试剂盒(济南思科捷公司);cDNA逆转录试剂盒、2×SYBR GreenⅠ试剂盒(南京诺维赞公司);BCA蛋白定量试剂盒(上海碧云天公司);大鼠EILSA(Rbpj、IFN-γ和IL-4)试剂盒(上海江莱生物技术有限公司);CO2培养箱(美国Thermo公司);LightCycler®480Q-PCR仪(美国Roche公司);多功能酶标仪(美国Perkin-Elmer公司);流式细胞仪(美国BD FACSVerseTM)。
1.2方法
1.2.1实验动物分组及处理把大鼠随机分为正常对照组(NC组)、葡萄膜炎模型组(EAU组)和空白对照组(BC组),每组各8只。预先制备含光感受器间维生素A结合蛋白(interphotoreceptor retinoid- binding protein, IRBP)、完全弗氏佐剂(complete Freund’s adjuvant, CFA)、结核分枝杆菌H37RA(tuberculin, TB)的无菌PBS乳糜液,EAU模型组大鼠在躯干上皮下、后肢两足垫及腹壁两侧各点分别均匀注射200μL以诱导葡萄膜炎,BC组大鼠于相同部位分别注射等体积的不含IRBP的TB+CFA乳糜液,NC组同法注射等体积的无菌生理盐水。各组大鼠不同处理条件干预后第12d,按照5%苯巴比妥溶液(按50mg/kg体质量的比例)腹腔注射麻醉处死大鼠,迅速分离各大鼠脾脏、淋巴结和眼组织用于以下实验研究。
1.2.2双荧光素酶检测miR-223-3p调控Rbpj基因应用生物信息软件预测miR-223-3p与Rbpj基因的结合位点;将Rbpj基因的3’UTR序列及其突变体克隆到双荧光素酶报告基因载体中,构建野生型及突变型重组双荧光素酶报告质粒载体,采用PCR及基因测序方法鉴定载体是否构建成功。将构建好的野生型和突变型双荧光素酶报告载体,通过mimic+Rbpj野生型,mimics NC+Rbpj野生型, mimic+Rbpj突变型,mimics NC+Rbpj突变型进行共转染,转染后48h以空白细胞裂解液作为参比,测定相对光单位(relative light unit, RLU)值。
1.2.3Q-PCR检测大鼠脾脏和淋巴结及眼组织中miR-223-3p与Rbpj基因的表达免疫后12d,各组大鼠随机各选取3只,分离脾脏、淋巴结和眼组织,用RNA组织/细胞快速提取试剂盒提取miRNA和总RNA,K5600光分度计检测RNA的纯度和浓度(A260/A280为1.8~2.1)。将提取的miRNA和总RNA逆转录成cDNA,采用Q-PCR技术检测miR-223-3p、Rbpj基因的表达水平,其中U6为miR-223-3p的内参,GAPDH为Rbpj基因的内参。U6的反转录引物为5’-CGC TTC ACG AAT TTG CGT GTCAT-3’,miR-223-3p反转录引物为5’-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG ACG GGG TA-3’。miR-223-3p、Rbpj、U6和GAPDH的PCR引物序列见表1。Q-PCR反应条件为:95℃ 5s,循环1次;95℃ 20s,57℃ 25s,60℃ 25s,循环45次。Q-PCR检测结束后,按照2-ΔΔCt方法计算miR-223-3p、Rbpj基因表达情况,并进行统计分析。实验重复3次。

表1 miR-223-3p、Rbpj、U6和GAPDH引物序列
1.2.4ELISA检测大鼠脾脏和淋巴结及眼组织中Rbpj与IFN-γ和IL-17蛋白的表达水平免疫后12d,每组大鼠随机各选取2只,分别收取各组大鼠的脾脏、淋巴结和眼组织,放入无菌EP管中,然后加入400μL RIPA裂解液和4μL PMSF,待充分混匀后电动匀浆5min,使组织裂解完全。将样品管插入冰中,超声波细胞粉碎机超声20min,高速离心机离心8000r/min,4℃10min后,收取上清液。BCA法测定各组蛋白浓度,ELISA试剂盒检测Rbpj、IFN-γ和IL-4蛋白的表达水平。实验重复3次。
1.2.5流式细胞仪检测大鼠脾脏和淋巴结及眼组织中Th1和Th17细胞水平免疫后12d,每组大鼠随机各选取3只,取各组大鼠脾脏、淋巴结和眼组织研磨后用40μm细胞筛网过滤,尼龙毛富集T淋巴细胞,然后用大鼠淋巴细胞分离液进一步纯化得到T淋巴细胞,加入4μL细胞刺激混合剂(包含cocktail刺激液和Golgistop蛋白转运抑制剂),振荡器涡旋10s充分混匀。先用FITC-CD4进行细胞表面染色,然后对细胞行固定破膜,然后分别用PE-IFN-γ和PE-IL-17进行胞内染色,振荡器涡旋10s充分混匀。染色结束后用细胞洗涤液清洗2次细胞,离心去上清。最后每管加300μL PBS重悬细胞,滤网过滤,流式细胞仪检测各组大鼠Th1、Th17细胞表达水平并分析结果。实验重复3次。
2结果
2.1miR-233-3p调控Rbpj基因双荧光素酶报告基因表达分析结果显示,与正常对照组相比,miR-233-3p对Rbpj基因野生型的值有较显著的下调表达,然而对其预测靶基因位点进行突变后,突变型载体中的RLU值表达水平未见明显改变(图1)。由此可见,miR-223-3p可明显调控带有Rbpj基因片段3’UTR基因的表达,Rbpj为miR-223-3p调控的靶基因。

图1 miR-223-3p与质粒载体转染靶细胞后Rbpj的表达水平 bP<0.01 vs miR-阴性对照组。
2.2EAU大鼠脾脏和淋巴结及眼组织中miR-233-3p与Rbpj基因的表达水平Q-PCR检测发现,BC组大鼠脾脏、淋巴结和眼组织中miR-233-3p、Rbpj基因的表达水平与NC组大鼠相比无明显变化(均P>0.05);与NC组大鼠相比,免疫后12d,miR-223-3p在EAU模型组大鼠脾脏、淋巴结和眼组织中的表达水平分别为0.33±0.29、0.11±0.12、0.18±0.11呈显著下调表达(均P<0.05);Rbpj mRNA水平均呈上调表达,分别为3.00±0.06、1.52±0.12、3.01±0.34,差异具有统计学意义(均P<0.05),见表2。

表2 免疫后12d三组大鼠脾脏、淋巴结和眼组织中miR-223-3p、Rbpj基因的表达水平
2.3Rbpj和IFN-γ及IL-17蛋白的表达水平ELISA检测结果显示,BC组大鼠脾脏、淋巴结和眼组织中Rbpj、IFN-γ和IL-17蛋白的表达水平与NC组大鼠相比无明显变化(均P>0.05);相比于NC组大鼠,免疫后12d的EAU模型组大鼠的脾脏、淋巴结和眼组织中Rbpj、IFN-γ和IL-17蛋白水平均呈明显的上调表达,且差异具有统计学意义(均P<0.05),见表3。

表3 免疫后12d三组大鼠脾脏、淋巴结和眼组织中Rbpj、IFN-γ和IL-17蛋白的表达水平
2.4大鼠脾脏和淋巴结及眼组织中Th1与Th17细胞水平免疫后12d,流式细胞仪分别检测三组大鼠脾脏、淋巴结和眼组织中Th1、Th17细胞水平,发现BC组大鼠与NC组大鼠相比,各组织中Th1和Th17细胞水平差异无统计学意义(均P>0.05)。与NC组相比,EAU模型组大鼠各组织中Th1和Th17细胞水平明显升高,见表4,图2、3。
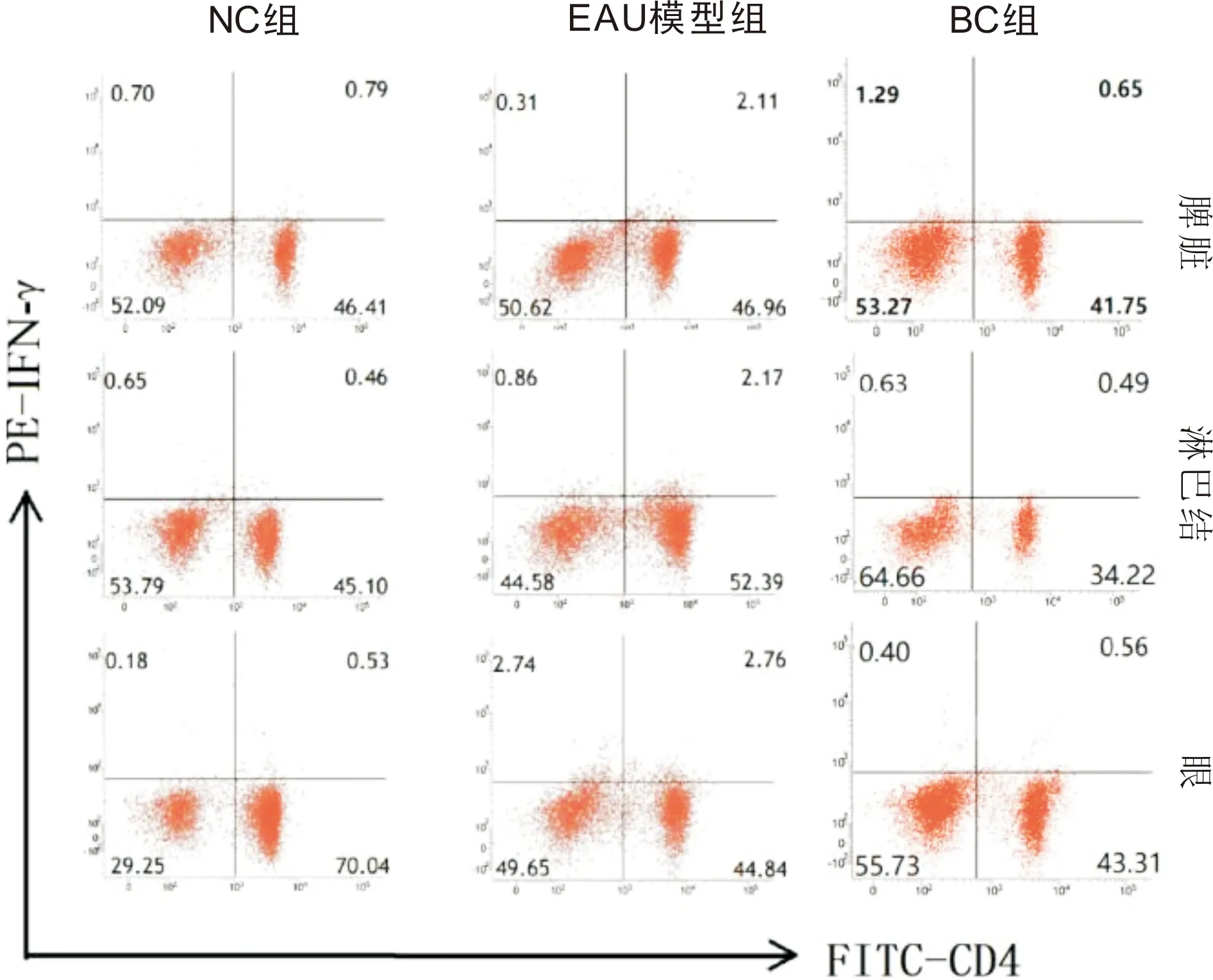
图2 流式细胞仪检测不同条件处理后第12d各组大鼠脾脏、淋巴结和眼组织细胞中Th1细胞水平变化。

表4 免疫后12d三组大鼠脾脏、淋巴结和眼组织中Th1、Th17细胞水平
3讨论
葡萄膜炎是一类眼科常见、以眼内炎症为特征的自身免疫性疾病,常伴有眼疼、畏光、前房积脓和玻璃体混浊等。目前,葡萄膜炎的发病机制尚不完全清楚,临床治疗主要依赖激素和免疫抑制剂,复发率高,长期使用易产生药物依赖性,导致严重的并发症,其诊疗已属于世界性难题。研究发现,Th1、Th17细胞是诱导葡萄膜炎发病的关键因素,Th1和Th17细胞因子主要介导促炎作用,Th1和Th17与其分泌的标志性细胞因子IFN-γ、IL-17共同参与了葡萄膜炎的发生发展[13]。葡萄膜炎的免疫调节涉及多条信号通路,其中Notch信号通路是维持机体免疫平衡的重要信号通路,在细胞因子的刺激下可调控初始CD4+T细胞分化为Th1、Th17等效应细胞进而影响Th细胞之间的比例平衡,并影响葡萄膜炎的病理过程[14-15]。转录因子Rbpj是Notch信号通路活化过程中所必须的,在哺乳动物中已发现的4种受体Notch1~4均可通过关键性转录因子Rbpj调节下游基因的表达,敲除Rbpj即可阻断全部Notch信号通路[16-17]。
MicroRNAs(miRNAs)是一类短片段的内源性非编码RNA分子,能直接结合特定的mRNA靶分子的3’端非翻译区而使其降解并抑制蛋白质的合成,从而以负反馈调节方式发挥免疫调控作用[18]。越来越多的证据表明,miRNAs可通过调节Th细胞分化在自身免疫性疾病的发病机制中发挥重要作用。Chen等[19]研究发现,miR-223-3p在实验性自身免疫性心肌炎小鼠中的表达明显低于正常小鼠。miR-223-3p可抑制NLRP3炎症小体的表达,促进树突状细胞(dendritic cell, DC)向耐受性DC表型分化。miR-223-3p通过抑制抗原递呈树突状细胞的功能,有效诱导调节性T细胞(Treg)的产生,提示miR-223-3p参与诱导耐受性树突状细胞的表型并调节自身免疫性心肌炎的耐受性;Shi等[20]发现,miR-219a-5p通过抑制Th1/Th17介导的免疫反应抑制肠道炎症的发展进程,提示miR-219a-5p可能是肠道炎症治疗的新靶点;Cruz等[21]证实,miR-27在小鼠T细胞中的过表达可抑制调节性T(Treg)细胞的分化,导致Treg功能紊乱,进而造成小鼠免疫耐受功能障碍。

图3 流式细胞仪检测不同条件处理后第12d各组大鼠脾脏、淋巴结和眼组织细胞中Th17细胞水平变化。
目前,国内外多名学者围绕miRNAs在葡萄膜炎病理机制中的作用开展了相关的研究。Zhang等[22]研究表明,miR-182-5p对EAU小鼠TAF15的调控,可通过抑制STAT3磷酸化来负性调节Th17细胞的发育,从而发挥治疗葡萄膜炎的作用。Muhammad等[23]研究证实,脾脏组织产生的miR-155可抑制黑皮质素5受体依赖的抑制性巨噬细胞(suppressor macrophages),加剧了EAU的发展在实验性自身免疫性前葡萄膜炎(experimental autoimmune anterior uveitis,EAAU)的研究中,Hsu等[10]发现miRNA的动态变化会促进核因子κB(nuclear factor kappa B, NF-κB)的活化,进而激活下游Th1和Th17特异性细胞因子和效应T细胞,最终引起光感受器细胞凋亡,进一步研究发现,与NF-κB信号通路相关的miR-223-3p、miR-146a-5p、miR-155-5p和miR-147b在葡萄膜炎大鼠虹膜、睫状体中呈现低水平表达,而miR-182-5p、miR-183-5p和miR-9-3p呈现高水平表达。Wei等[9]研究发现,miR-223-3p能通过抑制转录因子FOXO3的表达促进EAU小鼠中树突状细胞驱动的Th17细胞反应,上述研究提示miR-223-3p有可能成为治疗葡萄膜炎新的作用靶点。
生物信息学预测分析和本研究均表明,Notch信号通路的转录因子Rbpj基因为miR-223-3p调控的靶基因。Q-PCR结果显示,与NC组相比,免疫12d后的EAU大鼠的眼、脾和淋巴结组织中miR-223-3p显著下调,然而其调控的靶基因Rbpj的表达明显升高。ELISA检测结果发现,EAU模型组大鼠各组织Rbpj、IFN-γ和IL-17蛋白表达水平均明显高于NC组,流式检测表明EAU模型组Th1和Th17细胞比例明显升高,提示Th1和Th17细胞比例失衡与机体的免疫微环境改变有关,失衡的Th1和Th17与葡萄膜炎的发生发展密切相关。
综上所述,我们发现miR-223-3p可负调控Notch信号通路转录因子Rbpj的表达,EAU大鼠中miR-223-3p的下调表达可提高Rbpj基因和蛋白的表达水平,影响Th1和Th17细胞的分化及相关分子IFN-γ和IL-17的表达水平,进而影响葡萄膜炎的发生发展。本研究初步阐释了miR-223-3p对Notch信号通路转录因子Rbpj表达的调控作用以及对葡萄膜炎大鼠Th1、Th17细胞分化及IFN-γ和IL-17的影响,对寻找葡萄膜炎新的治疗靶点、丰富临床基础理论具有重要意义。
