热休克蛋白70促进急性肺损伤小鼠肺部炎症反应*
2022-05-05王梓璇冀彩丽华梦晴宋传旺
陈 艳, 王梓璇, 冀彩丽, 华梦晴, 宋传旺
蚌埠医学院检验医学院免疫学教研室,慢性疾病免疫学基础与临床安徽省重点实验室,蚌埠 233030
急性肺损伤(acute lung injury,ALI)是急性全身炎症过程的肺部表现,ALI的主要特征为弥漫性肺泡损伤、肺水肿形成、中性粒细胞源性炎症。临床上表现为肺顺应性降低,严重低氧血症,双侧肺浸润。ALI是临床上常见的危重症,死亡率高达40%左右[1-2]。热休克蛋白70(heat shock protein 70,HSP70)是热休克蛋白家族中最常见成员,分子量约70 kD。正常情况下HSP70在细胞内表达水平较低,而在高温及各种有害应激状态下,HSP70的合成增加[3]。HSP70通常被认为是细胞内分子伴侣,参与新生肽链的折叠与装配、蛋白的跨膜运送、热变性蛋白的修复等[4]。但有研究发现HSP70也存在于细胞外,特别是在特定的应激条件下,HSP70能刺激原代气道上皮细胞的促炎反应,诱导炎症细胞因子的释放[5-6]。有学者在慢性阻塞性肺部疾病患者的肺组织中发现了与疾病严重程度相关的HSP70表达升高,并且当HSP70被分泌到细胞外时可引发炎症反应[7-8]。另有研究表明HSP70可从病毒感染的气道上皮细胞释放,导致中性粒细胞的募集和激活[9]。考虑HSP70与中性粒细胞的募集、激活及炎症反应有关,因此可能参与了ALI的发病,本研究构建ALI模型小鼠,并鼻滴HSP70抗体(anti-HSP70)阻断HSP70的作用,检测小鼠肺组织炎性细胞浸润、肺干/湿重比和炎性因子产生情况,以观察HSP70对ALI发病的影响。
1 材料与方法
1.1 主要试剂与仪器
胎牛血清为杭州四季青生物技术有限公司产品;脂多糖(lipopolysaccharide,LPS)购自美国Sigma公司;重组小鼠HSP70蛋白、anti-HSP70购自美国Abcam公司;HSP70、肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)ELISA检测试剂盒购自武汉华美生物工程有限公司;DMEM高糖培养液购自美国Hyclone公司;GAPDH抗体、HSP70抗体购自武汉三鹰生物技术有限公司;胰酶组织细胞消化液、聚丙烯酰胺凝胶(SDS-PAGE)凝胶配置试剂盒、NP-40蛋白裂解液、BCA蛋白浓度测定试剂盒、HRP标记山羊抗小鼠IgG、聚偏二氟乙烯膜膜(PVDF膜)购自碧云天生物技术有限公司。
1.2 肺泡上皮细胞株MLE-12的培养和实验处理
小鼠肺泡上皮细胞株购于上海纪宁实业公司。MLE-12细胞在含10%胎牛血清(FBS)的DMEM高糖培养液中,5%CO2和37℃培养条件下进行培养,0.25%胰酶消化,隔日进行1次传代。实验前取对数生长期细胞,以1×105/mL接种12孔板,继续培养6 h后备用。
1.2.1 anti-HSP70作用的MLE-12细胞模型 培养贴壁的细胞中加入LPS 500 ng/mL继续刺激12 h,加入anti-HSP70(200 ng/mL)处理12 h,收集细胞上清,8000 r/min离心5 min,取上清液,使用ELISA法检测促炎性细胞因子TNF-α和IL-1β的含量。
1.2.2 HSP70作用的MLE-12细胞模型 培养贴壁的细胞中加入不同浓度(10~500 ng/mL)HSP70刺激24 h,加入与布孔细胞等量的FITC标记的凋亡细胞继续培养4 h,4%台盼蓝淬灭细胞外荧光10 min,PBS清洗3次,收集细胞,流式细胞仪检测吞噬率的变化。
1.3 原代小鼠肺泡上皮细胞的分离培养与处理
ICR小鼠(购于安徽医科大学实验动物中心)气管插管后用PBS进行支气管肺泡灌洗,尽可能去除支气管肺泡中白细胞。然后通过肺动脉用PBS灌洗小鼠肺部,直至肺部变白。小心取出双肺置于预冷的PBS液中,清洗2~3次,剪碎肺组织,加入胰酶(0.25%)、胶原酶(40 μg/mL)和DNA酶(100 μg/mL)37℃消化30 min,消化液1500 r/min离心10 min后弃上清,加入含10% FBS的DMEM高糖培养液重悬细胞沉淀,将细胞悬液收集入培养皿中于5%CO2和37℃温箱中培养2 h,将非粘附细胞收集后接种于预先铺有胶原的培养皿中继续培养,持续观察细胞生长的状态和形态特征,约1周左右细胞状态良好,采用磁珠分选法去除CD45阳性细胞。收集CD45阴性细胞即为肺泡上皮细胞(alveolar epithelial cells,AECs),使用含10%FBS的DMEM重悬后进行计数,接种于预先铺有胶原的6孔板中,置于细胞培养箱中继续培养24 h。随后以HSP70刺激24 h,再加入与接种细胞等量的FITC标记的凋亡细胞继续培养4 h,收集细胞使用流式细胞仪检测吞噬率的变化。
1.4 急性肺损伤动物模型的建立及实验分组处理
雌性ICR小鼠(8~10周龄,25~30 g)随机分为4组:正常对照组、ALI组、anti-HSP70+ALI组、同型IgG+ALI组。ALI模型小鼠采用LPS(5 mg/kg)经鼻腔滴入1次激发形成;正常对照组使用等量磷酸盐缓冲液PBS滴鼻;anti-HSP70+ALI组在小鼠用LPS滴鼻前2 h以及滴鼻后6 h,经气道滴入anti-HSP70(0.25 mg/kg);同型IgG+ALI组则采用等剂量的同型IgG代替anti-HSP70对ALI模型小鼠进行预处理。各组小鼠在气道滴入PBS或LPS 24 h后,取支气管肺泡灌洗液和肺组织进行后续检测。
1.5 肺组织病理学检测
取各组小鼠肺组织,4%多聚甲醛固定24 h,全自动组织脱水机脱水透明12 h,石蜡包埋,切片机上将石蜡块切成5 μm厚的薄片。切片后使用不同浓度的二甲苯进行脱蜡,高浓度到低浓度乙醇浸泡处理后行苏木精-伊红(hematoxylin-eosin staining,HE)染色,二甲苯透明,中性树脂封片,显微镜下观察拍照。肺损伤评分采用Smith评分法对肺间质水肿、中性粒细胞浸润、肺泡与间质出血、气道上皮损伤、透明膜形成等方面分别进行评分。无损伤为0分;损伤面积<25%为1分;损伤面积25%~为2分,损伤面积50%~为3分;损伤面积75%~为4分。每组选取5个高倍(×400)显微镜视野,取其平均值,计算肺组织学评分。
1.6 肺泡灌洗液中细胞计数与染色
用PBS灌洗小鼠肺组织,收集5 mL灌洗液,1500 r/min离心5 min,弃去上清,将细胞沉淀加入100 μL含10%血清的PBS,混匀后取10 μL滴加于玻片上,轻轻涂布均匀至1 cm2左右,在超净台中自然风干,加入固定液覆盖整个标本,在超净工作台中自然风干,随后滴加改良瑞士染液,覆盖整个标本,洗耳球轻柔吹打充分混匀,染色5 min,细流水冲洗,待玻片晾干后于显微镜下进行分类计数。
1.7 小鼠肺组织湿/干重比测定
各组小鼠解剖后,小心取出其肺组织放置在PBS中,清洗2遍以去除其表面的血液。将肺组织放置在吸水纸上,除去其表面的水分,然后统一称量右肺的质量,记录为湿重(W);紧接着将右肺组织放置在干燥箱中48 h至肺组织质量恒定后取出称取质量,记录为干重(D),计算各组小鼠肺组织的湿/干重比(W/D)。
1.8 流式细胞术检测吞噬作用
完成实验处理的MLE-12或原代AEC细胞用4%台盼蓝淬灭细胞外荧光10 min,PBS洗涤3次,再用0.25%胰酶消化,终止消化后离心,吸弃上清,4%多聚甲醛固定,使用DxP Athena流式细胞仪检测吞噬凋亡细胞情况。
1.9 免疫印迹实验
取小鼠肺组织,匀浆后采用NP-40裂解液提取蛋白,BCA法进行蛋白定量。取等量蛋白在8% SDS-PAGE凝胶中电泳(70 V,30 min转110 V,1 h),转移蛋白到PVDF膜上(200 mA,2 h),以5%工业脱脂奶粉室温封闭2 h,一抗(HSP70抗体,稀释度1∶5000)4℃孵育过夜,TBST洗膜后以HRP标记的二抗(HRP-山羊抗小鼠IgG,稀释度1∶5000)孵育2 h,增强化学发光法显影。以目的条带和GAPDH条带灰度比值对蛋白表达水平进行半定量。
1.10 酶联免疫吸附实验
收集小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的离心上清,及分组处理后的细胞培养上清,按照ELISA试剂盒操作说明,检测其中HSP70、TNF-α、IL-1β、IL-6的含量。根据酶标仪测得的A450 nm值,制作标准曲线,计算浓度。
1.11 统计学方法

2 结果
2.1 急性肺损伤小鼠肺组织和BALF中HSP70产生增加
首先以免疫印迹法和酶联免疫吸附实验检测ALI小鼠肺组织及BALF中HSP70含量。与对照组比较,ALI小鼠肺组织中HSP70的表达增加(P<0.01,图1A),BALF中HSP70分泌增多(P<0.01,图1B)。这些结果提示本研究采用的ALI模型小鼠肺组织HSP70产生增加。

A:免疫印迹法检测小鼠肺组织中HSP70表达;B:酶联免疫吸附实验检测小鼠BALF中HSP70含量;与正常对照组(Control)比较,**P<0.01图1 ALI模型肺组织和BALF中HSP70产生增加Fig.1 HSP70 was increased in lung tissues and BALF of ALI model
2.2 anti-HSP70减轻ALI模型小鼠的肺部炎症
采用anti-HSP70滴鼻以阻断HSP70的效应,检测肺组织病理改变及炎症情况。HE染色结果显示,与正常对照组小鼠比较,ALI小鼠肺组织中多形核中性粒细胞(PMN)明显增加,肺泡充血和渗出明显,炎症细胞浸润增加;与ALI组相比,anti-HSP70+ALI组小鼠肺组织中炎性细胞浸润减少,肺泡充血与渗出情况有所好转(图2A)。肺泡灌洗结果显示,anti-HSP70滴鼻处理后,与ALI组比较,anti-HSP70+ALI组小鼠BALF中HSP70的含量降低(图2B,P<0.05),TNF-α、IL-1β、IL-6等炎性因子的分泌减少,蛋白含量明显减少(图2C、2D,均P<0.05),PMN数目减少(图2E,P<0.05)。anti-HSP70滴鼻处理还使ALI小鼠肺湿/干重比值明显降低(图2F,P<0.05)。

1:Control;2:ALI;3:anti-HSP70+ALI;4:IgG+ALI;A:HE染色评价肺组织损伤(×200);B:酶联免疫吸附实验检测小鼠BALF中HSP70含量;C:酶联免疫吸附实验检测小鼠BALF中TNF-α、IL-1β、IL-6含量;D:BALF中蛋白含量测定;E:BALF中多形核中性粒细胞计数;F:肺组织湿/干重比;与正常对照组(Control)比较,*P<0.05 **P<0.01;与ALI组比较,#P<0.05图2 HSP70抗体对ALI模型小鼠肺部炎症的影响Fig.2 Effect of HSP70 antibody on lung inflammation in ALI mouse model
2.3 anti-HSP70降低LPS诱导的MLE-12细胞炎性细胞因子的产生
酶联免疫吸附实验显示,与LPS组比较,HSP70抗体预处理的anti-HSP70+LPS组培养上清中TNF-α、IL-1β含量下降(均P<0.05,图3)。

1:Control;2:LPS;3:anti-HSP70+LPS;4:IgG+LPS;与Control组比较,**P<0.01;与LPS组比较,#P<0.05图3 HSP70抗体对LPS刺激的MLE-12细胞分泌炎性细胞因子的影响Fig.3 Effect of HSP70 antibody on inflammatory cytokine secretion of LPS stimulated MLE-12 cells
2.4 HSP70减弱肺泡上皮细胞吞噬凋亡细胞的作用
为探讨HSP70促进ALI小鼠肺部炎症的可能机制,我们观察了HSP70对肺泡上皮细胞吞噬凋亡细胞的影响。采用不同浓度(10~500 ng/mL)的HSP70刺激肺泡上皮细胞株MLE-12细胞后,流式细胞术检测发现100~500 ng/mL的HSP70可抑制MLE-12细胞对凋亡细胞的吞噬,其中以200 ng/mL浓度组的抑制作用最为明显(P<0.01,图4A、4B)。进一步观察HSP70对原代AECs吞噬凋亡细胞作用的影响。首先提取分选的小鼠原代AECs经流式细胞术检测,符合肺泡上皮细胞表型CD45-EPCAM+的细胞纯度大于95%(图5);将分选得到的小鼠原代AECs培养贴壁后加入200 ng/mL HSP70刺激24 h,流式细胞术检测其对凋亡细胞的吞噬变化,结果显示原代AECs的吞噬率降低(P<0.01,图6)。
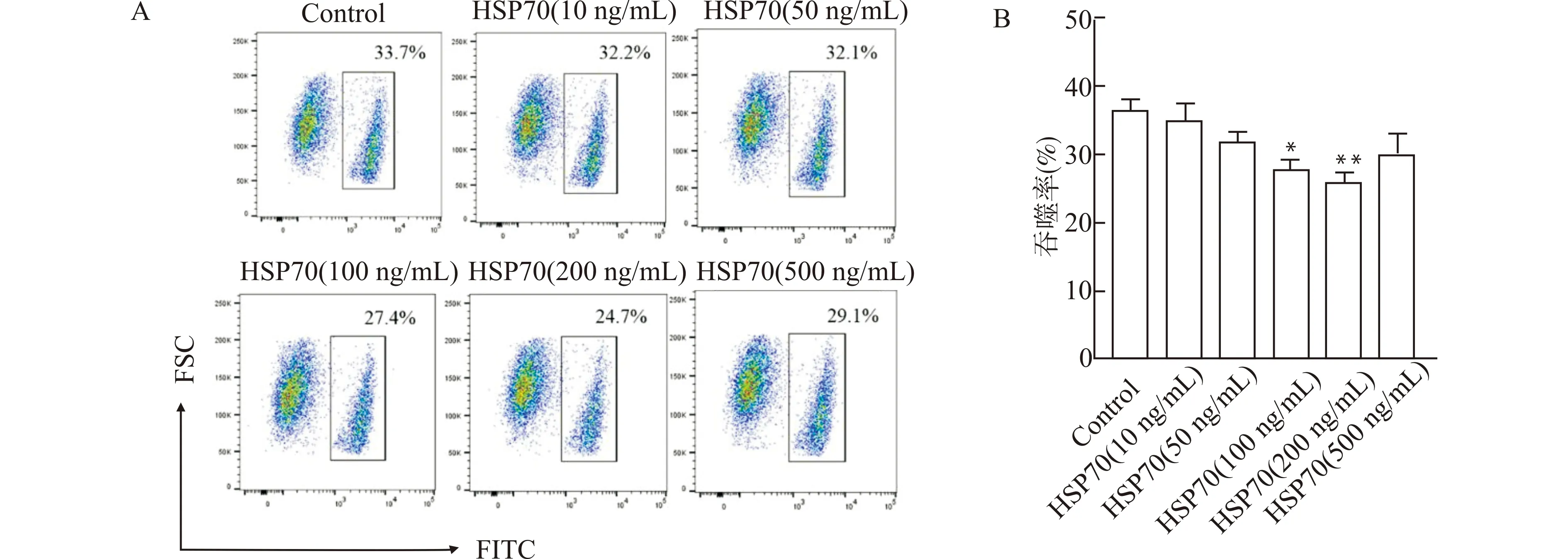
A:检测MLE-12细胞吞噬作用的流式图;B:流式统计图,与Control组比较,*P<0.05**P<0.01图4 HSP70对MLE-12细胞吞噬凋亡细胞的抑制Fig.4 Inhibitory effect of HSP70 on phagocytosis of apoptotic cell by MLE-12 cells

A:普通光学显微镜下所见(×40);B:流式检测分选,显示CD45-/EPCAM+细胞>95%图5 原代培养肺泡上皮细胞的鉴定Fig.5 Identification of primary alveolar epithelial cells
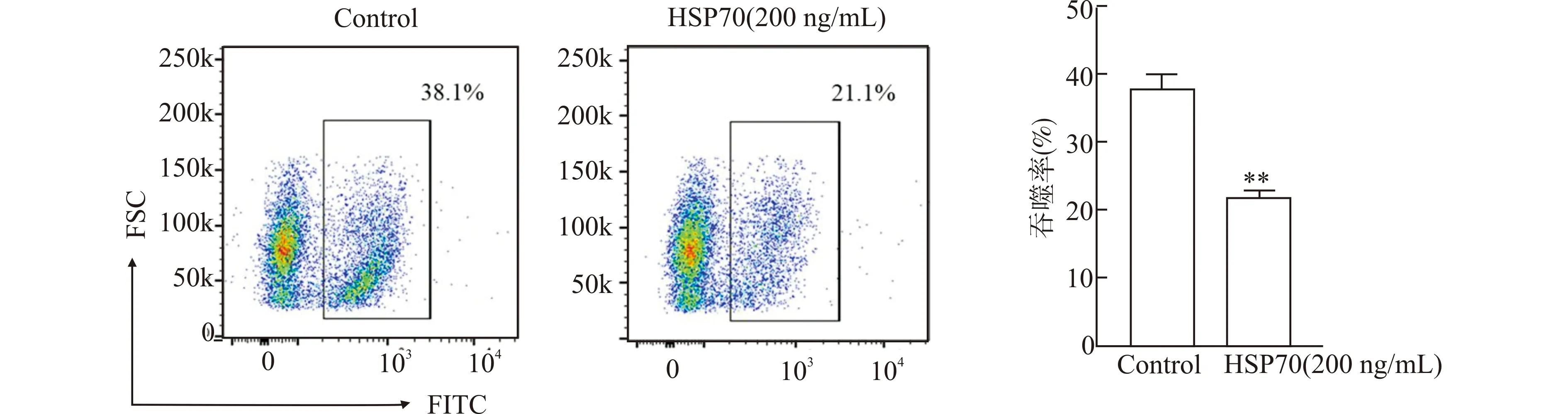
与Control组比较,**P<0.01图6 HSP70(200 ng/mL)对原代肺泡上皮细胞吞噬功能的抑制作用Fig.6 Inhibitory effect of HSP70(200 ng/mL)on phagocytosis function of primary alveolar epithelial cells
3 讨论
HSP70是热休克蛋白家族成员之一,分子量约为70 kD,是普遍存在的分子伴侣[10]。机体在高温及微生物感染等应激状态下HSP70的产生会增加[11-12],如高血压、急性感染患者外周血液中HSP70含量增加[13-14]。最近有报道表明,在霉菌毒素刺激下,大鼠肺组织中HSP70的表达显著增加[15]。本研究也证明HSP70在ALI小鼠中肺组织的表达和肺泡灌洗液中的分泌均增加,提示HSP70在ALI中可能有重要作用。本研究结果显示,使用anti-HSP70滴鼻能减弱ALI导致的小鼠肺泡中性粒细胞数量增多及炎性细胞因子(TNF-α、IL-1β、IL-6)生成的增加,并能降低肺蛋白含量,有助于减轻肺水肿,说明HSP70促进ALI肺部炎症进展。肺泡上皮细胞在ALI进展中起关键作用,LPS可诱导小鼠肺上皮MLE-12细胞促炎细胞因子(TNF-α、IL-1β)表达水平升高[16]。我们的结果显示在LPS刺激的MLE-12细胞中加入anti-HSP70后TNF-α、IL-1β生成量减少。有研究表明,HSP70不仅能激活气道上皮细胞促炎基因的表达,还可刺激其NLRP3炎症小体、IL-1β和ATP的释放,从而加重慢性阻塞性肺疾病(COPD)患者的病情并影响预后[9,17]。HSP70在中性粒细胞吞噬结核分枝杆菌过程中,触发巨噬细胞释放IL-6、TNF-α、IL-1β等促炎细胞因子,从而促进炎症反应[18]。另外,HSP70可诱导心肌细胞血管内皮细胞粘附分子(ICAM-1)和IL-6的表达增加,引起心肌细胞的炎症和收缩力下降[19]。这些研究均提示HSP70有促炎作用,本研究结果与之一致。
吞噬作用是宿主细胞对病原微生物和凋亡细胞的特异性识别和吞噬,是机体抗感染和维持组织稳态的重要过程[20]。AECs参与构成肺泡屏障,ALI发生时AECs受损,其损伤后释放的炎性介质启动了复杂的炎性反应,由于AECs数量较多,因此AECs在ALI/ARDS发生发展中起到重要作用[21-22]。AECs通过吞噬作用清除凋亡细胞,减轻ALI的炎症反应,因此AECs对凋亡细胞的吞噬有助于ALI气道炎症的消退,从而有助于重塑肺泡屏障[23]。凋亡细胞的有效清除对维护机体内环境的稳态至关重要,如果正常细胞对凋亡细胞的清除能力受损或细胞死亡超过正常细胞的清除能力,凋亡细胞通过自身以及诱导正常细胞释放促炎介质(IL-1和TNF-α等),进一步诱导炎症反应[24]。本研究发现HSP70可抑制AECs对凋亡细胞吞噬,说明其延长了死亡细胞来源炎性内容物的刺激时间,这也可能是HSP70促进ALI肺部炎症的原因。细胞外HSP70可以与上皮细胞RAGE受体相互作用,并且随着RAGE表达降低,HSP70启动的ERK1/2激活和和NF-κB转录及前炎症因子产生减少,说明RAGE是上皮细胞表面识别HSP70的受体[25]。另外,有研究表明,CD91也是巨噬细胞识别HSP70的受体[26]。由于RAGE和CD91都是吞噬凋亡细胞时用来识别磷脂酰丝氨酸的受体[27],因此可能是HSP70与这些受体相互作用后,占据了这些受体,影响了对凋亡细胞的识别和吞噬,这也可能是我们的研究中HSP70抑制AECs吞噬凋亡细胞的原因。
综上所述,HSP70促进了ALI小鼠肺部炎症反应,这可能是由于HSP70抑制了肺泡上皮细胞对凋亡细胞的吞噬所致。
