骨化三醇通过NF-κB信号通路促进牙周膜成纤维细胞分化
2022-05-05石金双刘金艳肖树林张江琳李晨
石金双 刘金艳 肖树林 张江琳 李晨
750001,银川市口腔医院 1.牙周黏膜科,2.正畸科
人牙周膜成纤维细胞(human periodontal ligament fibroblasts,hPDLCs)与牙周组织的再生、修复、重建关系密切,具有成骨分化特性,可用于牙周疾病治疗[1]。维生素D与牙周健康关系密切,而骨化三醇(VD3)是活性最强的维生素D形式,可诱导成骨细胞分化并抑制细胞增殖[2],但具体机制尚不清楚。核转录因子-kappa B(NF-κB)的活化在破骨细胞性骨溶解的病理过程中起承上启下的作用,可诱导炎症因子分泌并致骨溶解,抑制 NF-κB的表达可抑制细胞增殖、促分化[3],猜测 VD3可能通过调控 NF-κB影响 hPDLCs。本研究从牙周膜组织中分离hPDLCs,VD3干预后行NF-κB激活或抑制处理,探讨VD3影响hPDLCs的机制。
1 材料与方法
1.1 试剂及仪器
VD3(CAS:19356-17-3,10 mg)、NF-κB通路抑制剂吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamates,PDTC)(P8765,Sigma,美国);NF-κB通路特异性激活剂肿瘤坏死因子 α(tumor necrosis factorα,TNF-α)(Fitzgerald-10R-1382,Ambion公司,美国);碱性磷酸酶(ALP)检测试剂盒(TE0009,上海星科生物科技有限公司);一抗角蛋白(Cytokeratin)、波形丝蛋白(Vimentin)、NF-κB p65、Lamin B1、二抗山羊抗兔(Abcam公司,英国)。7500实时荧光定量PCR(Realtime quantitative PCR,qRT-PCR)仪(ABI公司,美国);GelDoc XR+蛋白凝胶成像仪(Bio-Rad公司,美国)。
1.2 hPDLFs取材
取银川市口腔医院牙科青少年正畸拔除的前磨牙,刮取根部1/3处牙周膜组织。
1.3 hPDLFs鉴定
常规培养牙周膜组织,提取原代细胞,细胞爬片,免疫荧光法检测细胞角蛋白、波形丝蛋白表达。
1.4 VD3浓度确定
实验分为:对照组、对照+2%DMSO组、VD3浓度(mol/L)分别为 10-14、10-12、10-10、10-8。第 0、1、3、5、7 d添加CCK-8试剂酶标仪检测450 nm处各孔细胞吸光度A值。
1.5 实验分组
实验分组:对照组、对照+DMSO组、VD3组(10-8VD3)、VD3+NF-κB抑制剂组(10-8VD3+10μmol/L PDTC)、VD3+NF-κB激活剂组(10-8VD3+20 ng/mL TNF-α)。
1.6 CCK-8检测细胞增殖情况
1.4 处理各组细胞5 d酶标仪检测450 nm处各孔细胞A值。
1.7 ALP试剂盒检测ALP活性
收集细胞按照ALP检测试剂盒说明书,波长560 nm处检测吸光度,按照标准曲线计算ALP活性。
1.8 茜素红染色检测细胞矿化情况
细胞矿化诱导10 d,1%茜素红染色30 min,光学显微镜下拍照,Image Pro Plus6.0软件鉴定矿化结节A水平。
1.9 RT-qPCR检测细胞中ALP、Runt相关转录因子(RUNX2)、骨钙素(OCN)mRNA水平
细胞处理10 d,提取总RNA逆转录成cDNA,RT-qPCR仪对 ALP、RUNX2、OCN、内参 GAPDH进行扩增。引物序列如下,ALP上游引物(Forward primer,F):5′-ACCATTCCCACGTCTTCACATTTG-3′、下游引物(Reverse primer,R):5′-AGACATTCTCTCGTTCACCGCC-3′;RUNX2 F:5′-TCTGGCCTTCCACTCTCAGT-3′;R:5′-GACTGGCGGGGTGTAAGTAA-3′;OCN F:5′-ATGAGAGCCCTCACACTCCTCG-3′、R:5′-GTCAGCCAACTCGTCACAGTC-3′,GAPDH F:5′-GCACCGTCA AGGCTGAGAAC-3′、R:5′-ATGGTGGTGAAGACGCCAG T-3′,8μL反应体系进行扩增。
1.10 Western blot检测细胞核中NF-κB p65蛋白表达
核蛋白提取试剂盒提取核蛋白,凝胶电泳分离蛋白质、PVDF转膜;5%脱脂奶粉室温封闭2 h;对应加入一抗NF-κB p65、内参Lamin B1,4℃孵育过夜;加入二抗山羊抗兔室温孵育1 h。DAB显色试剂盒避光显色,蛋白凝胶成像仪拍照,定量分析。
2 结 果
2.1 hPDLFs的鉴定
hPDLFs呈长梭形,透明度高,折射率强,细胞形态大小均匀。细胞角蛋白染色阴性、波形丝蛋白胞质区染色阳性(图1)。
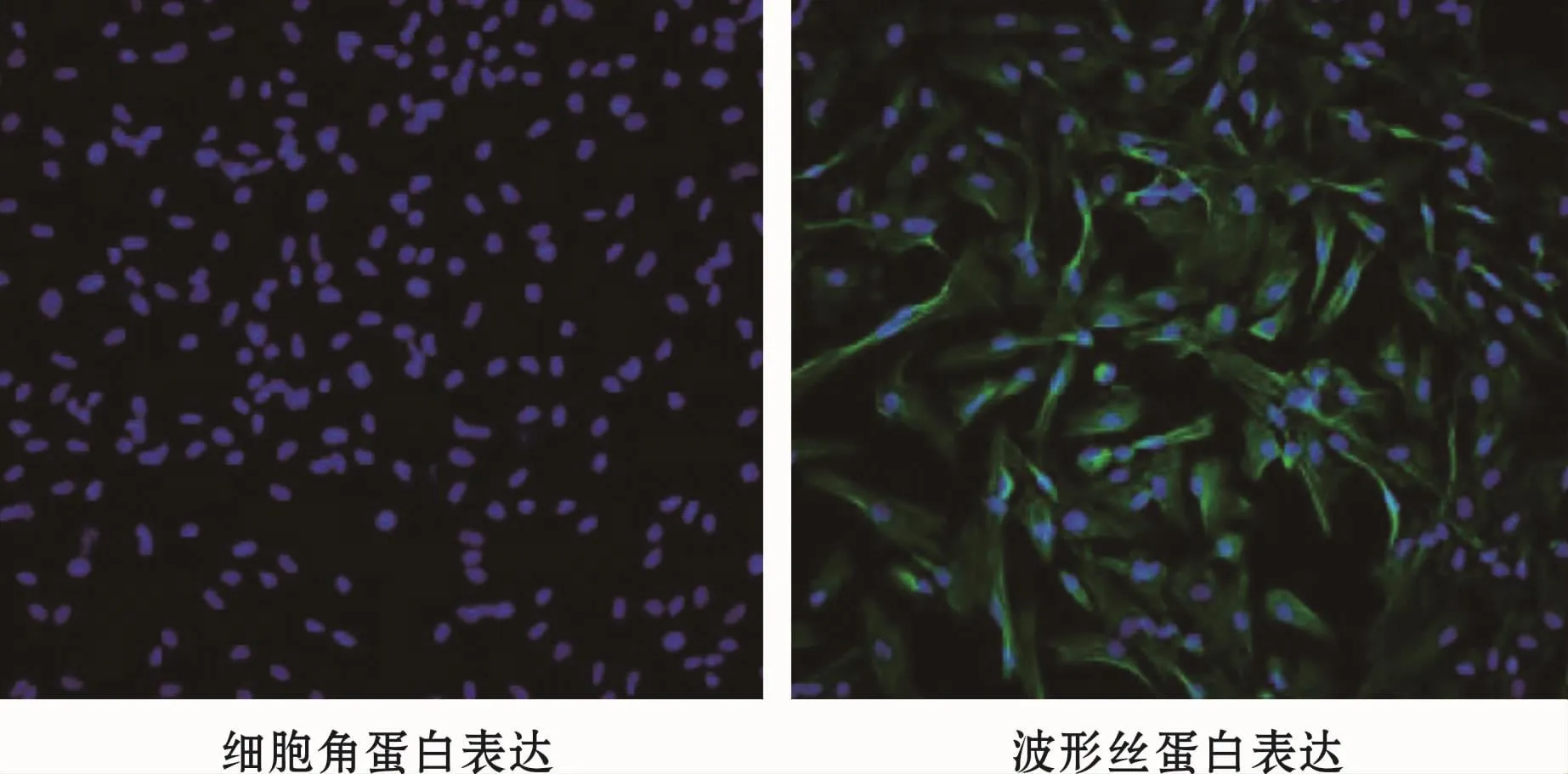
图1 hPDLFs鉴定 (免疫荧光,×200)
2.2 不同浓度VD3处理检测细胞增殖情况
随着VD3浓度的升高、实验天数的变长,细胞A450降低,具体情况见表 1。10-8VD3差异最明显,因此10-8VD3做进一步研究。
表1 不同浓度VD3(mol/L)处理后各组细胞A450值比较(n=6,±s)
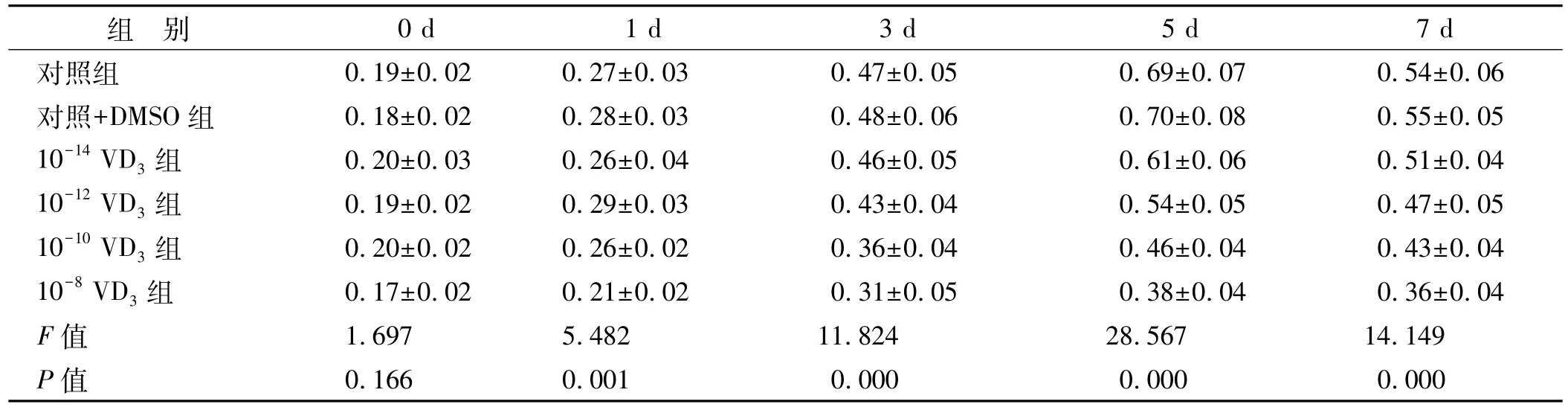
表1 不同浓度VD3(mol/L)处理后各组细胞A450值比较(n=6,±s)
组 别 0 d 1 d 3 d 5 d 7 d对照组 0.19±0.02 0.27±0.03 0.47±0.05 0.69±0.07 0.54±0.06对照+DMSO组 0.18±0.02 0.28±0.03 0.48±0.06 0.70±0.08 0.55±0.05 10-14 VD3组 0.20±0.03 0.26±0.04 0.46±0.05 0.61±0.06 0.51±0.04 10-12 VD3组 0.19±0.02 0.29±0.03 0.43±0.04 0.54±0.05 0.47±0.05 10-10 VD3组 0.20±0.02 0.26±0.02 0.36±0.04 0.46±0.04 0.43±0.04 10-8 VD3组 0.17±0.02 0.21±0.02 0.31±0.05 0.38±0.04 0.36±0.04 F值 1.697 5.482 11.824 28.567 14.149 P值 0.166 0.001 0.000 0.000 0.000
2.3 5组细胞增殖情况
在VD3基础上添加NF-κB抑制剂细胞A450水平降低,添加NF-κB激活剂细胞A450水平升高(表2)。
2.4 5组细胞ALP活性情况
在VD3基础上添加NF-κB抑制剂细胞ALP活性升高,添加NF-κB激活剂细胞ALP活性降低(表2)。
表2 5组细胞培养5 d时CCK-8实验的A值、ALP含量、茜素红染色A值比较(n=6,±s)
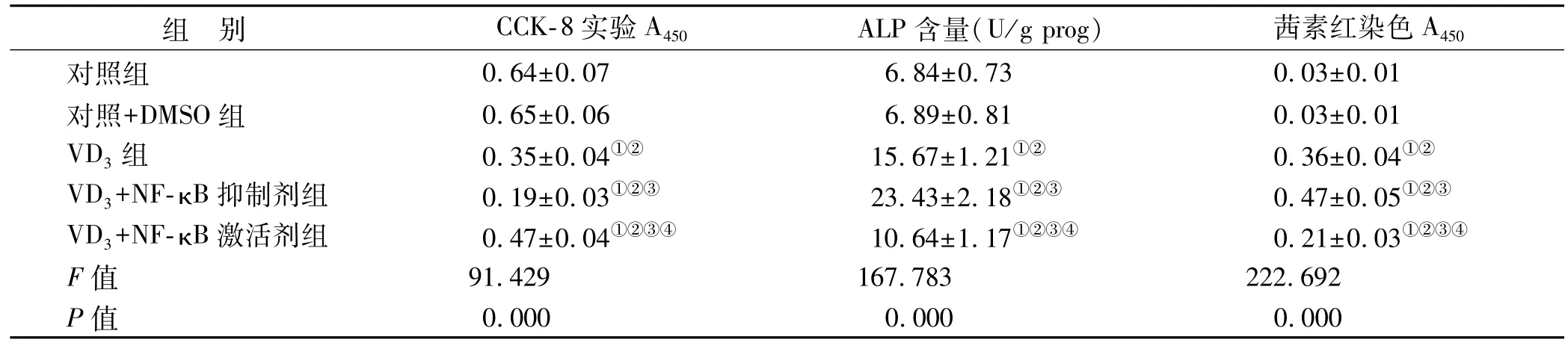
表2 5组细胞培养5 d时CCK-8实验的A值、ALP含量、茜素红染色A值比较(n=6,±s)
注:①与对照组相比,P<0.05;②与对照+DMSO组相比,P<0.05;③与VD3组相比,P<0.05;④与VD3+NF-κB抑制剂组相比,P<0.05
组 别 CCK-8实验A450 ALP含量(U/g prog) 茜素红染色A450对照组 0.64±0.07 6.84±0.73 0.03±0.01对照+DMSO组 0.65±0.06 6.89±0.81 0.03±0.01 VD3组 0.35±0.04①② 15.67±1.21①② 0.36±0.04①②VD3+NF-κB抑制剂组 0.19±0.03①②③ 23.43±2.18①②③ 0.47±0.05①②③VD3+NF-κB激活剂组 0.47±0.04①②③④ 10.64±1.17①②③④ 0.21±0.03①②③④F值 91.429 167.783 222.692 P值 0.000 0.000 0.000
2.5 5组细胞矿化情况
在VD3基础上添加NF-κB抑制剂细胞矿化增强,添加VD3+NF-κB激活剂细胞矿化减轻(图 2)。

图2 5组细胞矿化检测 (茜素红染色,×200)
2.6 5组细胞中 ALP、RUNX2、OCN mRNA、细胞核中NF-κB p65蛋白水平
在VD3基础上添加NF-κB抑制剂细胞中ALP、RUNX2、OCN mRNA水平升高,细胞核中 NF-κB p65蛋白水平降低;添加 NF-κB激活剂组细胞中 ALP、RUNX2、OCN mRNA水平降低,细胞核中 NF-κB p65蛋白水平升高(图3、表3)。
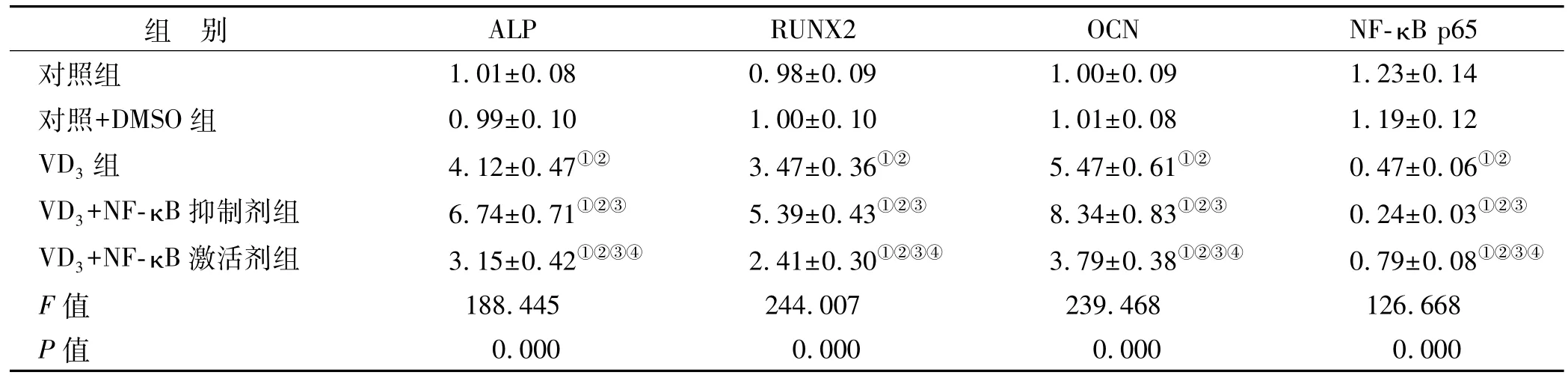
表3 5组细胞中ALP、RUNX2、OCN mRNA和细胞核中NF-κB、p65蛋白水平比较 (n=6)

图3 5组细胞核中NF-κB p65蛋白表达
3 讨 论
牙周炎会造成牙槽骨吸收,附着丧失、影响咀嚼功能[4],牙周膜细胞在一定条件下能向成牙骨质细胞、成骨细胞分化,为牙周组织再生提供了可能。VD3作为维生素D的活性代谢产物,可促进成骨细胞合成,对细胞成骨形成具有直接作用[5]。本研究提取hPDLCs,探究VD3对细胞分化影响,VD3能够促进ALP活性和RUNX2、OCN mRNA水平表达,ALP可释放到细胞培养液中,参与细胞外基质矿化过程,是hPDLCs分化的重要指标[6];RUNX2可促进成骨前体细胞、骨原细胞分化并促进成骨细胞成熟[7];OCN与骨基质内烃磷灰石紧密连接,是成骨细胞和骨矿化的特殊标志物[8]。VD3可抑制细胞增殖,且促进成骨前体细胞、骨原细胞分化、促进骨非胶原蛋白的形成、促进细胞矿化,但其机制尚需进一步研究。在牙龈卟啉单胞菌感染的PDLCs中病原菌可刺激NF-κB的抑制分子IκB磷酸化,促进NF-κB入核,调控靶基因后激活炎症反应、抑制成骨分化[9];在细胞增殖中,贝沙罗汀在C6胶质瘤细胞中的处理可以通过抑制NF-κB从而促进细胞凋亡、DNA损伤,抑制活性氧生成和总抗氧化剂水平,抑制细胞增殖[10]。本研究中在VD3的基础上添加NF-κB抑制剂后,hPDLCs中细胞增殖减弱、成骨分化因子ALP活性和mRNA,RUNX2、OCN mRNA水平进一步升高,矿化增强;提示VD3能够抑制NF-κB通路从而抑制hPDLCs增殖、促进成骨分化。
VD3可通过抑制NF-κB入核进而抑制hPDLCs细胞增殖、促进成骨分化,进而实现对牙周疾病的缓解作用。但VD3影响NF-κB入核的具体机制尚不清楚,是本文接下来研究重点。
