FRA-2 mRNA 表达及DNA 甲基化水平与代谢综合征的相关性研究
2022-05-05杜晴晴侯泽鑫曹国磊李思源
杜晴晴,侯泽鑫,李 军,胡 颖,曹国磊,李思源
1.石河子大学医学院,石河子 832002;2.石河子大学医学院第一附属医院内分泌代谢科,石河子 832002;3.新疆医科大学第四附属医院神志科,乌鲁木齐 830099;4.新疆医科大学附属肿瘤医院呼吸神经内科,乌鲁木齐 830011
近年来,西方生活方式在全球范围内日益流行,代谢综合征(metabolic syndrome,MS)的患病率也随之上升,其在一些发展中国家城市人口中的患病率往往高于发达国家,已成为一个全球性的威胁健康的重要问题。MS 是肥胖或超重、高血糖、胰岛素抵抗等多种代谢异常构成的复杂的代谢异常症候群。MS促进冠状动脉粥样硬化性心脏病、卒中及恶性肿瘤等疾病的发生,这些疾病造成的医疗保健成本和潜在的经济活动损失成本,数以万亿计[1-2]。
DNA甲基化是一种重要的表观遗传修饰方式。有研究[3]发现,DNA 甲基化可能通过在启动子区域的CpG 序列添加甲基来发挥作用,参与哺乳动物发育、代谢、稳态调节及肥胖和多种疾病的发生。DNA甲基化也可能与MS的发生有关[4]。Fos相关抗原-2(Fosrelated antigen-2,FRA-2)属于转录因子激活蛋白1(activator protein-1,AP-1)家族,存在于动物的多种组织和细胞,参与细胞增殖、分化等过程;FRA-2的异常表达可导致疾病的发生和发展[5]。FRA-2参与哺乳动物能量平衡、糖脂代谢及胰岛素抵抗的调节,与MS、糖尿病、动脉粥样硬化等的发生有关[6-9]。到目前为止,FRA-2mRNA及DNA甲基化水平与MS的相关关系尚不清楚。本研究拟探讨FRA-2mRNA及DNA甲基化水平与MS的关系,探究MS发生的分子机制以寻找MS防治的潜在靶点。
1 对象和方法
1.1 研究对象
选取2020年6月—2021年6月石河子大学医学院第一附属医院内分泌代谢科就诊的患者,根据《中国2 型糖尿病防治指南(2020 年版)》[10]对MS 的定义,将有MS 危险因素(高血糖、高血脂、高血压、肥胖)≥3 项的患者纳入MS 组(n=80),有MS 危险因素1~2 项的患者纳入非MS 组(n=80)。MS 的诊断标准满足以下≥3 项:①腰围(waist circumference,WC)女性≥85 cm,男性≥90 cm。②确诊高血压,或收缩压(systolic blood pressure,SBP) ≥130 mmHg或舒张压(diastolic blood pressure,DBP)≥85 mmHg(1 mmHg=0.133 kPa)。③高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)<1.04 mmol/L。④三酰甘油(triacylglycerol,TAG) ≥1.7 mmol/L。⑤确诊2 型糖尿病或空腹血糖(fasting plasma glucose,FPG)≥6.1 mmol/L。另外选取同期的健康体检者纳入对照组(无MS 危险因素,n=80)。各组排除具有以下情况人群:①各种严重肝、肾、心血管疾病者。②长期服用激素、免疫抑制剂者。③近期有外伤或手术者。④妊娠及哺乳期者。收集患者年龄、性别、体质量指数(body mass index,BMⅠ)等资料。本研究经石河子大学医学院第一附属医院医学伦理委员会批准(伦理审查号:KJ2020-142-01),所有参与的患者均签署知情同意书。
1.2 研究方法
1.2.1 标本采集及生化检测 所有研究对象均禁食12~14 h,晨起空腹抽取静脉血2 管,每管约2 mL。一管为EDTA 抗凝管,备以后续DNA 及RNA 提取;另一管为真空采血管,经过混匀后9 000×g离心10 min,离心管收集上清液备用,然后均置于-80 ℃冰箱中冻存。使用全自动生化分析仪(AU5800,美国贝克曼公司)测定FPG、TAG、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、HDL-C,使用全自动电化学发光免疫分析仪(COBAS e 601,德国罗氏) 测定空腹胰岛素(fasting serum insulin,FⅠNS)。使用稳态模型评估法来计算胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-ⅠR),公式为HOMA-ⅠR=FⅠNS×FPG/22.5。
1.2.2 RT-PCR 方法检测FRA-2mRNA 表达 TRⅠzol法提取RNA,后按照cDNA 第一链合成试剂盒(美国APExBⅠO 公司) 说明书合成cDNA 模板,进行PCR 扩增。反应条件为:94 ℃4 min,72 ℃2 min,然后94℃20 s、56 ℃30 s、72 ℃60 s,进行35 个循环。加入1 对内参(β-actin)的特异性引物,同时扩增内参DNA(引物序列见表1)。使用GelDoc EZ 全自动凝胶成像分析系统(美国UVB公司)和2-ΔΔCT法分析FRA-2mRNA相对表达水平。
1.2.3 MALDⅠ-TOF-MS法检测FRA-2DNA 甲基化水平 取200 μL血液样本,提取DNA,使用NanoDrop分光光度仪定量检测基因组DNA 的浓度及纯度,以保证其DNA 浓度>50 ng/μL,纯度[D(260 nm)/D(280 nm)]位于1.7~2.0 之间。依据EZ DNA 甲基化修饰处理试剂盒(D5001,美国Sequenom 公司)以及美国Sequenom 公司推荐的方式对基因组DNA 进行亚硫酸氢盐修饰,反应条件为:95 ℃30 s,50 ℃15 min,进行20 个循环。PCR 扩增DNA,反应条件如下:94 ℃预热4 min,72 ℃退火3 min,接下来45个循环(94 ℃20 s,56 ℃30 s,72 ℃1 min)。PCR产物在384-pad光谱芯片(美国Sequenom公司)上测定。引物序列见表1。

表1 PCR引物序列Tab 1 Primer sequences for PCR
使用MassARRAY 质谱仪(美国SEQUENOM公司)收集质谱图,使用EpiTYPER v1.0.5 软件生成各CpG 单元的甲基化数据。经由对比甲基化峰与非甲基化峰的强度来计算所检测基因各CpG 单元相对的甲基化率。共检测了10 个CpG 单元,分别为CpG 1、CpG 3、CpG 4.5、CpG 6.7、CpG 8、CpG 9.10、CpG 11、CpG 12.13.14、CpG 15.16.17、CpG 19。
1.3 统计学方法
采用SPSS 25.0 软件进行数据分析。符合正态分布的定量资料以±s表示,方差分析示3 组间年龄差异有统计学意义,余资料采用协方差分析以校正年龄对组间临床指标的影响;非正态分布定量资料以M(Q1,Q3)表示,采用Kruskal-WallisH检验;每增加1个危险因素,FRA-2DNA甲基化水平变化量采用线性回归分析;指标间相关关系采用Spearman 相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 组间一般资料比较
Kruskal-WallisH检验显示,MS 组年龄高于对照组及非MS 组(P<0.05)。使用协方差分析校正年龄对组间临床指标的影响后,发现MS 组BMⅠ、WC、DBP、SBP、FPG、TAG、TC、LDL-C、HOMA-ⅠR均高于对照组及非MS 组(P<0.05),HDL-C 低于对照组及非MS组(P<0.05)。结果见表2。
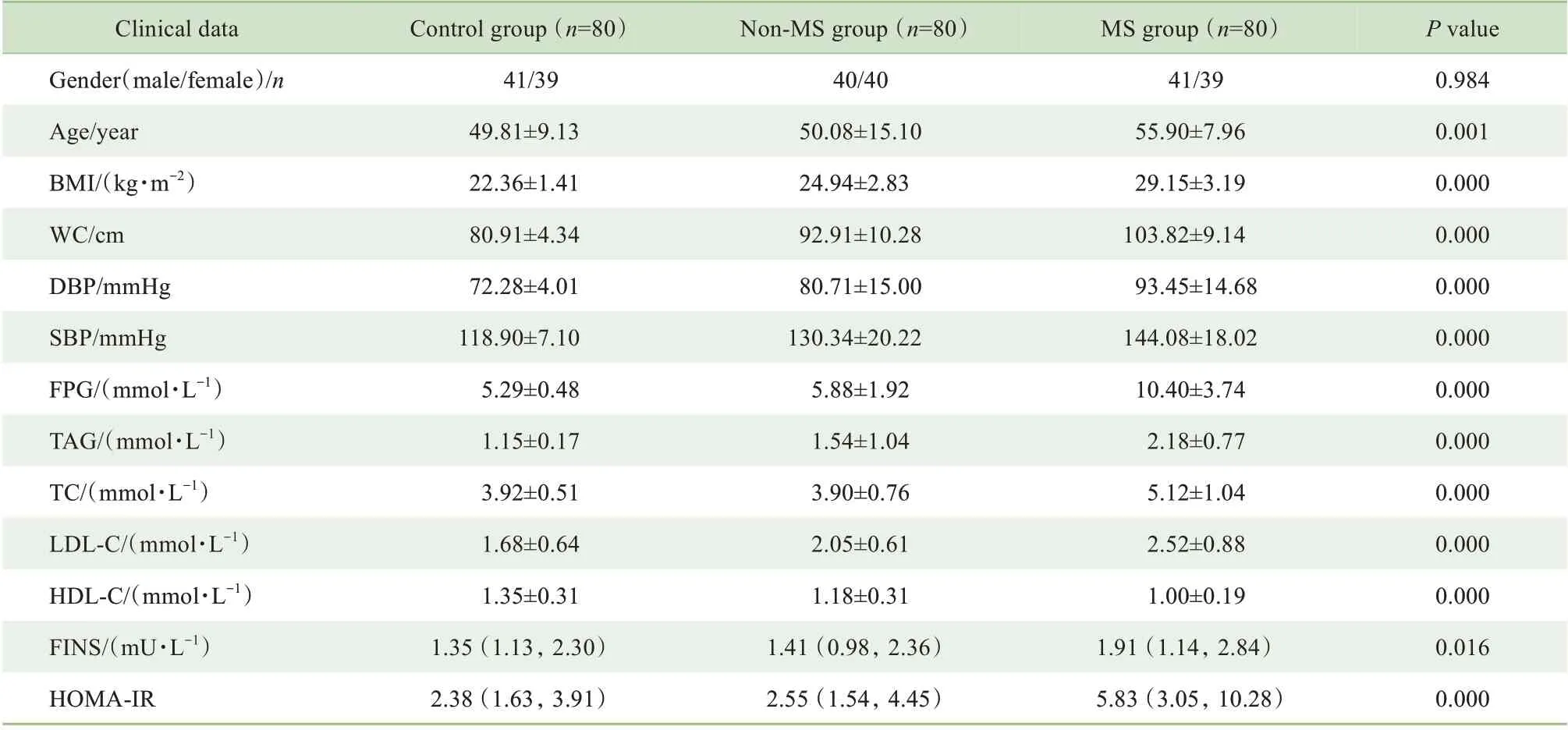
表2 3组间一般及临床资料比较Tab 2 Comparison of general and clinical data among the three groups
2.2 组间FRA-2 mRNA表达水平比较
与对照组及非MS 组相比,MS 组FRA-2mRNA表达水平降低(均P=0.000)(图1)。
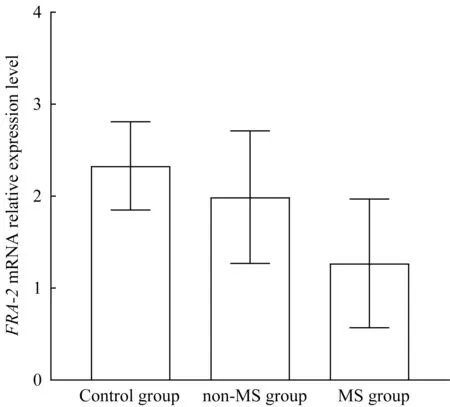
图1 3组间FRA-2 mRNA相对表达水平比较Fig 1 Comparison of relative expression levels of FRA-2 mRNA among the three groups
2.3 组间FRA-2 DNA甲基化水平比较
协方差分析结果(表3、图2)显示:与对照组相比,非MS 组及MS 组CpG 1(P=0.014,P=0.016)、CpG 3 (P=0.006,P=0.000)、CpG 12.13.14 (均P=0.000)、CpG 19(均P=0.000)甲基化水平上升;与非MS 组相比,MS 组CpG 4.5、CpG 6.7、CpG 8、CpG 9.10、CpG 15.16.17甲基化水平上升(均P=0.000)。

图2 FRA-2 DNA甲基化水平聚类分层Fig 2 FRA-2 DNA methylation level clustering stratification

表3 各CpG单元DNA甲基化水平比较Tab 3 Comparison of DNA methylation levels in each CpG unit
2.4 FRA-2 DNA 甲基化水平与MS 危险因素个数的关系
以FRA-2DNA 甲基化水平(10 个CpG 单元的平均甲基化率)为因变量,以MS 的危险因素个数为自变量进行线性回归分析。结果(图3)显示,MS 危险因素个数与FRA-2DNA 甲基化水平呈正相关(β=0.012,P=0.000),即危险因素每增加1 个,FRA-2DNA甲基化水平上升0.012%。
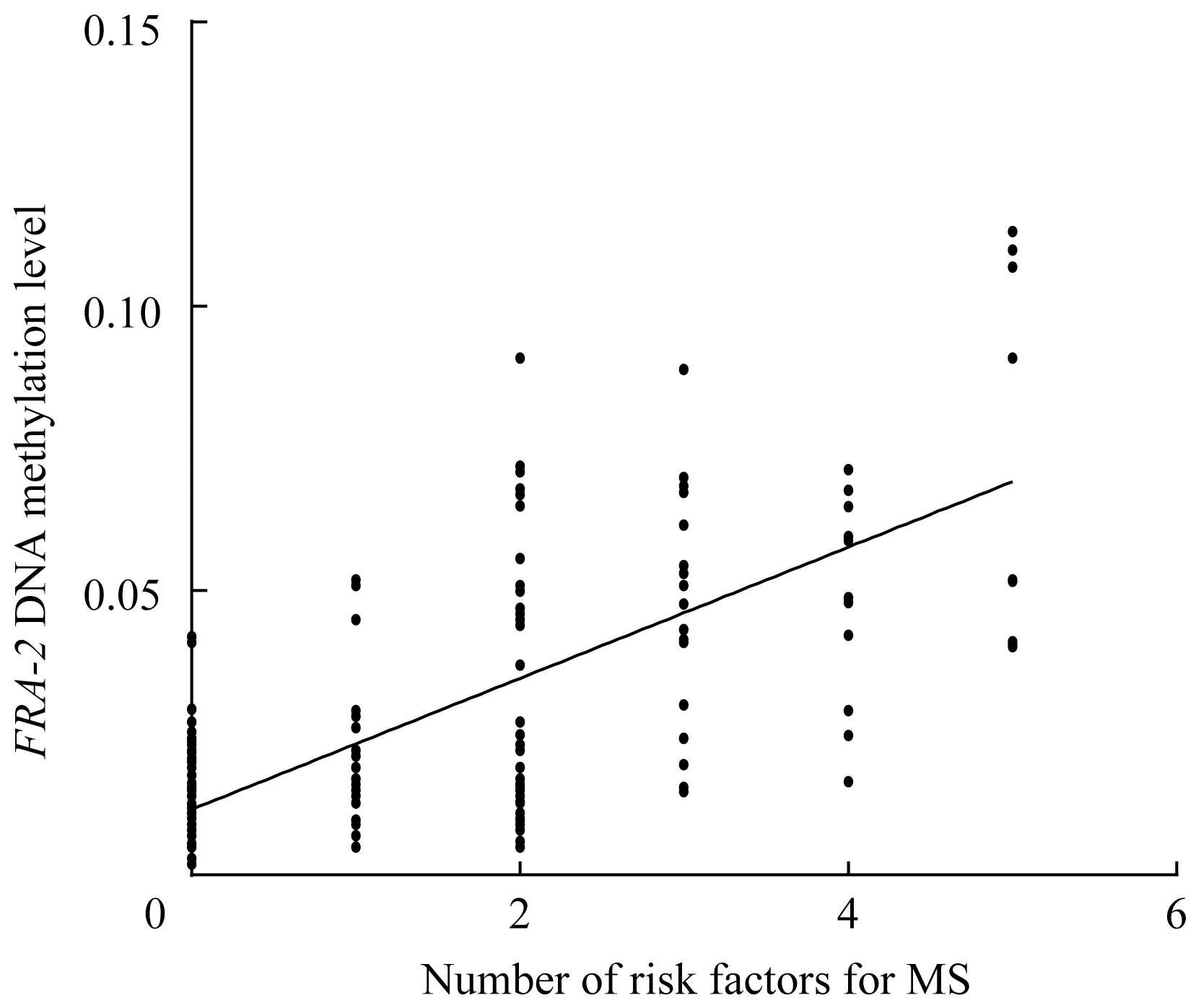
图3 FRA-2 DNA甲基化水平与MS危险因素个数的关系Fig 3 Relationship between FRA-2 DNA methylation level and the number of MS risk factors
2.5 FRA-2 DNA 甲基化水平与MS 危险因素的相关性分析
Spearman 相关分析结果(表4)显示,CpG 3、CpG 4.5、 CpG 6.7、 CpG 8、 CpG 9.10、 CpG 12.13.14、CpG 19 甲基化水平均与WC、SBP、DBP、FPG、TAG 呈正相关;CpG 1 和CpG 15.16.17 甲基化水平与WC、DBP、TAG 呈正相关;CpG 1、CpG 3、CpG 4.5、CpG 8、CpG 9.10、CpG 12.13.14、CpG 19甲基化水平与HDL-C呈负相关(均P<0.05)。
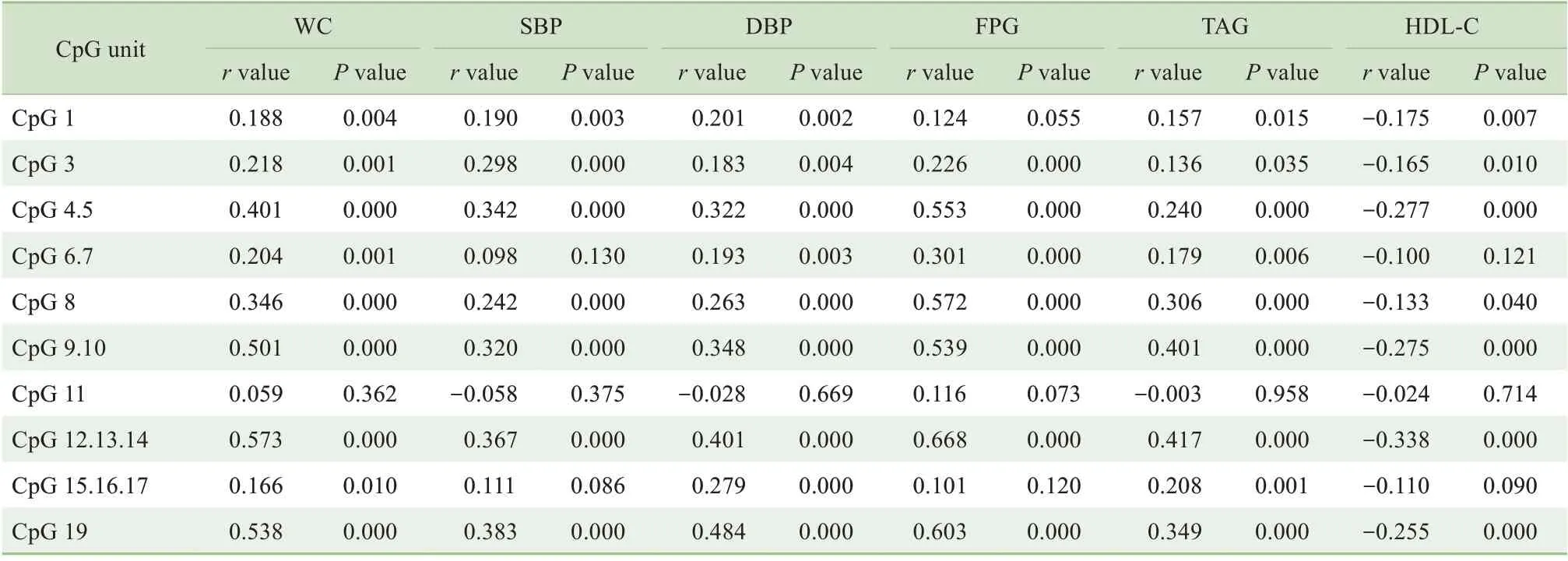
表4 FRA-2 DNA甲基化水平与MS危险因素的相关性分析Tab 4 Correlation analysis between FRA-2 DNA methylation level and MS risk factors
2.6 FRA-2 DNA甲基化水平与mRNA表达的相关性分析
Spearman相关分析的结果(图4)所示,FRA-2DNA甲基化水平(10个CpG单元的平均甲基化率)与FRA-2mRNA表达水平呈负相关(r=-0.607,P=0.000)。

图4 FRA-2 DNA甲基化水平与mRNA表达水平的相关性Fig 4 Correlation between FRA-2 DNA methylation level and mRNA expression level
3 讨论
DNA 甲基化是一种重要的修饰方式,可以调控基因表达,在不改变分子一级结构的前提下发挥重要的生物学作用,其与高血糖、高血压等心血管疾病的危险因素增多有关[11]。既往研究[12]发现,FRA-2蛋白参与了糖脂代谢紊乱及MS 的发生。目前关于FRA-2mRNA及DNA甲基化表达水平与MS相关性的报道较少。
赵天明等[13]通过流行病学分析发现,随年龄的增加MS 的患病率上升。本研究结果显示,与对照组及非MS 组相比,MS 组年龄更高;可能是由于随着年龄增加,机体器官功能有所减退,MS 危险因素的成分增加,患病概率增大。CHⅠURAZZⅠ等[14]研究显示,MS 人群表现为中心性肥胖、高血压、高血糖、高血脂及胰岛素抵抗的特征,与对照组及非MS组比较,MS 组WC、DBP、SBP、FPG、TAG、TC、LDL-C、HOMA-ⅠR 上升,HDL-C 降低;我们的研究数据与该研究相似。
通过RT-PCR 对研究对象FRA-2mRNA 进行检测发现,MS 组FRA-2mRNA 表达水平显著低于对照组及非MS 组,提示MS 的发生发展可能与FRA-2mRNA 表达下调有关。SAMBLAS 等[4]的研究发现,甲基化参与肥胖人群代谢及循环紊乱,缺氧诱导因子3A(hypoxia inducible factor 3A,HIF3A)、胰岛素样生长因子结合蛋白3 (insulin-like growth factor binding protein-3,IGFBP-3)、固醇调节元件结合转录因子1 (sterol regulatory element binding factor 1,SREBF1)、肿瘤坏死因子(tumor necrosis factor,TNF)、 昼夜节律钟(clock circadian regulator,CLOCK)等基因的甲基化水平可作为预测和评估MS的重要标志。我们进一步用MALDⅠ-TOF-MS 对外周血中FRA-2DNA甲基化水平进行检测。结果表明,与对照组相比,MS 组多个CpG 单元甲基化水平上升,可以推测在MS发生中,FRA-2DNA 高甲基化可能起到重要作用。相关分析结果显示,FRA-2基因9 个CpG 单元甲基化水平与WC、DBP、TAG 呈正相关,7 个CpG 单元甲基化水平与SBP 及FPG 呈正相关,7 个CpG 单元甲基化水平与HDL-C 呈负相关;推测FRA-2可能通过DNA 高甲基化的形式参与血糖、血脂、血压等的调节,进而参与MS 发生发展的过程。既往研究[15]发现,FRA-2与糖尿病患者的FPG、TG的调节有关;本研究结果与之相似。
此外,本研究还发现,FRA-2DNA高甲基水平与MS 人群SBP 及DBP 升高之间存在相关性;该结果与以往研究[12]不同,可能与纳入研究对象危险因素个数的差异性或不同的遗传背景有关。近年来,有研究[16-17]报道,DNA甲基化可通过影响肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosteronesystem,RAAS)参与高血压的发生,但FRA-2是否经该通路发挥作用有待进一步研究。全贞玉等[18]认为,MS的发生及严重程度与危险因素个数有关。本研究通过线性分析发现,危险因素每增加1个,FRA-2DNA甲基化水平上升0.012%,提示MS 患者FRA-2基因甲基化程度可能受危险因素个数的影响。XⅠE 等[19]研究发现,外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)中,DNA 甲基化水平对mRNA 表达有调节作用,DNA可通过高甲基化的方式下调mRNA的表达,从而参与疾病的发生。本研究发现FRA-2DNA甲基化水平与mRNA表达呈负相关,提示FRA-2基因在MS 中可能具有相似的致病机制,但其具体的分子机制及信号通路,还需要进一步探索。
综上所述,本研究发现FRA-2基因甲基化水平与MS发生具有一定的相关性,DNA 甲基化水平增高从而下调mRNA 表达可能在MS 发生中发挥作用。未来需要设计更大样本量的多中心研究及前瞻性研究,以明确FRA-2与MS 发生的因果关系及FRA-2参与MS发生的机制。
