裂殖酵母Shelterin五元复合物的电镜结构研究
2022-05-05鲁彦伽吴振芳
鲁彦伽,孙 虹,吴振芳,雷 鸣
上海交通大学医学院附属第九人民医院上海精准医学研究院,上海 200125
端粒是真核细胞线性染色体末端的保护性结构,由特定的DNA重复序列和蛋白质组分构成,在维持基因组的稳定中发挥重要作用[1]。Shelterin复合物是一种结合在端粒DNA上的复合物,由多种亚基构成。它与不同的复合物相互作用,通过精细的调控,使得端粒长度始终维持在稳定的状态[2]。人源Shelterin复合物由TRF1(telomeric repeat binding factor 1)、TRF2、TⅠN2(TRF1-interacting nuclear factor 2)、RAP1(repression/activation protein 1)、 TPP1 (adrenocortical dysplasia protein homolog,又称ACD)、POT1(protection of telomeric protein 1)6种组分构成,这些组分通过广泛的相互作用,抑制多种DNA损伤应答反应,调节端粒酶与端粒DNA的结合,维持端粒的稳态[3]。除此之外,Shelterin复合物还会配合细胞周期的进程,保证端粒DNA复制的正常进行[4]。由于Shelterin复合物在维持端粒稳态方面的重要性,其组分结构和功能上的异常,都会导致疾病的发生。例如在人类的乳腺癌细胞中发现Shelterin复合物的各种组分表达异常增高[5],在其他多种肿瘤细胞中检测到Shelterin组分的突变[6],这些变化大多会造成Shelterin复合物与DNA链之间或是Shelterin组分之间的相互作用遭到破坏,最终导致染色体脱帽,端粒DNA暴露在含有端粒酶以及多种损伤响应因子的环境中,促使癌症的发生[5,7]。
对Shelterin复合物结构的清晰认识能够极大地推进对慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)[8]、先天性角化不良(dyskeratosis congenita,DKC)[9]等由Shelterin 组分功能异常导致的端粒相关疾病的认识,以及相应治疗手段的研究进展。有研究表明,Shelterin 组分之间的相互作用是通过一种高度保守的“domain-peptide”(结构域对肽段)的机制来达成的[10-11],即一种Shelterin组分可以通过同一结构域中的保守残基与多种蛋白质相互作用。这种相互作用机制不仅利于小分子药物的设计和开发[12],更是赋予了Shelterin 复合物较高的进化可塑性[11]。 裂殖酵母(Schizosaccharomyces pombe,S. pombe) 在进化上相对缓慢,相较于芽殖酵母(Saccharomyces cerevisiae)来说,还留有许多后生生物的特性。正因如此,裂殖酵母在染色体的保护机制上与高等哺乳动物具有较高的同源性[13-14]。裂殖酵母的Shelterin 复合物由Taz1(telomere length regulator taz1)、Rap1、Poz1 (Pot1-associated protein Poz1)、Ccq1 (coiled-coil quantitatively-enriched protein 1)、Tpz1(telomere-protecting protein)、Pot1 6 个组分组成,在结构和功能上与人源Shelterin复合物都高度保守[15]。近年来也有不少以裂殖酵母的Shelterin复合物为研究对象,进行相关疾病起源的研究以及药物研发的实例。基于裂殖酵母Tpz1-Pot1 之间和人源TPP1-POT1之间相互作用的保守性,通过Tpz1-Pot1生化和结构特性的研究结果,推测人类黑色素瘤相关的POT1 突变(A532P)位于TPP1-POT1 界面,该突变引起的TPP1-POT1相互作用缺失可能是导致端粒异常延长的原因[16];利用人源POT1以及裂殖酵母Pot1结构的高度相似性,以裂殖酵母Pot1 与单链DNA 结合复合物为对象进行药物筛选,成功筛选到了一种能打断Pot1与单链DNA 相互作用的小分子抑制剂[17]。这些治疗手段与抑制端粒酶活性的治疗方式联合,能够在一定程度上克服癌细胞对药物的耐受性,有望显著提高药物对多种癌症的治疗效果[18]。
近20 年来Shelterin 复合物中多种蛋白质-蛋白质以及蛋白质-DNA 相互作用的高分辨率晶体结构已获得解析[19-24]。然而,Shelterin复合物在体内具有高度的异质性——各亚基间可能形成不同组合的亚复合物,参与不同的调控反应[25];同时,Shelterin 复合物的结构具有较大的可变性,这些因素都极大地阻碍了完整Shelterin复合物高分辨率结构的解析。本实验室之前的工作已解析了裂殖酵母Shelterin三元复合物(Rap1-Poz1-Tpz1)的晶体结构[19],在此基础上本研究采用在体外重组并表达裂殖酵母Shelterin复合物的方法,通过两步亲和层析、凝胶过滤层析等蛋白质纯化流程、负染技术、电子显微镜(电镜)以及单颗粒重构技术,最终获得了裂殖酵母Shelterin五元复合物Rap1-Poz1-Tpz1-Ccq1-Pot1 的低分辨率三维结构模型,为解析高分辨率的Shelterin复合物结构奠定了坚实的基础,对理解整个复合物的组装方式及其发挥功能的分子机制具有重要的意义,同时也将为相关疾病的治疗提供新的思路和潜在靶点。
1 材料与方法
1.1 实验材料
1.1.1 表达质粒与菌株 pGEX-6P1 以及pET-28ASm2 克隆载体均由本实验室保管,其中pET-28AS-m2为本实验室基于pET-28a(+)改造的质粒——用编码小分子泛素相关修饰物蛋白(small ubiquitin related modifier,SUMO) 序列替换原pET-28a(+) 中的ACTGGTGGACAGCAAATGGGTCGC 序列。用于质粒扩增的大肠埃希菌(E. coli)DH5α 以及用于蛋白质表达的E.coliBL21(DE3)菌株由本实验室保管。
1.1.2 主要试剂以及仪器 LB 培养基购于青岛生工生物科技有限公司,镍离子金属螯合亲和层析介质(Ni-NTA)购于德国Qiagen 公司,谷胱甘肽琼脂糖凝胶(glutathione sepharose 4B)购于美国GE 公司,甲酸双氧铀购于美国TED PELLA 公司,氨苄青霉素、 卡纳霉素、 氯化钠(NaCl)、 甘油(glycerol)、异丙基-β-D-硫代半乳糖苷(isopropylbeta-D-thiogalactopyranoside,ⅠPTG)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、亮抑肽酶(leupeptin)、三羟甲基氨基甲烷(Tris)、二硫苏糖醇(dithiothreitol,DTT)均购于生工生物工程(上海)股份有限公司,考马斯亮蓝G250 购于上海碧云天生物技术有限公司。本实验使用的His-ULP1(带组氨酸标签的SUMO 蛋白酶)以及谷胱甘肽巯基转移酶3C酶(GST-3C)均由实验室表达、纯化及保存。
高压细胞破碎仪(FB-110X)购于上海励途超高压设备有限公司,高速离心机(Beckman Avanti JXN26)购于美国Beckman Coulter 公司,超声波清洗器(SB-5200DTN)购于宁波新芝生物科技有限公司,垂直电泳仪(Mini-PROTEAN Tetra Cell)购于Bio-Rad(中国)公司,控温振荡培养箱(YR101)购于上海西雷生物有限公司,快速蛋白质液相色谱(fast protein liquid chromatography, FPLC) 系统(ÄKTATMpure)和SuperoseTM6 10/300 GL 层析柱购于美国GE 公司,普通碳支持膜(BZ1102XX)购于北京中镜科仪有限公司,透射电子显微镜(Talos L120C)购于美国FEⅠ公司。
1.2 实验方法
1.2.1 质粒构建 从Shelterin复合物各亚基间的相对位置关系(图1A),复合物各组分之间的相互作用情况(图1B),以及本实验室已发表的实验数据来看,Poz1全长蛋白质中的71~83位肽段不利于蛋白质稳定纯化[19];我们在本次构建中去除了这段序列(本文仍简称Poz1),并在Poz1的羧基端引入编码融合蛋白质柔性连接——(GGS)2肽段的序列,再利用该连接将Poz1的C端与Rap1PBM(Rap1上与Poz1相互作用的区域,氨基酸残基:465~491)的氨基端相连,构建出融合蛋白质Poz1-Rap1PBM[相对分子质量(Mr)30 000]。同样地,通过从氨基端到羧基端依次排列Tpz1PⅠM(Tpz1 上与Pot1 相互作用的区域,氨基酸残基:167~240)、Tpz1CBM-Tpz1PBM(Tpz1 上与Ccq1 相互作用的区域-Tpz1 上与Poz1 相互作用的区域,氨基酸残基:425~509),构建Tpz1ⅠNT(Mr17 000),2个片段用(GGS)2肽段连接。将Pot1FL(Pot1全长蛋白质,Mr61 000)、Poz1-Rap1PBM和Ccq1TAD(Ccq1上与Tpz1相互作用的区域,氨基酸残基:123~439,Mr34 000)3 段序列分别构建于pET-28AS-m2 克隆载体,使它们各自氨基端带上His-SUMO纯化标签;Tpz1ⅠNT构建于pGEX-6P1 克隆载体,使其氨基端带上谷胱甘肽巯基转移酶(GST)纯化标签(图1C)。

图1 裂殖酵母Shelterin复合物各组分重组质粒的构建Fig 1 Construction of recombinant plasmids of each component of S.pombe Shelterin complex
1.2.2 蛋白质表达与纯化 将Tpz1ⅠNT与Pot1FL共同转化进E. coliBL21 (DE3),Poz1-Rap1PBM以及Ccq1TAD单独转化进BL21(DE3)。挑取单个菌落至对应抗性的LB 液体培养基,于37 ℃活化12 h。将活化好的菌体转接至1 L 对应抗性的LB 液体培养基。接种比例为菌种∶培养基=1∶100。每次摇菌6 L,包括3 L Tpz1ⅠNT和Pot1FL共表达菌、2 L Poz1-Rap1 融合蛋白质表达菌和1 L Ccq1TAD表达菌。
在37 ℃下培养至吸光度值为0.8,降温至18 ℃后,加入ⅠPTG(终浓度为0.2 mmol/L)诱导蛋白质表达18 h。然后以3 990×g、25 ℃离心15 min,收集菌体。用lysis buffer吹悬菌体,直至无细菌团块。向悬液中添加终浓度为1 mmol/L 的PMSF、1 μg/mL 的亮抑肽酶并混匀,于高压均质机中彻底裂解并取样。裂解后的样品立刻于39 190×g、4 ℃离心45 min,收集上清液并取样。然后,将收集的上清液与Ni-NTA于4 ℃低转速结合1 h。离心收集Ni-NTA 于层析柱,收集流穿液并取样。之后用wash buffer Ⅰ清洗杂蛋白质并取样。洗杂期间,用考马斯亮蓝G250 实时监测杂蛋白质的洗脱情况,待考马斯亮蓝G250 几乎不再变蓝后,用elution buffer Ⅰ洗脱并收集目的蛋白质,取样。然后立刻用His-ULP1 于4 ℃酶切处理洗脱液,去除所有蛋白质氨基端的His-SUMO标签。
在His-ULP1酶切进行6 h后,取样。直接加入谷胱甘肽琼脂糖凝胶进行第2 步的亲和层析,于4 ℃低速旋转结合4 h。4 h 后,将谷胱甘肽凝胶转移至层析柱,收集流穿液,并取样。然后用wash buffer Ⅱ彻底清洗杂蛋白质,将谷胱甘肽凝胶转移至干净的50 mL管,于4 ℃下用GST-3C 酶低转速过夜处理谷胱甘肽琼脂糖凝胶,将Tpz1 蛋白质氨基端GST 标签以及GST-3C 酶与目的蛋白质完全分开。将目的蛋白质留在流穿液里,而将GST 标签和酶留在谷胱甘肽凝胶上。10 h 后200×g离心收集上清液并取样,将纯化各步骤留取的样品行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)。检查纯化各步骤样品蛋白质组成的变化情况。
在目的蛋白质样品中加入DTT (终浓度为2 mmol/L),用截留Mr为100 000 的超滤浓缩管将蛋白质体积浓缩至1 mL,并于21 130×g离心10 min 后,取上清液,使用SuperoseTM6 10/300 GL 与FPLC buffer,以0.4 mL/min 的流速分离纯化蛋白质。根据出峰情况,利用SDS-PAGE检测出峰位置对应收集管内的蛋白质组成状况。上述缓冲液配方见表1。
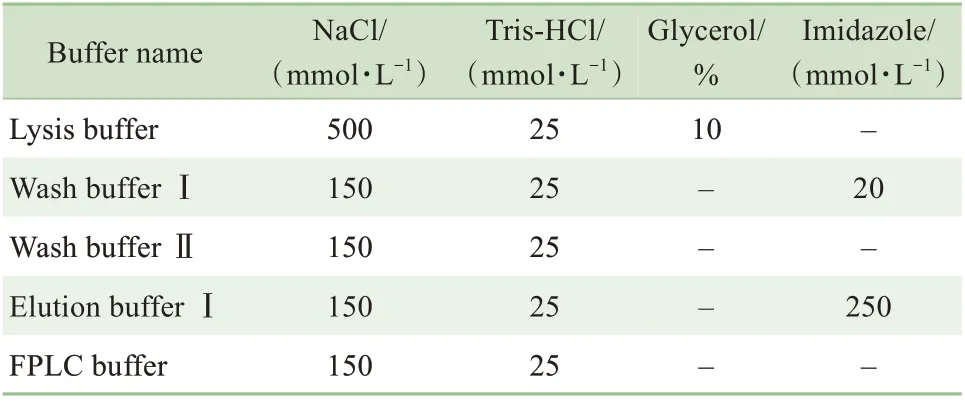
表1 缓冲液配方Tab 1 Buffer recipes
1.2.3 电镜样品制作、观察以及数据处理 将铜网碳膜覆盖面向上,经过真空放电亲水化处理后使用。取5 μL 稀释后的蛋白质样品滴于铜网中心(碳膜面朝上),等待样品吸附1 min,用滤纸边缘吸走多余的液体。将3 个5 μL 0.75%(质量体积浓度)甲酸双氧铀染液滴置于疏水薄膜,铜网碳膜面朝下蘸取染液,并立刻吸走多余染液,重复2 次。最后,吸取5 μL 染液静置染色1 min,用滤纸吸取多余的染液。然后将铜网碳膜朝上置于滤纸上,65 ℃照射5 min,至铜网完全干燥。将干燥的样品用120 kV 透射电镜观察,放大倍数设置为92 000 倍,欠焦值为-2~-1 μm,选择衬度好、颗粒分散性好、形态均一、浓度合适的区域收集数据。每张照片拍摄的位置的中心应间隔至少2 μm,以确保每张照片的视野没有重叠的区域,收集到的颗粒均不重复。将收集的原始图片数据用EMAN2 软件进行颗粒抽取,然后从EMAN2 软件中将抽取颗粒的图像和位置信息全部导入RELⅠON3.0 软件,经过对采集数据的处理最终产生一个目的复合物的三维重构模型。
1.2.4 Shelterin复合物结构初步分析 将获得的三维重构模型与已发表的裂殖酵母亚复合物高分辨率结构进行拟合。亚复合物Rap1PBM-Poz1-Tpz1PBM(PDBⅠD:5XXF)、Ccq1TAD-Tpz1CBM(PDB ⅠD:7CUJ)、Pot1OB3-Tpz1PⅠM(PDB ⅠD:7CUⅠ)、Pot1OB1-OB2(PDBⅠD:7CUH)高分辨率结构均由PDB 数据库检索获得。将上述结构导入USFC Chimera 软件,与我们所获得的重构模型进行拟合,以推测各组分在整个Shelterin复合物中大致的分布以及取向情况。
2 结果
2.1 Shelterin复合物的表达与纯化结果
E. coli体系经18 ℃诱导,能大量表达目的蛋白质。经过Ni-NTA 亲和层析,除去了大量杂蛋白质,但可以看出,洗脱后的样品纯度依然不高。之后,经过His-ULP1处理以及谷胱甘肽琼脂糖凝胶亲和层析,可以获得纯度较高的样品(图2A)。为获得性质均一的蛋白质样品,我们又将获得的样品浓缩至1 mL后,以0.4 mL/min 的流速进行SuperoseTM6 10/300 GL 凝胶过滤层析,最终得到了性质均一,并且组分齐全、比例合适的样品,目的蛋白质在SuperoseTM6 10/300 GL分子筛上大量被洗脱的体积为15.16 mL(图2B),经SDS-PAGE 检测对应出峰位置的蛋白质样品组成情况,可以证明蛋白质样品纯度较高、组分齐全且比例合适(图2C)。
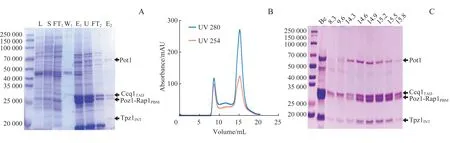
图2 裂殖酵母Shelterin复合物的体外表达与纯化Fig 2 Expression and purification of S.pombe Shelterin complex in vitro
2.2 电镜数据收集与处理
从120 kV 电镜的视野下观察被甲酸双氧铀覆盖的样品,可以看见,蛋白质颗粒的形态被染盐衬托得较为清晰,颗粒与颗粒之间的距离合适。颗粒直径约为15 nm,结合凝胶过滤层析结果,推测所纯化出的复合物为二聚体。在视野中能看见存在不同角度投影的形态信息,这说明蛋白质颗粒的多角度数据都能被收集(图3A)。可以通过后期的数据计算,获得较为立体的颗粒结构信息。在92 000倍的放大倍数下,每张照片采集间隔2 μm 的距离,收集到负染图片83 张,用EMAN2 软件[26]挑选了18 659 个颗粒,然后使用Relion3.0 软件[27]对所有的颗粒进行2D 分类(图3B)、初始模型构建、以及3D 分类和3D 优化处理获得Shelterin五元复合物的负染三维结构模型。使用USCF Chimera 软件对计算出的模型进行评测,可以看出目的蛋白质颗粒结构特征明显,三维重构效果良好(图3C),挑选出的颗粒角度分布均匀(图3D)。
2.3 Shelterin复合物结构初步分析
3D 分类后的每个分组的颗粒个数基本均匀,选择其中结构形态各部分过渡最均匀的为模版进行优化处理,最终获得一个分辨率为17 Å(1 Å=0.1 nm)的三维模型(图4A),整个蛋白质复合物大小为145 Å×120 Å×110 Å(图4B)。然后我们利用UCSF Chimera软件[28]将PDB 数据库[29]中已有的裂殖酵母相关高分辨率Shelterin亚复合物的结构与我们获得的模型进行拟合和匹配。
根据近年来发表的多种裂殖酵母Shelterin 亚复合物的结构信息可以得知:①Rap1PBM-Poz1-Tpz1PBM可以通过Poz1 的N 端前2 个α 螺旋形成反向平行的二聚体[19]。②在Ccq12-439-Tpz1406-508-Poz1FL复合物中通过基于双琥珀酰亚胺亚砜(disuccinimidyl sulfoxide,DSSO)的交联质谱分析鉴定出Ccq1 的N端(氨基酸残基:2~439)与Poz1 之间有广泛的相互作用[30],并且在Tpz1 组分中与Ccq1 以及Poz1 产生相互作用的2 个结构域Tpz1CBM、Tpz1PBM紧密相邻。这说明,Ccq1 与Poz1 组分在空间位置上相近。③有相关的负染电镜结果表明,在Ccq12-439-Tpz1406-508-Poz1FL二聚体中,2 个Ccq1 组分由于缺失C 端结构域,会采取相对自由的取向[30]。所以,在我们进行匹配的模型中,将2 个Poz1-Tpz1PBM组分放在空间结构上接近的位置,2 个Ccq1TAD分别放在与2 个Poz1 相近的位置。然后,由于Tpz1PⅠM和Tpz1CBM通过(GGS)2肽段连接,所以在匹配过程中我们将与Tpz1PⅠM有相互作用的Pot1OB3-Tpz1PⅠM,以及与Tpz1CBM有相互作用的Ccq1TAD-Tpz1CBM放置在相近的位置。最后,将Pot1OB1-OB2组分放置在整个结构中相对独立、占比大、且有对称倾向的“三角形”的两边。从分子对接结果可以说明所有高分辨率结构与重构模型匹配情况良好,进而大致确定了各亚基在重构模型中的相对位置(图4C)。

图4 Shelterin复合物三维重构模型和各亚基的分子对接情况Fig 4 3D reconstruction of the Shelterin complex and docking of solved structures into the overall envelope
3 讨论
Shelterin 复合物是结合在真核生物端粒区域,维持基因组稳定的重要复合物[2]。它保护端粒,防止其被识别为双链DNA 而发生断裂,并能够调控端粒酶的结合[3],保证端粒DNA 复制正常进行[4]。正由于Shelterin复合物在端粒末端保护方面的重要性,其组分缺失、突变[31]或是复合物组分间相互作用的破坏[16]都会造成端粒功能紊乱,导致基因组稳定性被严重破坏,进而导致疾病的发生。
最近几十年以来,研究人员已经从进化上、功能上、结构上对多种生物的Shelterin复合物开展了广泛的研究[3,11,32]。这些研究的成果对帮助我们理解端粒末端稳态调控的具体机制提供了宝贵的理论依据。但是到目前为止,由于Shelterin复合物分子量巨大,并且在结构上具有高度的可变性,所以尚未有完整的复合物的结构被解析出来。而Shelterin复合物行使调控端粒异染色质形成[33]以及端粒酶结合等功能[34],都要依赖于复合物的正确组装。所以,对Shelterin复合物整体结构的解析,将会更全面地阐明其与端粒DNA 结合的情况,解释Shelterin 整体复合物的组装机制,从而便于从整体上来认识Shelterin 复合物的功能。
我们之前的工作解析了裂殖酵母Shelterin三元复合物(Rap1-Poz1-Tpz1)的晶体结构[19],本研究在此基础上采用在体外表达并重组裂殖酵母Shelterin复合物的方法,首次获得了一个裂殖酵母Shelterin五元复合物(Rap1-Poz1-Tpz1-Ccq1-Pot1)的低分辨率结构。我们对已有的高分辨率复合物组装方式进行分析,并将这些高分辨率结构与我们获得的重构模型进行分子对接,大致确定了各组分在整个复合物中的分布情况。另外,我们的凝胶过滤层析结果与结构模型直接说明了该复合物是一个二聚体,这对复合物高分辨率结构的解析和组装机制的揭示有重要的意义,也对理解Shelterin 复合物发挥功能的分子机制提供了重要线索。但为了解析复合物组分间具体的相互作用情况,我们还需要获得更高分辨率的结构信息。接下来,我们还需要着手筛选适合冷冻观察Shelterin 复合物的条件,用冷冻电镜来分析裂殖酵母Shelterin 复合物的结构,获得复合物的高分辨率信息,以更加精细地揭示Shelterin 复合物发挥各项调节作用的结构基础。
