Wolfram 综合征1例报道并文献复习
2022-05-05杨媛汪治华李玛丽刘超
杨媛 汪治华 李玛丽 刘超
1 西安医学院附属医院 内分泌科,西安 710021;2西安市儿童医院 内分泌遗传代谢科,西安710003
1 临床资料
患者,女,12岁,因“多饮、多尿8 a,加重伴视力下降2月”住院。8年前患者无明显诱因出现多饮、多尿,日饮水量2 800~3 500mL,尿量3 200~3 900mL,就诊于某院,查随机血糖15.9 mmol/L,多次查空腹血糖波动在8.8~14.5 mmol/L,诊断为“糖尿病”,予胰岛素治疗后临床症状好转出院。此后坚持胰岛素及饮食控制血糖,期间曾有反复低血糖发作,血糖最低达1.9 mmol/L,进食后可缓解,就诊当地医院建议暂停胰岛素1月观察,期间空腹血糖波动在3.3~6.1 mmol/L,1月后继续胰岛素控制血糖,血糖控制尚可。2月前患者无明显诱因再次出现多饮、多尿,尿量4 000~5 000mL/d,饮水量3 800~4 900mL/d,伴视力下降,曾就诊外院,考虑“糖尿病视网膜病变”,眼底镜检查未见异常,建议继续胰岛素控制血糖,眼科随诊。现患者多饮、多尿仍不缓解,监测血糖波动在5.2~10.8 mmo/L,视力下降逐渐明显再来就诊。
1)既往史及个人史,无异常。
2)家族史:父母及姐姐均体健,均否认糖尿病病史。弟弟8岁,诊断为“糖尿病”4 a,胰岛素控制血糖中,血糖控制尚可。家族中否认近亲婚配。
3)查体:体温36.9℃,脉搏92次/min,呼吸28次/min,血压95/65 mm Hg;身高148 cm,体质量49 kg,体质量指数22.37 kg/m2;腰围72 cm,臀围79 cm。神志清,精神反应可,口唇无发绀;双肺呼吸音清,心率92次/min,未闻及心脏杂音;腹软,无压痛;双下肢无浮肿,足背动脉搏动有力,皮温正常;肌力、肌张力、病理征及脑膜刺激征未见异常。
2 辅助检查与治疗情况
1)尿常规:葡萄糖(+++),尿酮体(-),尿p H 6.5,尿比重1.01。尿β2 微球蛋白665 ng/mL。空腹血糖8.36 mmol/L。糖化血红蛋白9.3%。
2)糖尿病自身抗体五项:谷氨酸脱羧酶抗体、胰岛细胞抗体、胰岛素自身抗体、锌转运蛋白8抗体及蛋白络氨酸磷酸酶抗体均为阴性。
3)胰岛素测定:23.25μU/mL;C 肽,0.05 ng/mL。
4)葡萄糖耐量试验:0 min 18.08 mmol/L;30 min 25.15 mmol/L;60 min 29.16 mmol/L;120 min 33.3 mmol/L;180 min 29.19 mmol/L。
在夜间无列车运行时段,杂散电流监测装置测得的是参比电极的本体电位,在白天列车运行时段,测得的是参比电极与钢筋的电压,将该电压减去夜间测得的参比电极的本体电位,即得到钢筋极化电压的正向偏移值,将此偏移值进行30 min平均值计算,并将计算的平均值作为判断杂散电流腐蚀是否超标的依据[7]。因此,在杂散电流腐蚀防护工程中,将参比电极作为测量钢筋极化电压的基准,对于极化电压测量的准确性起着至关重要的作用。当参比电极出现异常或损坏情况时,所得到的极化电压值亦会出现错误。
5)胰岛素释放试验:0 min 4.41μU/mL;30 min 6.91μU/mL;60 min 5.35μU/mL;120 min 5.2 μU/mL;180 min 3.55μU/mL。
6)C 肽释放试验:0 min 0.47 ng/mL;30 min 0.84 ng/mL;60 min 0.79 ng/mL;120 min 0.78 ng/mL。
7)肝肾功能、甲状腺功能、胰岛素样生长因子-1、促肾上腺皮质激素、皮质醇、性激素,均未见异常。
8)眼底检查,视神经萎缩。
9)双耳听力检查,正常。
10)B超,双侧输尿管轻度扩张。
11)MRI,垂体后部T1高信号缺如。
12)禁水加压素实验,因我院不能进行血尿渗透压检测,故利用公式计算血浆总渗透压:血浆渗透压=2×(血钠+血钾)+血糖+血尿素氮。患者禁水后尿量无明显减少,根据患者目前年龄大于7岁(或者体质量>20 kg),给予口服醋酸去氨加压素片100μg后尿量明显减少,血浆渗透压升高,提示中枢性尿崩症。见表1。
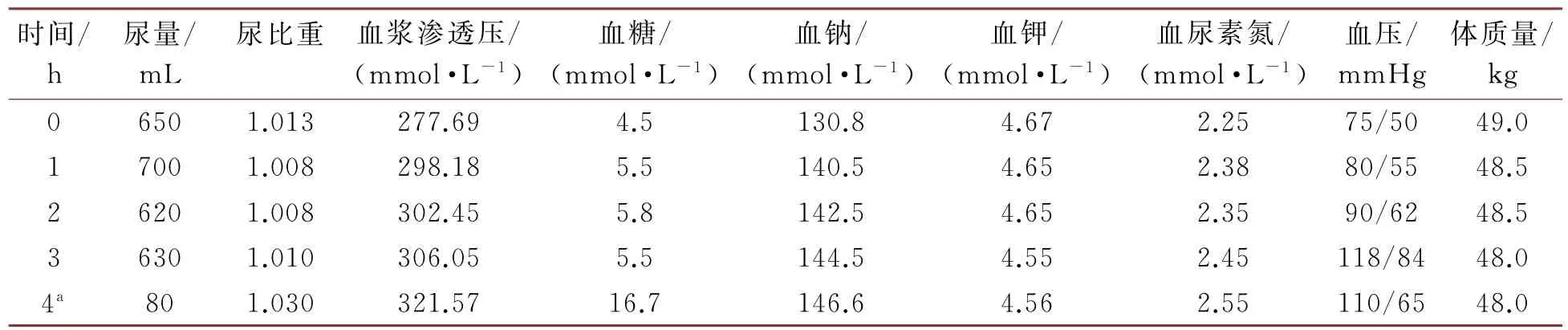
表1 禁水加压素实验结果
13)征得知情同意后行基因检测,并Sanger验证。发现患者及其弟均有WFS1基因第8外显子c.1174C>T(p.Q392X)(如图1 所示)和c.1249-1263dup15(如图2所示)复合杂合变异。父亲携带c.1174C>T(p.Q392X)杂合变异,母亲及姐姐携带c.1249_1263dup15(p.F417_I421dup)杂合变异。符合Wolfram 综合征1型常染色体隐性遗传方式。
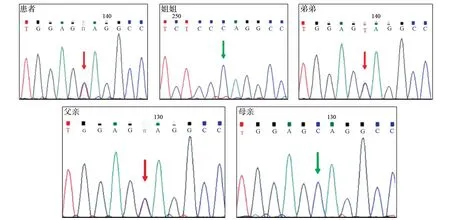
图1 患者WFS1基因c.1174C>T(p.Q392X)变异(均来自父源)
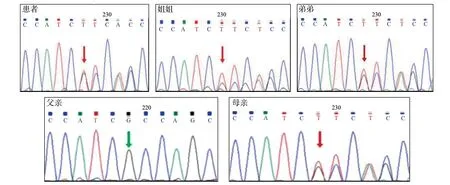
图2 患者WFS1基因c.1249-1263dup15(p.F417-I421dup)突变(均来自母源)
14)治疗情况:给予胰岛素控制血糖,醋酸去氨加压素治疗中枢性尿崩症,同时给予维生素B12营养神经治疗。治疗后血糖维持在6.3~8.2 mmol/L,尿量1 000~2 000mL/d。
3 讨论
Wolfram 综合征临床表现复杂多样,据相关文献[1]报道主要包括:①糖尿病常为其首发症状,多在儿童期发病,为非自身免疫性胰岛素依赖型糖尿病;②视神经萎缩为第2个出现的症状,多在11岁左右出现,伴视力下降,部分患者可有色盲、色素性视网膜炎、眼球震颤等;③耳聋为感音性耳聋,常累及高频段,发生率约占70%;④中枢性尿崩症发生率约51%~87%,平均年龄14岁,对醋酸去氨加压素反应可。其他少见症状:小脑共济失调、痴呆或智力迟钝、性腺功能减退、甲状腺功能减退、生长迟缓、先天性心脏病等[2]。MRI可发现:神经垂体正常高信号消失、视觉通路萎缩、下丘脑和垂体变薄等[3]。
目前,Wolfram 综合征诊断共识为同时具有青春期起病的糖尿病及视神经萎缩,伴或不伴其他临床表现,即需考虑此病可能[4]。本例患者以糖尿病为首发症状,早期误诊为1型糖尿病,但未见酮症酸中毒,曾有反复低血糖发生,胰岛素自身抗体为阴性,符合非自身免疫性胰岛素依赖型糖尿病。当出现视力下降时,误认为与糖尿病视网膜病变有关,最终确诊为与视神经萎缩有关。患者多饮、多尿无法用糖尿病解释,行禁水加压素试验提示中枢性尿崩症。
临床考虑Wolfram 综合征,但尚需警惕Alstrom 综合征及Bardet-Biedl综合征。有文献[5-6]报道,Alstrom 综合征及Bardet-Biedl综合征婴儿期可见胰岛素抵抗、肥胖、原发性心肌病、视力下降、神经性耳聋等,胰岛素抵抗最终形成2型糖尿;在青春期及成年期以2型糖尿病、高甘油三酯血症、扩张型心肌病等为主要症状;视力下降多为视网膜色素变性导致;多尿为进行性肾功能不全引起;Bardet-Biedl综合征多伴有多指或并指畸形,智力发育迟缓,这些在Wolfram 综合征及Alstrom 综合征中均较为少见症状。
Wolfram 综合征临床表现复杂,根据诊断共识,仍有部分患者漏诊、误诊。因此,精确诊断需基因检查。Wolfram 综合征是由WFS1 基因突变导致其编码wolframin蛋白功能障碍或缺失引起的常染色体隐性遗传性疾病。WFS1 基因位于染色体4qp16.1,由8个外显子组成。wolframin蛋白主要位于内质网内,在胰腺β细胞、脑及心脏中高度表达[7]。WFS1基因缺失会导致内质网Ca2+稳态失衡,增强胰岛β细胞及神经元细胞中内质网应激水平,触发细胞凋亡信号通路,特别是胰岛β细胞的进行性破坏引起胰岛素分泌障碍,导致糖尿病[8-10]。本例患者检测出WFS1基因上第8号外显子存在c.1174C>T(p.Q392X)和c.1249-1263dup15复合杂合变异,经家系验证符合常染色体隐性遗传,进一步证明了该患者Wolfram 综合征的临床诊断。c.1174C>T(p.Q392X)变异为已知的Wolfram 综合征相关基因变异,该变异为终止变异,会导致蛋白质的合成提前终止,该变异在两名Wolfram syndrome患者中以复合杂合形式被检出[11-12]。患者存在c.1249-1263dup15(p.F417-I421dup)变异,该变异为氨基酸的整码插入变异,可能导致蛋白质长度改变,该变异既往未见相关文献报告,本研究则首次报道中国人群中位于第8 号外显子c.1249-1263dup1(p.F417-I421dup)变异。患者弟弟诊断糖尿病4年,因均携带上述两种变异,目前暂未出现视力下降、听力受损及尿崩症等,故后期需密切关注。
Wolfram 综合征为多系统受损疾病,呈进行性进展,预后欠佳,极易误诊、漏诊,故需尽早基因诊断。临床上遇到1 型糖尿病患者时若出现视力下降,无法用糖尿病视网膜病变解释,或者血糖控制平稳仍有多饮、多尿,应警惕Wolfram 综合征,尽早行基因检测确诊。
