原代人气道基底细胞的分离与培养
2022-05-05张文平刘姿贾建超魏立张晓菊
张文平 刘姿 贾建超 魏立 张晓菊
1 河南省人民医院/郑州大学人民医院/河南大学人民医院 呼吸与危重症医学科,郑州 450003;2河南省人民医院/郑州大学人民医院/河南大学人民医院 胸外科/肺移植科,郑州450003
人气道基底细胞存在于气管和较大支气管的上皮内,是复层纤毛细胞和分泌细胞的祖细胞,约占假复层黏膜纤毛上皮细胞的30%。基底细胞紧紧黏附于气道黏膜上皮的基底层,不像其他类型的上皮细胞(如复层纤毛柱状上皮细胞、分泌细胞和神经内分泌细胞)那样向管腔内延伸[1]。人气道基底细胞特异性表达基因包括编码转录因子Trp63、细胞角蛋白Krt5、整合蛋白α6(Itga6)、平足蛋白(Pdpn,另名T1α)和跨膜神经因子生长因子受体(Nfgr,另名p75)[2]。基底细胞在气道损伤后的再生修复中发挥着重要作用。近年来利用气道基底细胞体外培育肺的类器官用于研究肺部疾病发病机制和药物试验是研究热点[3]。基底细胞的分离和培养是体外试验的关键技术。本文介绍使用人气管或支气管标本分离原代基底细胞及其培养传代的方法。
1 材料与方法
1.1 材料
1.1.1 标本来源
气管和较大的支气管标本来源于河南省人民医院肺移植中心肺移植手术弃用的供肺和切除的病肺。无菌条件下使用手术器械将气管、左右主支气管或叶段支气管分离出来,离断并保存于含美罗培南100μg/mL、万古霉素20μg/mL 和两性霉素B 250 ng/mL的PBS中,标本保存在4 ℃冰箱,时间不超过12 h,应尽快进行分离气道基底细胞。
1.1.2 主要试剂与器材
含谷氨酰胺DMEM 培养液(Gibco 11995073),EpiX Base培养液(Propagenix 276-201),Ham's F-12 Nutrient Mix(Thermo Fisher 11765062);胶原酶P(Sigma-Aldrich 11213873001),蛋白酶XIV(Sigma-Aldrich P5147),DNase Ⅰ(Sigma-Aldrich 10104159001),Purecol(Sigma-Aldrich 5006),p63-α(D2K8X)XP®RabbitmAb(Cell Signaling Technology 13109S),Anti-KRT5 mousemAb(Sigma-Aldrich SAB4100508),Goat anti-Rabbit IgG-Cy3(Bio Vision 6903-250),Goat Anti-Mouse IgG-Cy5(Southern Biotech 1030-15),Alexa Fluor 647 goat anti-Rabbit IgG (Novus Biologicals NBP1-72732AF647);0.01 mol/L HCl,二硫苏糖醇(DTT),1%(v/v)青霉素/链霉素(工作浓度100 ng/mL),5% (v/v)庆大霉素(Sigma-Aldrich G1272,工作浓度500 ng/mL),美罗培南(Pharmacy 63323050830,工作浓度100μg/mL),万古霉素(Pharmacy 6332302840,工作浓度20μg/mL),两性霉素B(Thermo Fisher BP2645-50,工作浓度250 ng/mL),乳酸林格氏液(Abbot#7953),0.05%(v/v)胰蛋白酶-EDTA 酚红(Thermo Fisher Scientific 25300120),FBS,Di H2O,DMSO,2%(v/v)多聚甲醛,BSA,0.3% (v/v)Triton X-100,Ever BriteTMHardset Mounting Medium with DAPI(Biotum 23004),ViaStainTMAOPI 染液(Thermo Fisher NC0285242);0.2μm过滤器(Thermo Scientific F2613-17),Nunc®Lab-Tek ⅡCC2 Chamber Slide System(Thermo Scientific 154917 PK),无菌手术刀、手术剪和镊子,培养皿,长颈培养瓶(T75 T175),Falcon离心管(15mL/50mL Fisher Scientific 14-959-70C 14-959-49a),细胞计数板,CO2温箱,自动细胞计数仪2000(Nexcelom Biosicence)。
1.2 方法
1.2.1 气道基底细胞的分离
气道基底细胞的分离、传代和保存各项操作均在超净工作台中进行。
1)Purecol包被培养瓶。5mL 无菌0.01 mol/L HCl加入15 mg PureCol®(15 mg/瓶),充分溶解。每个T75培养瓶需要100μL Purecol+7mL无菌PBS,充分铺满整个培养瓶。每个T175需要200μL Purecol+14mL无菌PBS,充分铺满整个培养瓶。停留1 h后,弃去Purecol溶液,UV 光照15~30 min。包被好的培养瓶放入4 ℃冰箱保存。
2)配备冲洗液、消化液、松解液。冲洗液为含0.2%(v/v)青霉素/链霉素和500 ng/mL 庆大霉素的谷氨酰胺DMEM 培养液。消化液为含1%(v/v)Protease XIV 和10μg/mL DNase的PBS,配置后需0.2μm 过滤器过滤。松解液含0.5 mg/mL DTT、0.25 mg/mL 胶原酶P、10μg/mL DNase的PBS,配置后需0.2μm 过滤器过滤。以上溶液均保存于4 ℃冰箱。
3)配置培养基。EpiX Base培养液500mL 加入1%(v/v)的P/S 5mL、5%(v/v)的庆大霉素5mL 和Amphotericin B 500μL。Ham's F-12 Nutrient Mix培养液加入100μg/mL 的美罗培南、20 μg/mL的万古霉素、250 ng/mL的两性霉素B。
4)气管和支气管组织的消化。第1天进行气管和支气管组织的消化。提前配备冲洗液和消化液。首先,用无菌镊将标本从含抗生素的PBS保存液中取出,置于无菌培养皿中。培养皿中注入30mL无菌乳酸林格氏液。用无菌手术剪和手术镊清除气管或支气管周围的软组织及淋巴结组织,同时清理管腔内的血块和分泌物,最后沿着气管或支气管的长轴剪开(图1)。如标本为气管,则应在气管膜部沿长轴剪开。将清理干净后的标本放入15mL/50mL Falcon离心管(根据标本大小选择),以适量冲洗液反复冲洗3次,每次1 min,手动摇晃试管充分清洗,弃去冲洗液。最后向离心管中加入冲洗液和消化液(比例为8mL∶1mL),放置在摇床上4 ℃消化24 h。

图1 清理好的气管标本
5)分离并接种气道基底细胞。第2天进行气道基底细胞的分离和接种。向15mL/50mL Falcon离心管中加入与消化液等体积的FBS 终止消化,混匀。将气管或支气管组织连同消化液一同倒入无菌培养皿,一手持无菌镊固定气管或支气管,一手持无菌手术刀轻轻搔刮气管或支气管内膜,注意一定要动作轻柔,同时应沿不同方向充分搔刮。肉眼可看到刮下的细小的碎片。将培养皿中的溶液回收至15mL/50mL Falcon离心管,并用适量冲洗液反复冲洗组织2~3次,回收冲洗液至上述离心管。1 000~1 100 r/min离心5 min。弃去上清液,以1mL松解液重悬细胞沉淀,注意不要使用移液管吹打,仅以手轻轻拍打震荡离心管使细胞重悬。将离心管置于37 ℃5%(v/v)的CO2温箱中孵育10 min,期间应取出离心管拍打震荡2~3次。在此过程中肉眼可见较大块的细胞沉淀被溶解,离心管内细胞悬液更均匀。
向离心管中加入与松解液等体积的FBS终止消化,然后加入适量冲洗液;再次1 000~1 100 r/min离心5 min;弃去上清液,以1mL EpiX Base培养基重悬细胞。此时可使用移液管吹打混匀,但动作应非常轻柔。最后,将细胞接种于Purecol包被的T75或T175长颈培养瓶。
1.2.2 气道基底细胞的传代
细胞融合度80%左右时可进行传代。具体方法为:弃去培养液,向培养瓶中加入0.05%的胰蛋白酶-EDTA(T175 4mL,T75 2mL);置于37 ℃5%CO2温箱中孵育1 min;离心管内预先放入1mL FBS,使用细胞刮轻柔地将细胞从培养瓶内壁刮下,收集在离心管内。重复上述过程,充分收集瓶内细胞。向离心管中加入含抗生素的Ham's F-12 Nutrient Mix培养液30mL,1 000~1 100 r/min离心5 min。以1mL EpiX Base培养基重悬细胞,接种于Purecol包被的培养瓶中。
1.2.3 气道基底细胞的保存
收集细胞进行计数,保存于10%(v/v)的DMSO 和90%(v/v)的FBS中。通常1×106的细胞保存于1mL体积分数为10%的DMSO90%(v/v)的FBS中。将细胞冻存管放置于Mr Froster内-80℃冷冻24 h,然后转移至液氮中保存。
1.2.4 气道基底细胞免疫荧光染色
接种3×104细胞于腔室载玻片(Nunc®Lab-Tek ⅡCC2 Chamber Slide),待细胞贴壁后弃去培养液。2mL PBS漂洗。加2%(v/v)的多聚甲醛1mL固定细胞,室温下静置10 min,吸去2%多聚甲醛。2mL PBS漂洗1次。如不立即进行染色,加入2mLPBS放入4 ℃冰箱保存。
染色前去除玻片上的隔室。加0.3%(v/v)的Triton X-1001h破膜透化细胞。以含0.5%(v/v)的BSAPBS(PBB)漂洗3次,每次5 min。5%(v/v)的山羊血清(和二抗来源物种相同,溶解于PBB)200 μL室温下封闭45 min。PBB 漂洗3 次,每次5 min。设阴性对照。加100μL 一抗P63(1∶800)、一抗KRT5(1∶1 000)(均溶于PBB)。(如两种一抗同时加,需注意抗体来源物种应不同,避免一抗和荧光团直接结合),4 ℃孵育过夜,为避免玻片干燥可将玻片放置在有水的暗盒内。PBB 漂洗3次,每次5 min。加100μL 二抗Goat anti-Rabbit IgGCy3(1∶200)、二抗Goat anti Mouse IgG-Cy5(1∶200),阴性对照Alexa Fluor 647 Goat anti-Rabbit(1∶200)(均溶于PBB)。室温孵育1 h。PBB漂洗3次,每次5 min。PBS漂洗3次。加DAPI复染细胞核,封片,荧光显微镜下观察染色结果。
1.2.5 气道基底细胞活性检测
将收集到的细胞重悬于FBS中,充分混匀。取上述细胞悬液11μL 在1.5mL Eppendorf离心管内,加等体积(11μL)AO/PI染液,充分混匀。取20 μL上述细胞悬液加入细胞计数板进行计数和活性检测。活细胞细胞核呈现绿色荧光,死细胞细胞核呈现红色荧光。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。正态分布的两样本间的均数比较用独立样本t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 人气道基底细胞的镜下细胞形态
显微镜下细胞呈多边形成片连接,形似蜂巢,细胞间连接紧密。成熟细胞形态较均一,细胞核大,胞浆内可见颗粒。不成熟的细胞个体较大,胞浆及细胞核内可见空泡,随着细胞成熟空泡消失。图2A中细胞为第1代,融合度约80%,细胞形态较均一,无其他形态的细胞混杂。图2B图中箭头所示细胞体积较大,胞浆及细胞核内可见空泡。
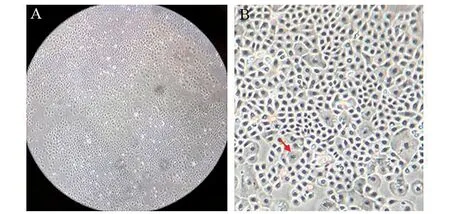
图2 气道基底细胞的形态
2.2 人气道基底细胞免疫荧光染色
KRT-5和P63是气道基底细胞的标记物。通过上述方法得到的人气道基底细胞进行免疫荧光染色,图3A 中蓝色为细胞核,绿色荧光为KRT-5抗体标记。图3B中白色荧光为P63抗体标记。通过免疫荧光染色证实了为气道基底细胞。
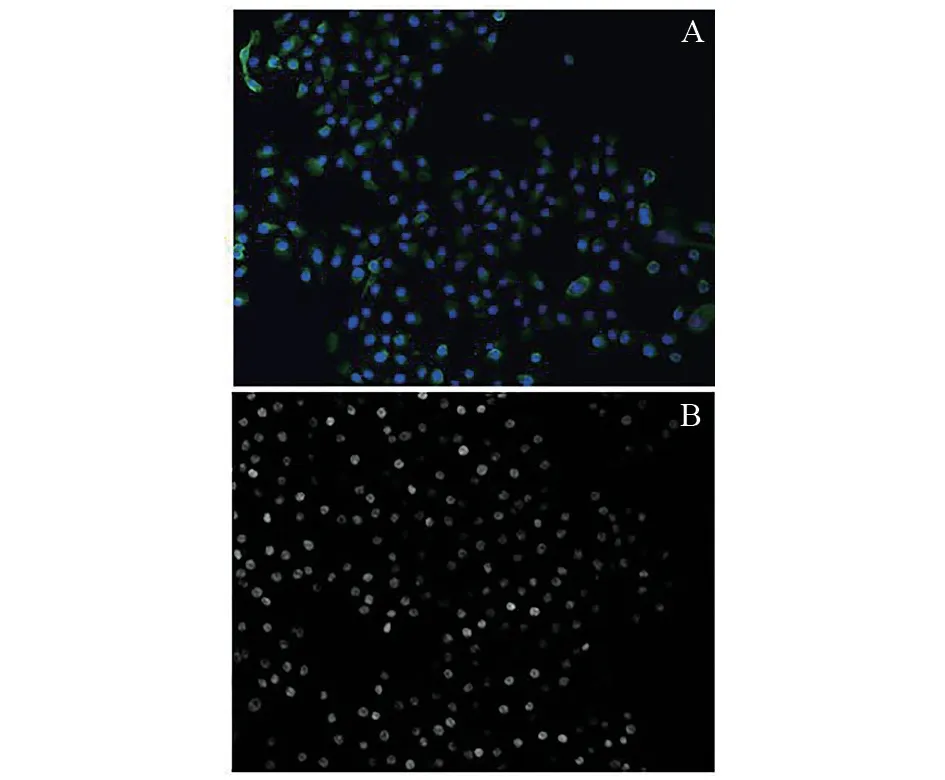
图3 免疫荧光染色的人气道基底细胞
2.3 人气道基底细胞第1代活性检测及数量
自2018年10月至今共成功分离培养38株人原代基底细胞。标本来源宿主中男性21 名、女性17名,年龄中位数59岁(2,77)。其中健康捐献者12例,慢性阻塞性肺疾病(COPD)患者11例,特发性肺纤维化(IPF)患者9例,系统性硬化肺纤维化3例,朗罕氏细胞增生症1例,尘肺病1例,特发性肺高压1例。38株人气道基底细胞第1代细胞活性为81.25%±0.12%。表1显示了健康捐献者和各种疾病来源的人气道基底细胞第1代细胞活性。健康捐献者年龄中位数为35岁,非健康捐献者年龄中位数为60岁。健康捐献者细胞株细胞活性平均值为82.15%±0.09%,非健康捐献者细胞株细胞活性平均值为77.84%±0.13%,两者相比无明显统计学差异(t=0.318,P=0.75)。
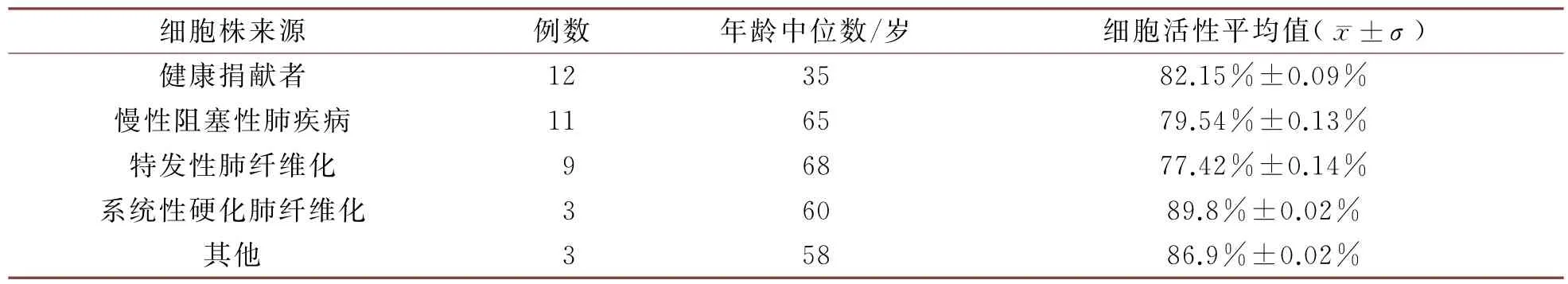
表1 人气道基底细胞株来源及第1代细胞活性
自气道标本分离出基底细胞后接种于培养瓶内,为第0代,经1次传代后为第1代(图4)。由于气道基底细胞具有分化的能力,通常将第1代基底细胞冷冻保存。38株人气道基底细胞第一代细胞的数量中位数为6.0×106;来自于健康捐献者的12株第一代细胞数量的中位数为1.1×107;慢性阻塞性肺疾病组11株中位数为6.0×106;特发性肺间质纤维化组9株中位数为3.5×106;其他疾病组6株中位数为4.0×106。
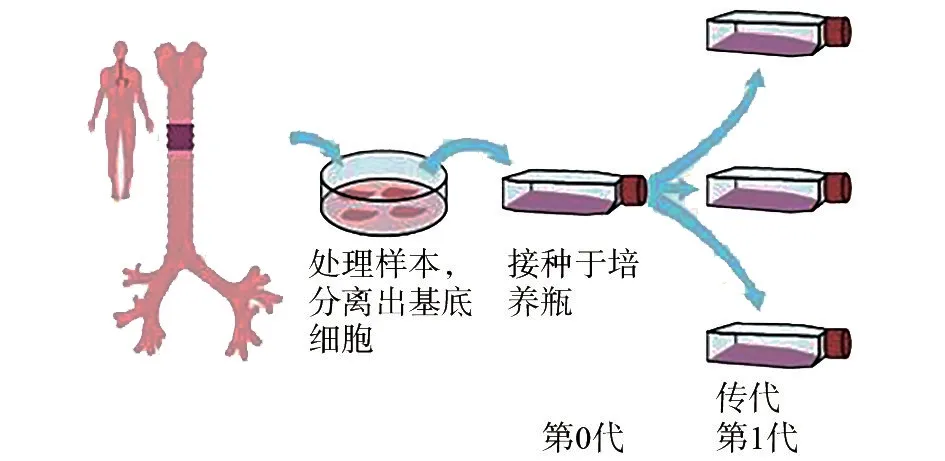
图4 人气道基底细胞分离、培养、传代
3 讨论
肺组织具有一定的再生能力,肺上皮受到损伤后,肺干细胞可进行自我更新和损伤修复来维持和恢复上皮细胞的数量和功能。目前已知内源性肺干细胞包括基底细胞、气道分泌性Club细胞(以往称为Clara细胞)、支气管肺泡干细胞和Ⅱ型肺泡上皮细胞等。在人肺中,Trp63+Krt5+基底细胞存在于气管至直径1 mm 的细支气管。由于正常肺组织间散布着增生区域和转化区域,即使是在正常捐献者的肺组织中,在不同个体之间和同一个体内部,基底细胞的数量和分布也存在差异[4]。虽然不能对人的气道上皮细胞进行基因追踪,但是通过对携带有线粒体细胞色素氧化酶基因突变的细胞集落的大小和组成进行分析可作为基因追踪的替代方法[5]。研究结果提示基底细胞中存在多能干细胞可以随机分化为分泌细胞和纤毛细胞,维持细胞数量的稳定。可利用鼻腔上皮细胞、较大的气道标本和支气管刷检标本进行基底细胞的分离和培养。Trp63+Krt5+基底细胞最有效的扩增传代方法是在Rho激酶抑制剂Y-27632存在的条件下,在辐照过的3T3-J2鼠成纤维细胞上进行培养[6],或者与Rho激酶抑制剂,通过BMP和TGFβ信号通路的Smad依赖信号抑制剂和Wnt信号激活剂一起培养[7]。
以本方案分离和培养人气道基底细胞成功率高,细胞纯度高,细胞活性也较高。但也存在以下常见问题:①细胞非常敏感,本试验中来自于健康捐献者、COPD 和其他疾病患者的细胞株的第一代细胞中均存在细胞数量较少的情况。在分离过程中应注意操作需非常轻柔,离心时应严格按照方案来设定转速和时间,减少细胞损伤。②由于气道标本并非为无菌状态,尤其是慢性阻塞性肺疾病患者来源的标本合并感染的几率较高,因此即使在保存液和培养液中添加抗生素,在分离和培养气道基底的细胞的过程中发生污染也非常常见。气管或支气管组织自肺组织分离后,保存在添加有美罗培南、万古霉素和两性霉素B的PBS中。由于细胞很敏感,培养液中添加更多种的抗生素不利于细胞生长。为减少细胞被污染的几率,在细胞接种的前3 d,可将培养液中的两性霉素B浓度提高至1 500μg/mL。如发生细胞污染,可参考标本来源宿主的临床信息,比如肺部感染的病原菌和药敏结果在培养液中添加敏感抗生素进行挽救。③本文所用方法分离和培养的气道基底细胞形态较为均一,纯度较高,但有时可能混杂有肺成纤维细胞。肺成纤维细胞镜下呈梭形外观,有伪足样突起。为尽量减少其他类型混杂的可能性,在使用刀片搔刮气管或支气管内膜时应力度轻柔,避免破坏内膜基底层。
成功分离人气道基底细胞是进行体外细胞试验的关键技术。目前的研究热点之一是利用气道基底细胞体外构建3D 肺类器官,从而进行肺的内源性修复机制,以及哮喘和囊性纤维化疾病治疗等方面的研究[8-10]。
