甲醇水蒸气重整制氢Cu-Zn-Al尖晶石催化剂的研究
2022-05-04张楷文刘鑫尧庆绍军张财顺刘雅杰高志贤
张楷文 ,刘鑫尧 ,张 磊,* ,庆绍军 ,张财顺 ,刘雅杰 ,高志贤,*
(1.辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001;2.中国科学院山西煤炭化学研究所,山西 太原 030001;3.晋中学院 化学化工系,山西 晋中 030619)
氢能的开发利用已成为实现“碳中和”的有效途径,其中,水[1]、生物质[2]、甲醇均可以作为氢能来源。随着相关研究的不断深入,甲醇水蒸气重整制氢技术因其原料来源广泛、低副产物、高氢碳比已备受关注,并有望成为中小型现场制氢站解决氢气储运问题的有效办法[3,4]。
甲醇水蒸气重整制氢催化剂有贵金属和铜基催化剂等[5],其中,铜基催化剂因其价格低廉且具有较好的催化性能而被广泛研究[6]。
具有面心立方结构的铜基尖晶石催化剂因其独特的阳离子分布使得还原后的活性Cu在甲醇重整制氢反应中具有更高的分散,并且相关研究表明铜基尖晶石催化剂在反应前无需进行预处理,Cu物种会随着反应的进行表现出“缓释催化”行为[7]。已有的研究大多关于Cu-Al两组分尖晶石,研究了其生成动力学[8]、不同铜源合成[9]对尖晶石缓释催化行为的影响。为进一步调控反应过程中Cu的缓释速率及降低其烧结程度,提高反应稳定性,考虑在二元尖晶石基础上掺杂第三组分阳离子合成三元尖晶石并用于甲醇重整制氢反应中。
Arean等[10]以金属氧化物为原料,在高温(1223 K)下制备得到Cu-Zn-Al尖晶石,研究表明,在Cu-Zn-Al的空间结构中Zn2+更易占据四面体空间位置,Cu2+更易稳定在八面体空间位置。Nestour等[11]以Zn2+、Cu2+、Al3+金属盐溶液为原料,经过溶胶凝胶法制备三元组分Cu-Zn-Al尖晶石,表征结果显示所制备的Cu-Zn-Al尖晶石平均粒径在40 nm左右,并具有较多的阴、阳离子空位。Anand等[12]以金属盐溶液为原料,采用一锅微波燃烧技术合成Cu掺杂Zn-Al尖晶石,研究发现其平均晶粒和发光性均发生了明显的变化,使其在光电催化领域具有广阔的应用前景。以上方法均合成出Cu-Zn-Al尖晶石固溶体,但实验控制因素较多,对目标产物的影响较大,尤其是液相法产生的废液需要进行环保处理,加大了目标产合成的成本。
Hou等[13]通过固相球磨法制备了Cu1−xMgxAl3三元尖晶石固溶体催化剂,通过表征发现Mg2+的掺入会导致结构中Al3+、Cu2+分布发生变化,从而减缓了铜的释放速率,表现出更好的缓释催化行为。Liu等[14]通过固相球磨法合成了Cu-Ni-Al三元尖晶石固溶体,相比Cu-Al二元尖晶石固溶体,它在MSR反应中具有更缓慢的Cu释放速率,在2000 h长期催化评价中表现出极好的稳定性,更具商业化应用前景。但固相球磨法合成铜铝尖晶石存在球料黏连的问题,这将会影响制备产物的均匀性。相比液相法等传统的制备方法,固相球磨法成本低、操作简单、合成路线短、工艺参数少,制备得到的粉体颗粒均匀性好,已成为制备新型纳米材料的优选方式[15]。
基于以上情况,本研究拟采用湿式球磨法,通过固定(Cu+Zn)∶Al = 1∶2.5(molar ratio),改 变Zn含量(Zn = 0.1、0.2、0.3)制备Cu-Zn-Al尖晶石催化剂,通过不同手段表征其晶相结构、还原性能、表面性质,探讨其与甲醇重整制氢“缓释催化”行为的关系。此方法合成的Cu-Zn-Al尖晶石催化剂与商业Cu/Zn/Al催化剂相比,无需预还原处理,且反应稳定性较好,为三元铜基尖晶石缓释催化甲醇重整制氢的开发提供可参考的基础数据。
1 实验部分
1.1 催化剂的制备
以硝酸铜、硝酸锌、拟薄水铝石、柠檬酸为原料,采用湿式球磨法制备Cu-Zn-Al尖晶石催化剂前驱体,步骤如下:首先按比例Cu∶Zn∶Al∶H+(物质的量比)= (0.9、0.8、0.7)∶(0.1、0.2、0.3)∶2.5∶1.5称取原料置入球磨罐中(球料比5∶1)并添加10 mL去离子水,以100 r/min球磨处理10 min使其混合均匀后提高转速至500 r/min球磨处理6 h得到浆状混合料,随后将混合料置入干燥箱中100 ℃干燥处理12 h,即得催化剂前驱体;随后对前驱体在空气中进行焙烧处理,焙烧温度为900 ℃,升温速率为3 ℃/min,焙烧时间为不停留焙烧(0 h),得到尖晶石催化剂样品,命名为CuxZn1−xAl2.5(x= 0.9、0.8、0.7)。
按照上述制备方法,按比例Cu∶Al∶H+(物质的量比)= 1∶2.5∶1.5和Zn∶Al∶H+(物质的量比)= 1∶2.5∶1.5分别制备参比样并命名为CuAl2.5和ZnAl2.5。
1.2 催化剂的表征
TG-DTA表征采用法国凯璞Setline STA-1A同步热分析仪上进行测试。XRD表征采用德国布鲁克斯AXS-D8型X射线衍射仪对样品进行检测。N2物理吸附表征采用贝士德BSD-PM型高性能比表面及微孔分析仪进行检测。H2-TPR表征采用浙江泛泰FINESORB-3010C化学吸附仪进行测试。XPS表征采用赛默飞Thermo Escalab 250光电子能谱仪进行测试。
1.3 催化剂的评价
在课题组自行搭建的甲醇水蒸气重整制氢固定床反应器上对合成的催化剂性能进行评价,所有催化剂无需预还原处理。具体操作流程为:将催化剂研磨、压片、过筛,选择40−80目的催化剂颗粒。取1.45 g催化剂,置于石英管反应器中,反应温度为265 ℃。甲醇水混合原料经微量泵打入到反应器内,水醇物质的量比为2∶1,质量空速2.25 h−1。产物经冷凝器、干燥器处理后,由捷岛GC-1690型气相色谱仪在线分析各种组分含量。
2 结果与讨论
2.1 TG-DTA分析
图1是前驱体在空气气氛下的TG-DTA分析曲线。由图1可见,在150 ℃之前出现第一次失重,主要是由于前驱体中物理吸附水的脱除;在150−230 ℃出现的失重,是由于前驱体中和未反应的柠檬酸的氧化分解,对应DTA曲线中放热峰a和b[16]。在230−330 ℃的失重,是由于前驱体中柠檬酸铜和柠檬酸锌的氧化分解,对应在DTA曲线中的放热峰c;330−600 ℃为前驱体中未反应的拟薄水铝石中结合水的脱除,直至600 ℃后样品质基本保持稳定。
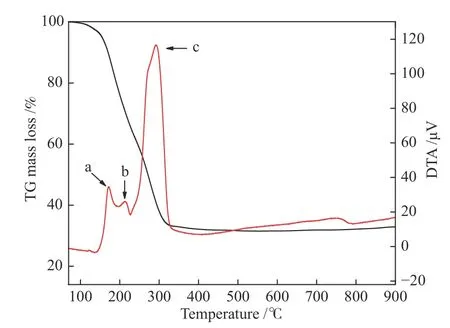
图1 Cu0.8Zn0.2Al2.5前驱体的TG-DTA曲线Figure 1 TG-DTA curves of the precursor of Cu0.8Zn0.2Al2.5
2.2 XRD分析
利用XRD表征分析催化剂的晶相组成,结果见图2,图中还给出了刚玉(Corundum)(图2a)和两个参比样CuAl2.5(图2e)、ZnAl2.5(图2f)的特征衍射图。
与标准Cu-Al尖晶石(PDF#73-1958)和Zn-Al尖晶石(PDF#71-0968)比对,发现CuAl2.5和ZnAl2.5两个参比样均具有尖晶石结构,且不含单一氧化物杂晶相。对于三元CuxZn1−xAl2.5(x= 0.9、0.8、0.7)催化剂,也呈现尖晶石特征衍射峰,没有出现CuO和ZnO的特征衍射峰。结合H2-TPR和XPS分析,样品中都有未反应的CuO和ZnO,表明他们以高度分散的状态存在,这正是使用球磨法所期望的[17]。与数据库Cu-Al尖晶石(PDF#73-1958)的2θ为31.3°(220)、37.0°(311)、44.9°(400)、55.8°(422)、59.4°(511)、65.3°(440)进行比较,发现三个催化剂样品的特征衍射峰均向低角度偏移,位于CuAl2.5和ZnAl2.5的特征衍射峰之间,证明了Cu-Zn-Al尖晶石固溶体的形成[18,19]。

图2 CuxZn1−xAl2.5 (x = 0.9、0.8、0.7)和参比样的XRD谱图及440晶面的XRD谱图放大Figure 2 XRD patterns of CuxZn1−xAl2.5 (x = 0.9, 0.8, 0.7) and reference samples and enlarged XRD peaks of spinel 440 plane a: Corundum; b: Cu0.9Zn0.1Al2.5; c: Cu0.8Zn0.2Al2.5;d: Cu0.7Zn0.3Al2.5; e: CuAl2.5; f: ZnAl2.5
由Scherrer公 式 计 算 出CuxZn1−xAl2.5(x= 0.9、0.8、0.7)催化剂的晶粒粒径见表1。数据显示,与CuAl2.5相比,添加Zn后样品晶粒尺寸变小,其中,Cu0.8Zn0.2Al2.5与其他两个三元尖晶石对比,平均粒径较大为15.3 nm。表1中同时列出了根据尖晶石六个晶面的衍射峰数据计算出的尖晶石晶胞参数平均值。可以看出,随着Zn含量的增加,所得尖晶石的晶胞参数由0.80645 nm增加至0.80716 nm,这是由于Zn2+离子半径(0.06 nm)大于Cu2+(0.057 nm),从而引起了晶胞参数的增大[12]。综上分析,所制三个催化剂均形成了Cu-Zn-Al尖晶石固溶体,且其晶粒尺寸略小于CuAl2.5二元尖晶石。
图2中除尖晶石特征衍射峰外,在25°、35°、43°、52°、57°、77°附近出现刚玉(Corundum)的特征峰(图2a),这可能是由于高速球磨过程中刚玉球的磨损造成的。
2.3 催化剂的物理性质
图3是催化剂CuxZn1−xAl2.5(x= 0.9、0.8、0.7)的吸附-脱附等温曲线,是属于典型的Ⅳ型吸附等温线,呈现出H3型回滞环,说明所合成的Cu-Zn-Al尖晶石催化剂是典型的介孔材料[20]。
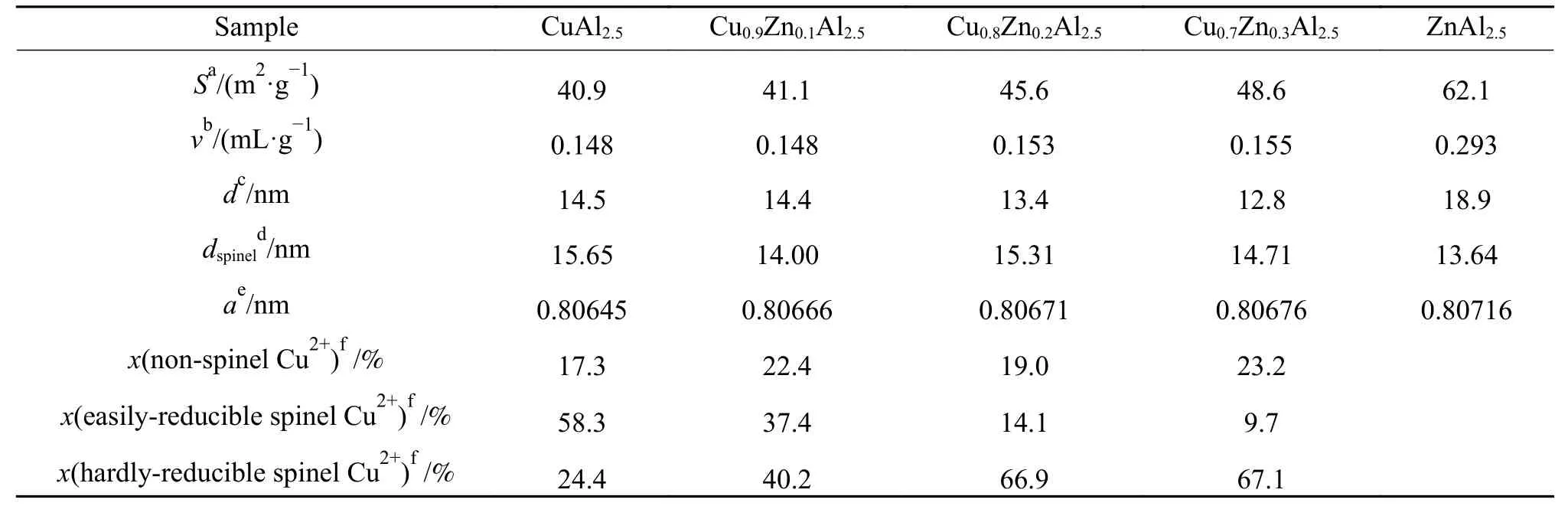
表1 CuxZn1−xAl2.5(x = 0.9、0.8、0.7)及参比样的物化性质Table 1 Physico-chemical property of CuxZn1−xAl2.5(x = 0.9, 0.8, 0.7) and the reference samples

图3 催化剂CuxZn1−xAl2.5 (x = 0.9、0.8、0.7)的吸附-脱附等温曲线Figure 3 Adsorption-desorption isotherms of CuxZn1−xAl2.5 (x = 0.9, 0.8, 0.7) catalysts
CuxZn1−xAl2.5(x= 0.9、0.8、0.7)的比表面积、孔容积和平均孔径见表1。可以看出,三元Cu-Zn-Al尖晶石随着Zn含量的增加,催化剂比表面积由41.1 m2/g增大到48.6 m2/g,这说明Zn含量的增大对增大催化剂的比表面积是有利的。同时,随着Zn含量的增加,孔容积也随之增大,平均孔直径随之减少。传统铜基催化剂比表面积越大,其催化活性一般越好。但本催化剂比表面积与评价结果关联性不好,这说明可能还与其还原性能、表面性质、催化过程中释放的Cu粒径大小有关。以上结果进一步说明了缓释催化过程的复杂性。
2.4 H2-TPR分析
图4为催化剂CuAl2.5和CuxZn1−xAl2.5(x= 0.9、0.8、0.7)的H2-TPR谱图。从参比样CuAl2.5的H2-TPR谱图可以看出,Cu-Al尖晶石催化剂在150−900 ℃呈现宽泛的还原温度区间,这与文献[21,22]得到的结果相同。所有催化材料的H2-TPR谱图都出现了三个还原峰,150−300 ℃(α峰)归属为催化剂中非尖晶石相的铜物种,300−510 ℃(β峰)归属为催化剂中易还原尖晶石铜物种,510−900 ℃(γ峰)归属为催化剂中难还原尖晶石铜物种[21,22]。各还原峰峰温、各还原峰组分含量(通过还原峰积分面积计算)见表2,同时得到催化剂中各铜物种含量见表1。

图4 CuxZn1−xAl2.5 (x = 0.9、0.8、0.7)和CuAl2.5的H2-TPR谱图Figure 4 H2-TPR profiles of CuxZn1−xAl2.5(x = 0.9, 0.8, 0.7) and CuAl2.5
对比CuAl2.5和Cu0.9Zn0.1Al2.5的H2-TPR谱图发现,催化剂中易还原和难还原尖晶石铜物种均向高温方向移动,通过表1可以看出,Cu0.9Zn0.1Al2.5催化剂中易还原铜物种少,非尖晶石相铜物种和难还原铜物种多;结合XRD、XPS分析可知Zn2+进入了尖晶石结构中,说明Zn的引入会显著影响尖晶石中Cu2+的还原性能,使得尖晶石铜物种更难还原。
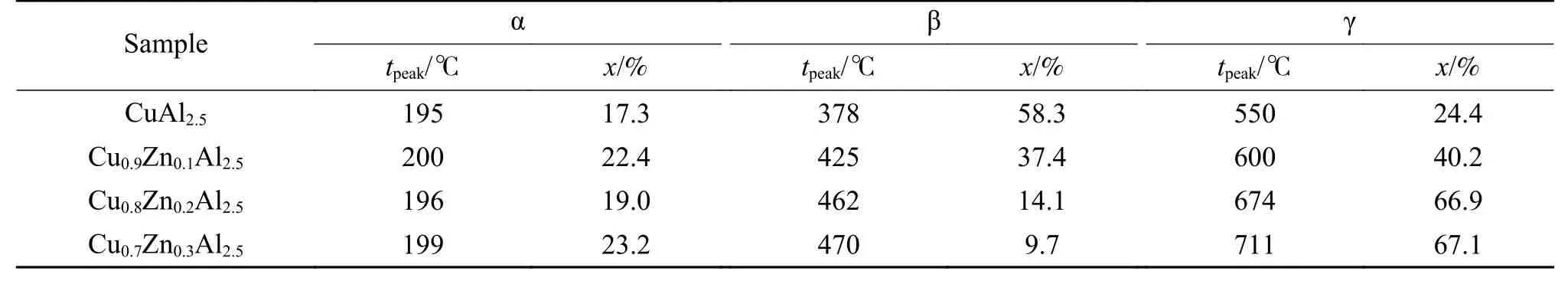
表2 CuxZn1−xAl2.5 (x = 0.9、0.8、0.7) H2-TPR谱图还原峰含量及温度Table 2 Reduction peak content and temperature in the H2-TPR profiles of CuxZn1−xAl2.5 (x = 0.9, 0.8, 0.7)
通过分析CuxZn1−xAl2.5(x= 0.9、0.8、0.7)的H2-TPR谱图,结合表1尖晶石相中难还原组分的含量可知,随着Zn含量的不断提高,难还原尖晶石铜物种含量也随之增加,说明Zn2+进入尖晶石结构中会改变尖晶石中的阳离子分布,从而表现为难还原尖晶石铜物种的变化[13]。由于反应过程中Cu的缓释行为与难还原尖晶石铜物种关联密切,因此,CuxZn1−xAl2.5(x= 0.9、0.8、0.7)尖晶石催化剂在反应过程中会呈现出不同的缓释行为[14]。
2.5 XPS分析
2.5.1 Cu 2p3/2 XPS分析
为表征CuxZn1−xAl2.5(x= 0.9、0.8、0.7)催化剂的表面组成和化学状态结构,进行了XPS测试,所得结果见图5、6、7。由图5可知,Cu 2p3/2主峰结合能为930−938 eV,Cu2+卫星峰(satellite Cu2+)的结合能为938−946 eV[23]。通过XPS peak分析软件将主峰解析成两个峰,分别归属为非尖晶石相Cu2+(932.8 eV)和尖晶石相Cu2+(934.6 eV)[24]。通过对两个峰进行积分得到峰面积S并计算得到催化剂CuxZn1−xAl2.5(x= 0.9、0.8、0.7)和CA2.5表 面Cu2+物种之比:S(spinel Cu2+)/S(non-spinel Cu2+)分别为2.58、13.93、9.61、4.57表现出明显的不同。其中Cu0.8Zn0.2Al2.5催化剂的表相尖晶石Cu2+占比最高。
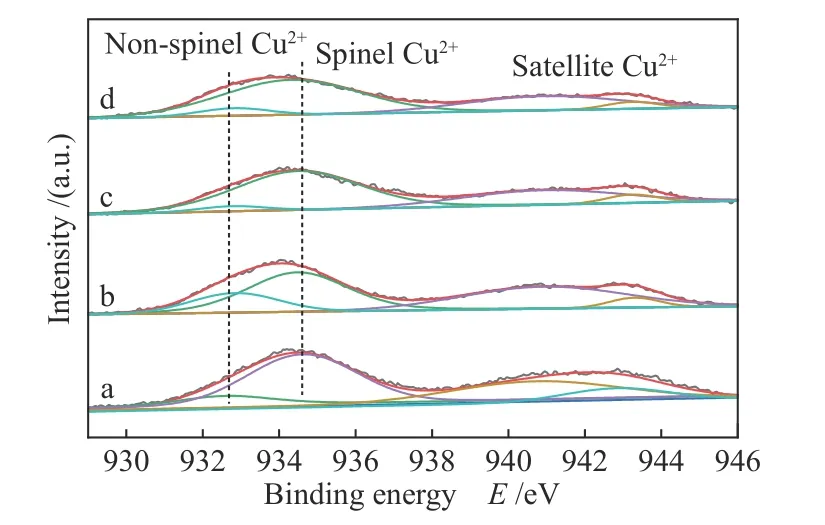
图5 催化剂CuxZn1−xAl2.5 (x = 0.9、0.8、0.7)和CuAl2.5的Cu 2p3/2谱图Figure 5 Cu 2p3/2 spectra of CuxZn1−xAl2.5 (x = 0.9, 0.8, 0.7) and CuAl2.5 catalysts
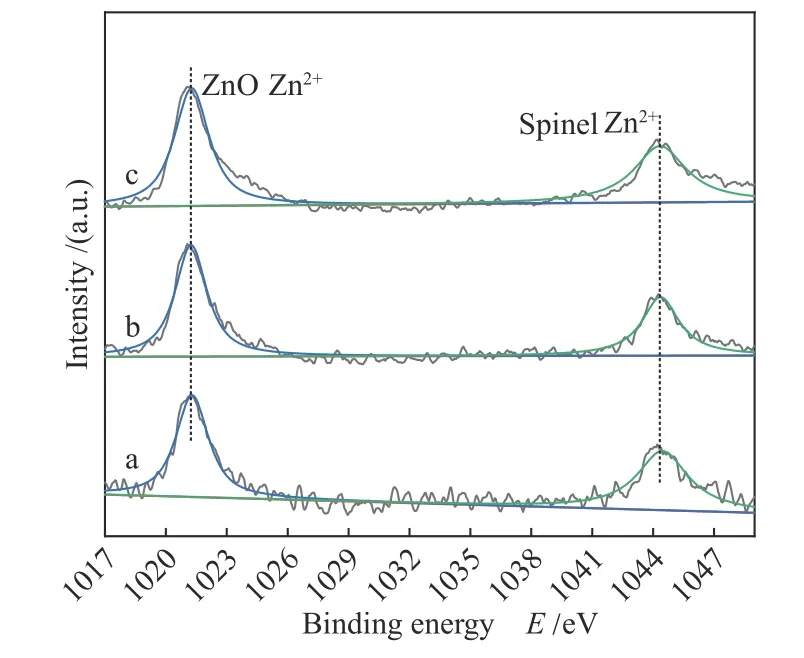
图6 催化剂CuxZn1−xAl2.5(x = 0.9、0.8、0.7)的Zn 2p 谱图Figure 6 Zn 2p spectra of CuxZn1−xAl2.5(x = 0.9, 0.8, 0.7) catalysts
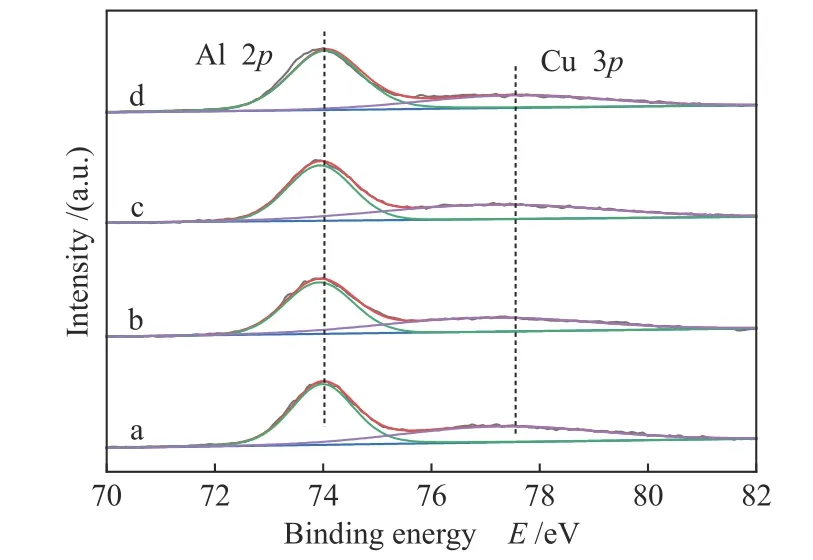
图7 催化剂CuxZn1−xAl2.5 (x = 0.9、0.8、0.7)和CuAl2.5的Al 2p 谱图Figure 7 Al 2p spectra of CuxZn1−xAl2.5(x = 0.9, 0.8, 0.7) catalysts
2.5.2 Zn 2p XPS分析
图6为Zn 2pXPS谱图,分别通过对两个峰进行解析得到峰中心对应的电子结合能分别为1021.2和1044.3 eV,分别归属为游离ZnO的Zn2+和尖晶石相的Zn2+[25]。结合XRD分析,证明了只有部分Zn2+进入了尖晶石结构中,游离的ZnO呈高度分散。通过对两个峰进行积分得到峰面积A并计算得到催化剂CuxZn1−xAl2.5(x= 0.9、0.8、0.7)表面上A(spinel Zn2+)/A(non-spinel Zn2+)分别为0.98、0.65、0.76,说明催化剂表面中非尖晶石相的Zn2+较多。
采用灵敏度因子对催化剂CuxZn1−xAl2.5(x=0.9、0.8、0.7)的Cu 2p3/2(图5)和Zn 2p(图6)峰面积进行校正[26],并计算催化剂表面Cu/Zn比,分别为3.09、1.62、1.11,而其对应的体相组成之比分别为9.0、4.0和2.33,这说明Cu比Zn更容易进入尖晶石结构中。
2.5.3 Al 2p XPS分析
图7为 催 化 剂CuxZn1−xAl2.5(x= 0.9、0.8、0.7)和CuAl2.5的Al 2p谱图。采用灵敏度因子对四个催化剂的Cu 2p3/2(图5)和Al 2p(图7)峰面积进行校正,计算得到催化剂表面Cu/Al比分别为0.17、0.13、0.12、0.15,而体相Cu/Al分别为0.36、0.32、0.28、0.40,这表明,催化剂表面呈现出富铝的特点。这与三元Cu-Mg-Al和Cu-Ni-Al尖晶石的测试结果是一致的[13,14],表明第三组分Zn的加入不会影响尖晶石表面富铝的特性。
2.6 催化剂的性能评价
将所制催化剂用于甲醇水蒸气重整制氢反应,探究Cu-Zn-Al尖晶石催化剂的缓释催化性能。与传统催化剂不同,所有催化剂均未经预还原处理。进料1 h后开始取样分析,每1.0−2.0 h取样一次。MSR反应中副产物主要是CO,其在产物中的含量决定着后期分离任务的难易程度及能耗[27]。
图8是催化剂CuxZn1−xAl2.5(0.9、0.8、0.7)和CuAl2.5的甲醇转化率。由图8可以看出,不含Zn的CuAl2.5催化剂在40 h内转化速率不变,稳定在72%左右。与此比较,添加Zn后的三个催化剂的转化率都有一定幅度的增大,但催化行为存在极大差异。图9是催化剂CuxZn1−xAl2.5(x= 0.9、0.8、0.7)和CuAl2.5的CO选择性。可以看出除Cu0.7Zn0.3Al2.5催化剂其他催化剂在40 h MSR反应中CO选择性均呈现下降趋势,Zn的加入会显著降低CO选择性,其中,Cu0.8Zn0.2Al2.5催化剂40 h内CO选择性降低最多为4%。
如图8所示,Cu0.9Zn0.1Al2.5催化剂反应16 h后转化率开始有所提升,反应进行28 h后转化率稳定在84%左右;Cu0.8Zn0.2Al2.5催化剂反应11 h后转化率明显提升,在16−40 h稳定;Cu0.7Zn0.3Al2.5初始转化率最高,18 h后开始下降,反应进行到26 h后转化率趋于稳定。
以上结果说明少量Zn的引入显著提高了甲醇转化率,其缓释催化行为变化不大。随着Zn含量的增加,催化剂的初始转化率也随之增加,但缓释催化行为有明显的变化。此外,就长时间运行的稳定活性而言,Cu0.8Zn0.2Al2.5表现具有最大的甲醇稳定转化率。
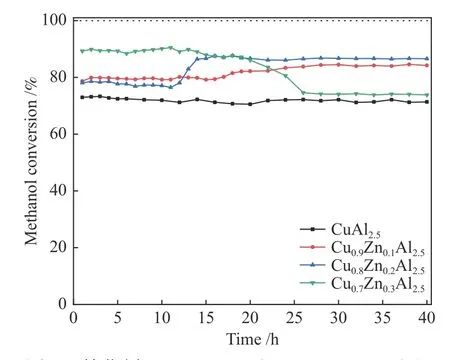
图8 催化剂CuxZn1−xAl2.5 (x = 0.9、0.8、0.7)和CuAl2.5的甲醇转化率Figure 8 Methanol conversion rate curve of CuxZn1−xAl2.5(x = 0.9, 0.8, 0.7) and CuAl2.5
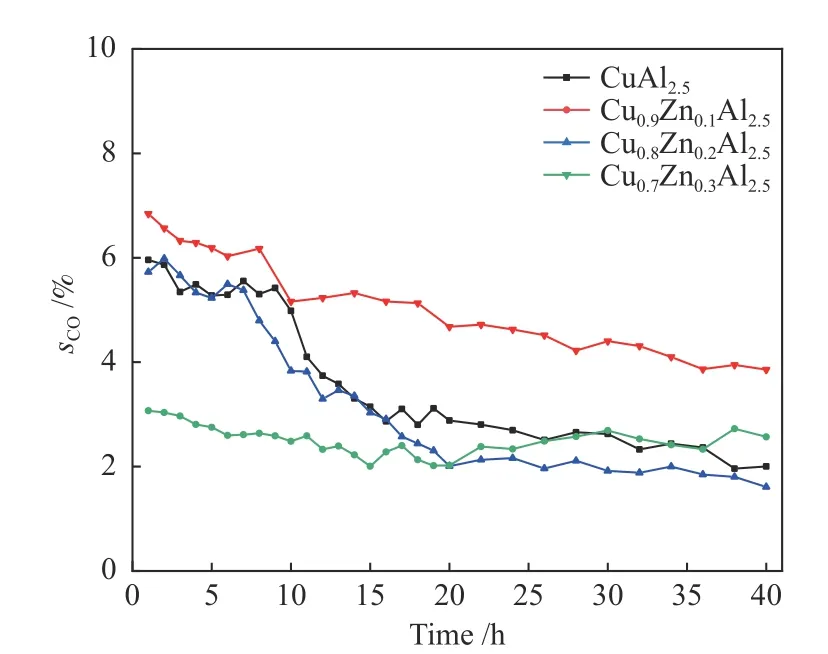
图9 催化剂CuxZn1−xAl2.5 (x = 0.9、0.8、0.7)和CuAl2.5的CO选择性Figure 9 CO production rate curve of CuxZn1−xAl2.5(x = 0.9, 0.8, 0.7) and CuAl2.5
结合分析可知,其尖晶石粒径大、难还原铜物种含量高,因而在MSR反应种呈现出较好的催化活性和稳定性。同时可以看出,Cu0.7Zn0.3Al2.5具有很高的初始转化率,这是由于其具有较多的表面Zn含量和较高的非尖晶石相Cu2+,但烧结速率较快[27]。另外,反应过程中缓释出来的活性Cu的粒径大小也会导致催化活性的差异,这将在接下来对于反应后催化剂的表征中进行探讨。
2.7 评价后催化剂的表征
对评价后的催化剂进行XRD表征,谱图见图10。评价后催化剂的中均出现Cu、尖晶石和α-Al2O3的特征衍射峰。其中,Cu的出现证明了催化剂在不经预还原处理的条件下,在反应过程中能够逐渐释放出活性Cu催化MSR反应。根据Scherrer公式计算Cu平均粒径见表3,Cu0.8Zn0.2Al2.5催化剂反应后Cu粒径17.2 nm为最小,Cu0.9Zn0.1Al2.5反应后Cu粒径最大。Cu粒径大小与催化活性变化是一致的,说明Cu粒径越小越有利于催化反应的进行[13,28]。另外,反应40 h的催化剂中仍含有尖晶石衍射峰,但其衍射峰的强度明显低于新鲜催化剂,形成了缺陷的尖晶石[29,30]。
将反应后的催化剂以3 ℃/min升温至300 ℃在空气中处理60 min,将得到的催化剂进行H2-TPR表征,通过H2-TPR结果计算出Cu的缓释度(RD)见表3,缓释度为分别为34.3%、16.5%、7.1%,所有催化剂都未全部缓释,尖晶石的结构仍然保持。其中,Cu0.7Zn0.3Al2.5催化剂40 h反应后其活性Cu的缓释度仅7.1%,这可能与更多Zn2+进入结构中有关。基于缓释度数据,可以进行两方面的推测。一是Cu0.7Zn0.3Al2.5催化剂缓释度最小,说明缓释形成的活性铜具有最高的本征活性(可以计算40 h累计甲醇转化,再除以缓释出来Cu的量,得到的比值比较),其本质值得进一步探究;二是反应40 h后催化剂中仍有大量Cu未被缓释,就长期运行而言Cu-Zn-Al尖晶石催化剂可能具有更长的稳定活性。
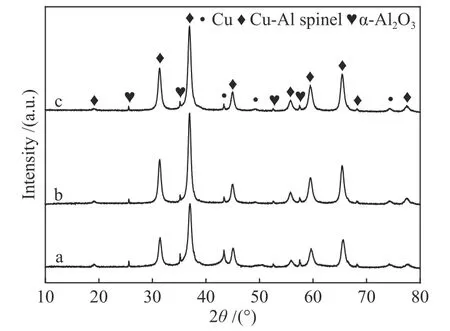
图10 反应后催化剂CuxZn1−xAl2.5(x = 0.9、0.8、0.7)的XRD谱图Figure 10 XRD patterns of CuxZn1−xAl2.5 (x = 0.9, 0.8, 0.7)catalysts after reaction

表3 CuxZn1−xAl2.5 (x = 0.9、0.8、0.7)反应后的特性Table 3 Characteristic data of CuxZn1−xAl2.5 (x = 0.9, 0.8, 0.7) after reaction
3 结 论
在Cu/Zn/Al = 0.9∶0.1∶2.5、0.8∶0.2∶2.5和0.7∶0.3∶2.5(物质的量比)的比例下,焙烧900 ℃(0 h)均可形成Cu-Zn-Al三元体系尖晶石。
与二元Cu-Al尖晶石对比,不同Cu/Zn/Al比例形成的三元尖晶石催化剂尖晶石结晶度高、粒径小、比表面积大及更难还原。三元尖晶石催化剂仍呈现表面富铝特点,且表面上的Cu2+主要以尖晶石存在,而Zn2+的非尖晶石相占比多。
Cu-Zn-Al三元体系尖晶石在MSR反应中表现出比二元尖晶石更好的催化性能,但不同Zn含量样品的缓释行为相差极大。Cu∶Zn∶Al = 0.8∶0.2∶2.5(物质的量比)的Cu-Zn-Al尖晶石催化剂在MSR反应中表现出最好的缓释催化稳定活性,预测出三元Cu-Zn-Al尖晶石催化剂将具有更好催化寿命。
符号说明
FR: 标况下重整尾气流量,mL/min
F: 甲醇水溶液的进料量,mL/min
ρmix: 甲醇和水混合溶液的密度,g/mL
mcat: 所用催化剂质量,kg
w: 水醇物质的量比
ФCO: 重整尾气中CO的含量,%
ΦCO2: 重整尾气中CO2的含量,%
ΦH2: 重整尾气中H2的含量,%
