铁、锰、铜和水杨醛缩金刚烷胺席夫碱配体原位催化5-羟甲基糠醛氧化制备5-甲酰基呋喃-2-羧酸
2022-05-04白继峰程曼芳卢虹竹侯明波王景芸周明东
白继峰,程曼芳,卢虹竹,侯明波,杨 雨,王景芸,*,周明东
(1.辽宁石油化工大学 石油化工学院, 辽宁 抚顺 113001;2.中国石油抚顺石化公司石油二厂, 辽宁 抚顺 113004)
当前,我们正进入一个可利用化石能源日益减少的时代,有限的石油资源使当前的石油基燃料和化学品生产难以为继。因此,已投入大量精力研究可再生资源的转化利用,以满足社会对燃料和化学品不断增长的需求[1]。由于其可再生性和丰富性,生物质可替代石油资源生产各种化学品[2−4]。5-羟甲基糠醛(5-hydroxymethylfurfural,简称HMF)是重要的平台化合物,易于通过纤维素或其衍生糖类化合物合成[5−8]。HMF可通过多种化学反应制备马来酸、甲酸、2,5-二甲酰呋喃(2,5-diformylfuran,简称DFF)、5-甲酰基呋喃-2-羧酸(5-formyl-2-furancarboxylic acid,简称FFCA)和2,5-呋喃二甲酸(2,5-furancarboxylic acid,简称FDCA)等高附加值精细化学品[9,10],其中,由于FFCA分子中含有醛基和羧基等官能团,化学性质十分活泼,可以作为化学反应中间体、合成大环化合物原料及高分子材料单体等,在燃料、化学中间体、药物等领域具有广阔的应用前景[11−13]。
HMF氧化反应路径如图1所示。第一条反应路径是HMF分子中的醛基被氧化成羧基,生成HMFCA,然后HMFCA分子中的羟基被氧化成醛基,生成FFCA;另一条反应路径是HMF分子中的羟基被氧化成醛基形成DFF,然后DFF分子中的一个醛基被氧化成羧基,形成FFCA,最后FFCA可继续氧化为FDCA。由此可以看出,FFCA是HMF氧化反应过程的反应中间体,如何控制氧化反应程度,提高FFCA选择性是HMF氧化制备FFCA反应的关键问题。因此,一些报道通过设计高效催化剂和调控HMF氧化反应条件以提高FFCA选择性[14−17]。
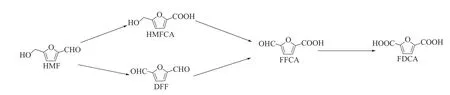
图1 HMF氧化反应路径Figure 1 Reaction path of HMF oxidation
Xu等[14]设计合成一种Fe-Anderson型杂多酸基催化剂Na3H6FeMo6O24·5H2O,以30 mL/min氧气为氧化剂进行HMF氧化反应,比较不同的溶剂、不同的碱性化合物对反应的影响。结果表明,当K2CO3/HMF物质的量比为0.5时,在溶剂N-甲基-2-吡咯烷酮中获得75%的FFCA。但是,该催化剂稳定性差,不能重复使用。Zhu等[15]合成复合光催化剂g-C3N4/NaNbO3催化HMF氧化反应,该复合材料异质结构的形成有效地促进了光致电子-空穴对的分离,加速了电子转移速率,从而减少了(OH)-O中心点的形成,进而提高了FFCA的选择性,在最优化条件下,HMF转化率最高为35.8%,FFCA选择性达87.4%。过渡金属氧化物对HMF氧化反应具有良好的催化活性。Priyanka等[16]通过水热法合成了不同组成的Mn-Fe复合金属氧化物催化剂MnzFeyOx。结果表明,在最佳反应条件(0.5 mmol Na2CO3、140 ℃,90 min和3.0 MPa O2)下,使用Mn3Fe7Ox可得到37.7%的FFCA,催化剂Mn3Fe7Ox至少可循环使用四次。此外,据报道在水中,使用氧气作为氧化剂,混合金属氧化物基催化剂(CuO·CeO2和MgO·CeO2)对HMF表现出良好的活性。在最佳的反应条件下,FFCA的产率达到了90%[17,18]。
综上所述,上述研究在HMF的氧化反应中获得了良好的FFCA收率,但仍然存在一些难题,例如所报道催化剂制备和操作方法复杂;反应需在碱性条件下进行,需要大量酸中和反应液,产生大量工业废水;有些反应使用高压氧气作为氧化剂,反应操作不易控制等。因此,开发廉价、绿色的催化体系,在温和条件下进行HMF氧化反应,高选择性地制备FFCA具有重要的意义。基于上述研究思路,本研究合成了水杨醛缩金刚烷胺席夫碱配体,与锰(II)、铁(Ⅲ)、铜(II)形成原位催化剂,在非碱性、温和条件下催化HMF选择性氧化制备FFCA。该方法反应过程简单且易于控制,催化剂合成及处理成本。
1 实验部分
1.1 试剂与催化剂的制备
试剂:四水合氯化锰,三氯化铁,二水合氯化铜(99%,500 g,Sigma Aldrich), 金刚烷胺(98.5%,25 g,Meryer),水杨醛(99%,500 mL,Meryer),5-羟甲基糠醛(98%,25 g,Aladdin),5-羟甲基-2-呋喃羧酸、2,5-呋喃二甲醛、5-甲酰基呋喃-2-羧酸、2,5-呋喃二甲酸(98%,1 g,Aladdin)。
1.2 席夫碱配体的制备与表征
按照文献报道的方法[19]制备席夫碱配体。将金刚烷胺(2.0 mmol)和水杨醛(2.0 mmol)于20 mL无水乙醇中混合并回流1 h,然后冷却至室温。溶剂自然蒸发7 d后,获得黄色席夫碱配体,反应方程式如图2所示。
1.3 配合物的制备与表征
合成方法参照文献[20]:向含有2 mmol配体的20 mL无水甲醇中分别加入2 mmol NaOH的无水甲醇和含有1 mmol金属盐的甲醇溶液各20 mL,60 ℃回流2 h,然后浓缩直至观察到大量沉淀,将沉淀物过滤,用冷水洗涤并干燥,得到如图3所示的三种配合物。
配合物1: C34H40MnN2O2(563.62): elemental analysis calcd.: C, 72.45, H, 7.15, N, 4.97; found: C,72.41, H, 7.12, N, 4.95; FT-IR (KBr, cm−1): 1618 (m),1122 (m), 578 (w), 549 (m)。
配合物2: C34H40FeN2O2(564.53): elemental analysis calcd.: C, 72.33, H, 7.14, N, 4.96; found: C,72.29, H, 7.11, N, 4.92; FT-IR (KBr, cm−1): 1613 (m),1122 (m), 576 (w)。
配合物3: C34H40CuN2O2(564.53): elemental analysis calcd.: C, 71.36, H, 7.05, N, 4.90; found: C,71.31, H, 7.02, N, 4.88; FT-IR (KBr, cm−1): 1617 (s),1147 (m), 761 (m)。
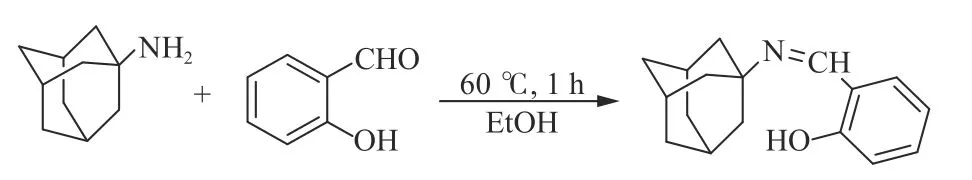
图2 水杨醛缩金刚烷胺席夫碱配体的合成路径Figure 2 Synthetic route of salicylaldehyde amantadine Schiff base ligand
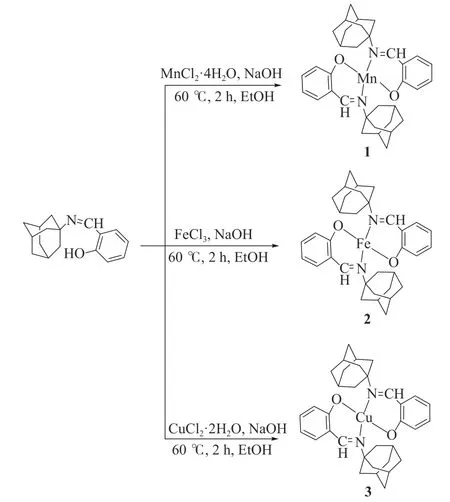
图3 配合物合成路径Figure 3 Synthesis path of complexes
1.4 HMF氧化反应及产物分析
称取1 mmol HMF置于25 mL三口烧瓶中,加入4 mL DMSO和3 mmol 70%的叔丁基过氧化氢,搅拌至溶解,加入一定量配比的金属盐和席夫碱配体,在一定温度下进行反应。反应结束后冷却至室温,随后向反应液中加入去离子水稀释定容至100 mL,取少量稀释后的溶液经滤膜过滤后进行定量分析。本研究采用Waters1525型高效液相色谱仪进行定量分析,所用液相色谱检测器为紫外检测器,测定波长 278 nm。色谱柱为 C18 反相色谱柱 (200 mm × 4.6 mm),柱温35 ℃,以乙腈和质量分数 0.1% 的乙酸水溶液(体积比 = 30∶70)为流动相,流量1.0 mL/min。通过标准曲线计算反应生成的FDCA、 DFF、HMFCA和FFCA 等氧化产物收率,计算公式如下:
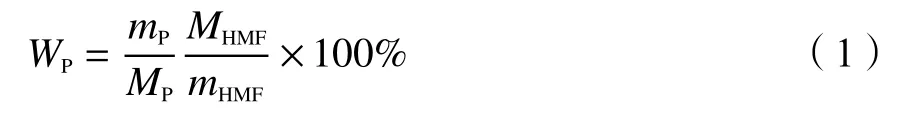
式中,Wp: 产物产率,%;mp、mHMF: 产物和原料HMF的质量,g;MP、MHMF: 产物和原料HMF的相对分子质量
2 结果与讨论
2.1 配合物的晶体结构解析
利用溶剂蒸发法,从体积比为1∶1的CH3OH和CH2Cl2溶液中制备出适合X射线分析的配合物单晶。以配合物3为例,采用ω扫描方式进行扫描,使用SAINT程序进行数据还原,配合物晶体衍射数据在SHELX-2014软件上通过直接法得到晶体衍射数据[21]。并且通过全矩阵最小二乘法对晶体数据精修。然后分别通过dimand和Mercury软件作图,得到热椭球结构图与晶体结构堆积图,最后得到配合物的完整晶体数据。具体的晶体结构和数据见图4和表1。
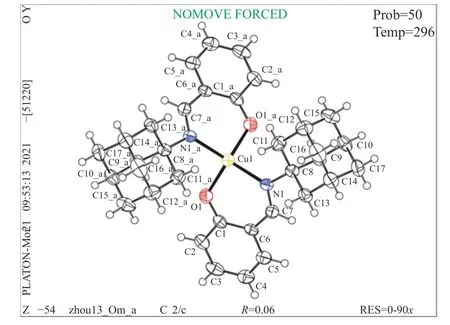
图4 配合物3晶体结构图Figure 4 Crystal structure of complex 3
根据以上晶体学数据表明,配合物3属于单晶斜系,空间点群为C2/c,每个晶胞存在着四个不对称单元。并且配合物均是由两个双齿配体通过两个N原子和两个O原子与中心金属离子形成的四配位的结构。并且每个配合物的金属与N原子形成的键长均大于Pauling共价键理论计算出的理论值,所有数据均与相应文献报道的结构相符[22],因此,可以推出所有配合物与N原子形成的键均为配位键,其CCDC号为2113434。
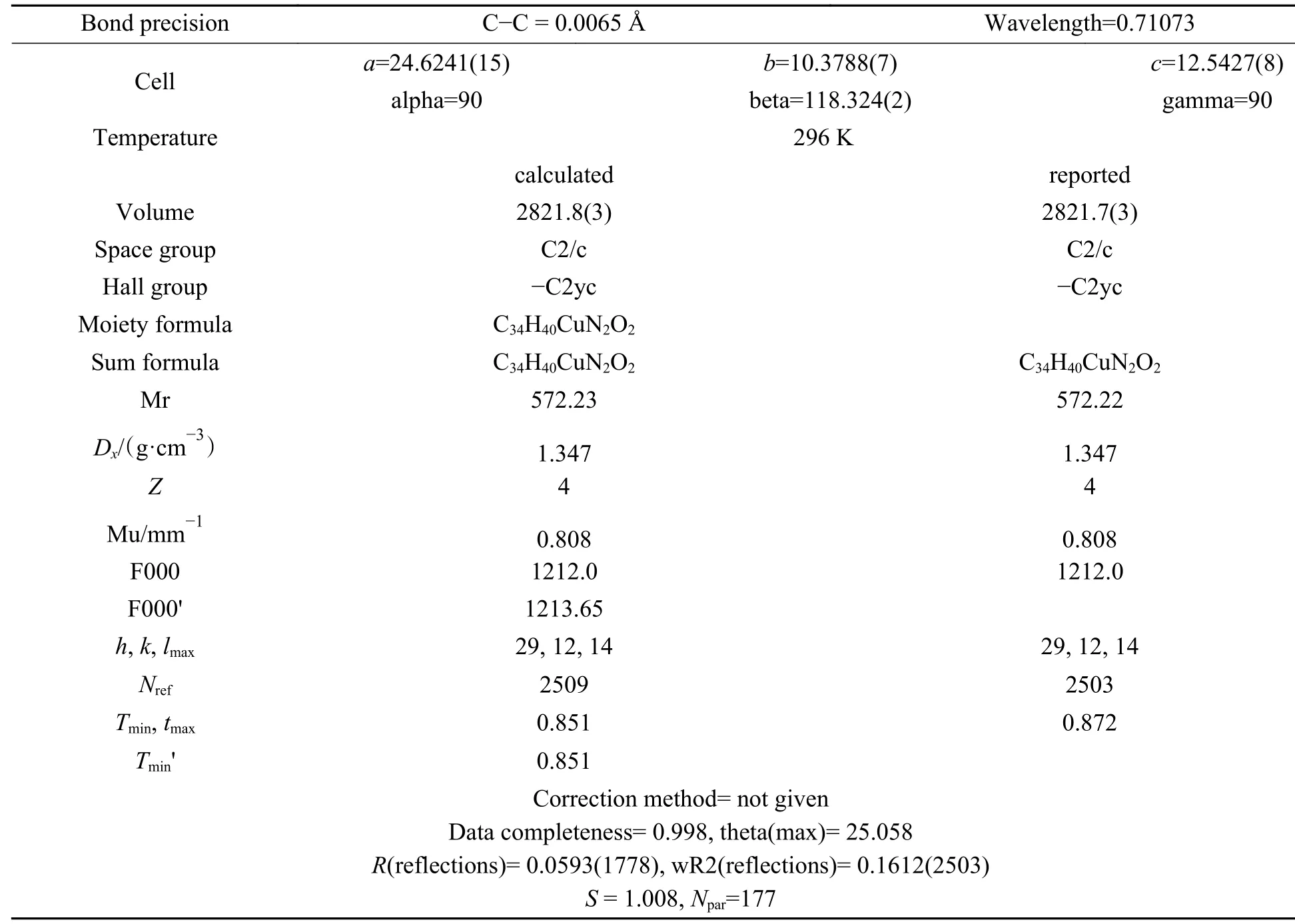
表1 配合物3的单晶数据Table 1 Single crystal data for complex 3
2.2 不同催化剂对HMF氧化反应的催化作用
在相同的反应条件下比较配体、无机盐、金属配合物及原位催化剂等不同种类的催化剂对HMF氧化反应的影响,结果列于表2。由表2可以看出,配体L对HMF氧化反应没有表现出催化活性。以不同无机盐为催化剂进行HMF氧化反应,结果表明,FeCl3和CuCl2也不能有效催化HMF氧化反应进行,同样,与配体相互反应生成的配合物及原位催化剂均不能使HMF转化率和FFCA产率显著提升。与FeCl3和CuCl2相比,MnCl2可以在一定程度上促进HMF氧化反应的进行,HMF转化率和FFCA产率提高至36.1%和15.2%,而随着配体的加入,HMF转化率和FFCA产率可继续增加76.3%和21.7%。其原因可能是配体与金属盐络合形成配位化合物,致使中心金属的电子密度改变,使HMF氧化反应更容易进行。此外,由表2中数据可以发现,当催化剂为金属配合物时,HMF转化率和FFCA产率增大趋势和金属和配体组成的原位催化剂无明显差异,两者催化性能基本相当。该结果表明,在该反应体系中,MnCl2·4H2O可与加入的有机配体进行配位,生成的配合物对HMF氧化反应进行原位催化。
综上所述,在众多Mn基催化剂中,MnCl2·4H2O和配体L5组成的原位催化剂对HMF氧化反应表现出较好的催化活性,同时,对氧化产物FFCA具有较高的选择性;而不同种类的Fe基催化剂虽然能同时催化HMF的羟基和醛基,但对HMF氧化反应整体催化活性不高,尤其是对氧化产物FFCA 选择性也较低;相对Mn基催化剂,Cu基催化剂氧化产物DFF表现出相对较高的选择性,而对FFCA的选择性相对较低。因此,综合考虑,催化HMF氧化制备FFCA最合适的原位催化剂是MnCl2·4H2O和配体L5组成的原位催化剂,在接下来的工作中,以MnCl2·4H2O和配体L5为原位催化剂进行HMF氧化反应,对反应温度、反应时间、氧化剂用量、催化剂用量及配比等反应条件进行优化。
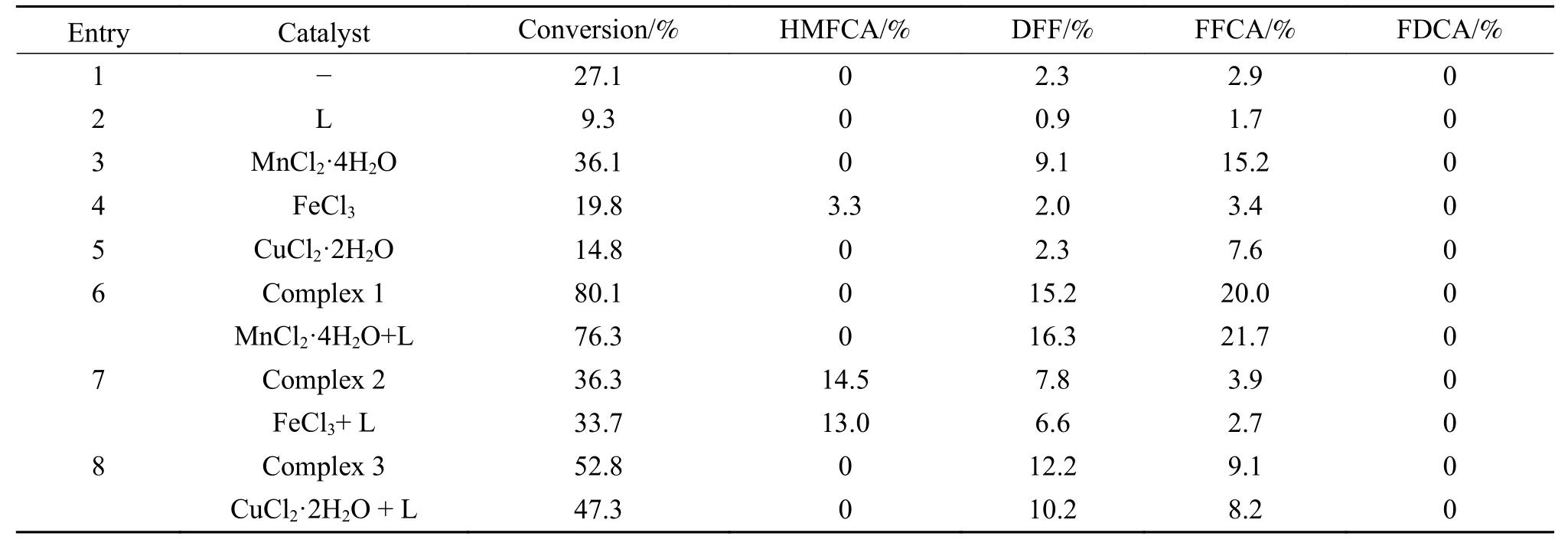
表2 不同种类催化剂对HMF氧化反应催化性能比较Table 2 Comparison of different types of catalysts for oxidation of HMF
2.3 HMF氧化反应条件优化
2.3.1 反应温度对HMF氧化反应的影响
由图5可知,反应温度对HMF氧化反应的影响较大。
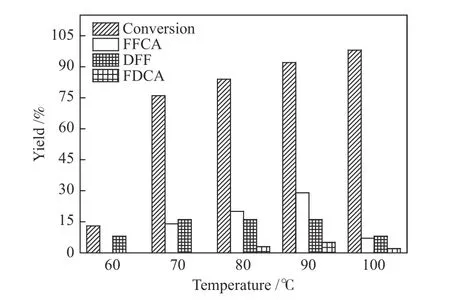
图5 反应温度对HMF氧化反应的影响Figure 5 Influence of temperature on HMF oxidation
当反应温度为60 ℃时,HMF转化率仅为13.3%,DFF产率为8.1%,并没有获得FFCA。当反应温度升高至90 ℃时,HMF的转化率增大至92.3%,FFCA产率为29.0%,DFF产率为16.3 %。继续升高温度至100 ℃ 时,HMF几乎完全转化,但FFCA、DFF以及FDCA的产率却分别降低到8.2%、7.1%、1.4%。由此可以推断,当反应在较高温度下进行时,HMF氧化反应速率增大,HMF转化率随着温度的升高而显著增加。但由于HMF和FFCA在较高温度条件下化学性质不稳定,副反应程度较大,因此,FFCA选择性降低,这与以前的文献报道的结果一致[23,24]。因此,选择90 ℃作为HMF氧化反应的最佳反应温度。
2.3.2 反应时间对HMF氧化反应的影响
由图6可以看出,HMF转化率和FFCA产率均随反应时间的延长而增加。当反应时间为12 h时,HMF转化率由75.2%增加至95.1%,继续延长反应时间,HMF转化率增加趋势不明显。FFCA产率随反应时间的延长而增大,当反应时间为18 h时,FFCA产率由20.3%增加至36.2%,进一步延长反应时间,FFCA产率开始下降,当反应时间为30 h时,FFCA的产率从36.2%降低至29.2%。这表明当反应时间超过18 h后,FFCA继续氧化、聚合或分解的副反应程度增加,导致FFCA收率开始下降。由图6还可以看出,中间氧化产物DFF收率虽然也随着反应时间的延长而增加,但整个反应过程中并未获得较高收率的DFF,这可能是由于DFF向FFCA转化的反应速率较快,HMF氧化生成的DFF可迅速转化为FFCA,因此,反应体系中并未检测到较高收率的DFF。反应过程中还得到了少量的FDCA,这是FFCA继续氧化的结果,但反应时间超过18 h后,FDCA收率也未显著增加,这是由于FFCA向FDCA的继续氧化反应速率较慢,未生成大量的FDCA;同时,由于FDCA化学性质不稳定,可继续发生开环、聚合等副反应,因此,反应体系中并未得到较高收率的FDCA。综合来看,最佳反应时间应选择为18 h。
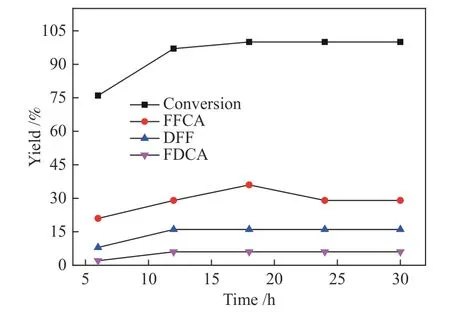
图6 反应时间对HMF氧化反应的影响Figure 6 Influence of reaction time on HMF oxidation
2.3.3 金属与配体的物质的量比对HMF氧化反应的影响
在上述最优化反应温度和反应时间条件下,对金属和配体物质的量比进行优化。由图7可以看出,金属和配体物质的量比对HMF转化率和FFCA产率影响明显。当金属和配体物质的量比为1∶1时,HMF的转化率为100%,产物FFCA的产率为43.3%。当金属和配体物质的量比变为1∶2时,FFCA的产率降低到36.2%。此后,随着金属和配体物质的量比增加,HMF的转化率以及FFCA产率均呈下降趋势。这可能是由于随着配体摩尔数的增加,金属在溶液中的分散度低,金属和配体难以按比例络合形成具有催化活性的配合物,金属活性中心并未按照一定的比例与金属配位。并且配体分子数量的增加导致了HMF分子难以接触到已经形成的金属配合物的活性中心,进而使催化活性和选择性均降低。此外,由图中数据可以看出,DFF在本催化体系没有受到配比的改变的影响。所以,金属和配体的最佳的配比是1∶1。
2.3.4 催化剂用量对HMF反应的影响
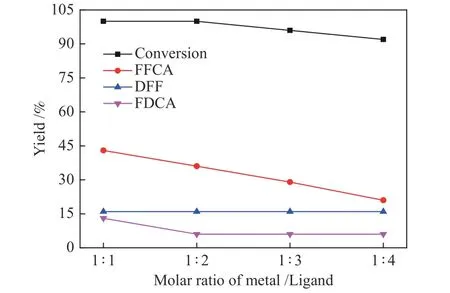
图7 金属与配体配比对HMF氧化反应的影响Figure 7 Influence of molar ratio of metal and ligand on the oxidation of HMF
考察催化剂用量对HMF氧化反应的影响,结果见表3。由结果可以知,HMF转化率、FFCA和FDCA的产率均随着催化剂用量的增加出现先增加然后降低的趋势,当催化剂的用量为3%时,DFF、FDCA和FFCA的产率分别达到最大值(14.3%、10.5%和48.6%),HMF的转化率达到100%。当催化剂用量继续增加时,FDCA和FFCA的产率分别降低到36.4%和6.1%。原因是由于催化剂用量较少时,可提供的活性中心数有限,催化效果不明显,叔丁基过氧化氢只能将部分HMF氧化,故而产物产率较低。而随着催化剂用量的增加,活性中心也不断增加,反应物分子与活性中心作用的机会与时间延长,促使氧化反应充分进行,因而呋喃类产物产率升高。继续增加催化剂用量时,产物呈现下降趋势。这是由于增加催化剂的用量造成了呋喃环开环等副反应的增加,HMF反应体系颜色逐渐变深。综上所述,当催化剂用量为3%时,主产物FFCA的产率最高,同时获得了产率相对较高的DFF以及FDCA。因此,HMF氧化反应适宜的催化剂用量为3%。
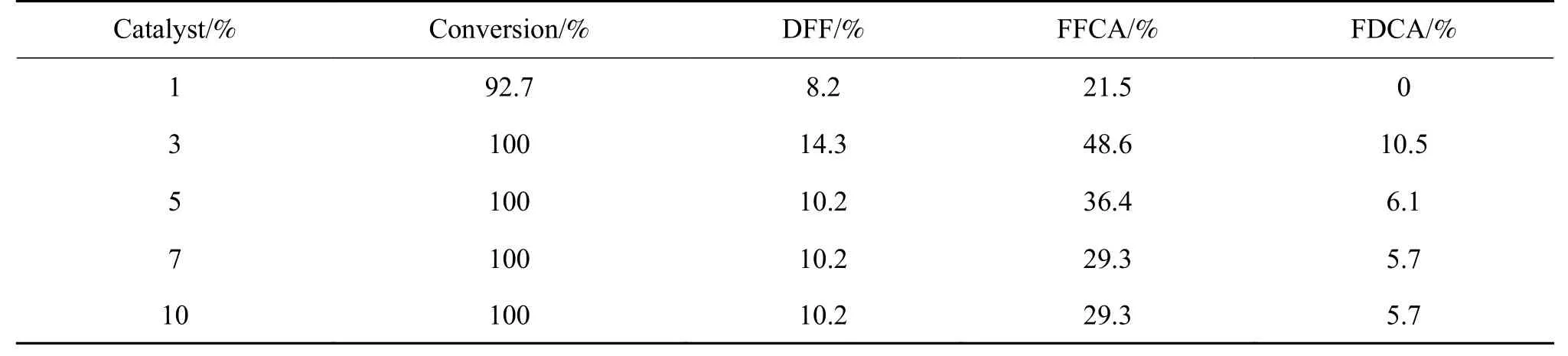
表3 催化剂用量对HMF氧化的影响Table 3 Influence of dosage of catalyst on HMF oxidation
2.3.5 氧化剂用量对HMF氧化反应的影响
图8为氧化剂用量对HMF氧化反应的影响。由图8可知,在金属和席夫碱原位催化HMF氧化反应中,产物的产率受氧化剂的影响较大。
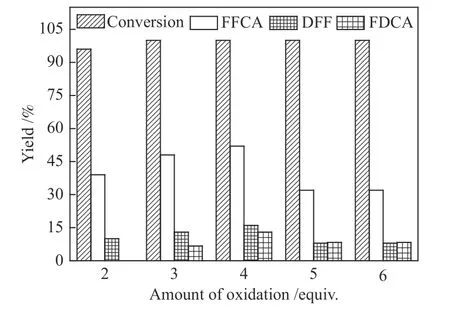
图8 氧化剂用量对HMF氧化反应的影响Figure 8 Influence of oxidant dosage on HMF oxidation
HMF氧化生成FFCA所需的氧化剂理论用量为2 equiv.,但由实验结果可以看出,当氧化剂的用量是2 equiv.时,产物FFCA的产率为仅为39.4%,而DFF的产率为10.2 %,并未检测到FDCA。当氧化剂增加到3 equiv.时,FDCA的产率仅为6.7%。而当氧化剂用量增加到4 equiv.时,呋喃类氧化产物的总产率达到最大值,其中主产物FFCA的产率为52.1%,FDCA和DFF的产率分别为13.2% 和16.3%。这是由于在90℃条件下氧化剂TBHP会部分分解,因此,2 equiv.的氧化剂并不能满足HMF向FFCA的高选择性转化。而当TBHP用量超过3 equiv.时,FFCA收率开始下降,当氧化剂的用量增加至5 equiv.时,产物FFCA产率降低到36.3%,而其他副产物产率基本保持不变。这说明过量的氧化剂用量使FFCA被过渡氧化发生开环、聚合等副反应,因此,反应体系中并未得到较高收率的FFCA。所以,TBHP与HMF的物质的量比为3∶1较合适。
2.3.6 不同溶剂对HMF氧化反应的影响
反应介质对反应的进行也有重要的影响,由表4中数据可知,溶剂对HMF氧化反应影响较大。在有机溶剂中HMF的转化率较高,在水中的转化率最低。尽管在甲醇中,HMF的转化率达到60.6%,但是并未获得FFCA。原因可能是HMF与甲醇发生了反应,生成了5-甲氧基甲基糠醛[25]。在所有测试的溶剂中,FFCA的产率在DMSO或者CH3CN中是较高的。FFCA在CH3OH和H2O中的产率最低,这是由于极性有机溶剂(例如DMSO和CH3CN)有利于稳定阳离子的正电荷。因此,综合来看,用MnCl2·4H2O和水杨醛缩金刚烷胺席夫碱配体催化HMF氧化制备FFCA时,在DMSO中可获得较高的FFCA收率。
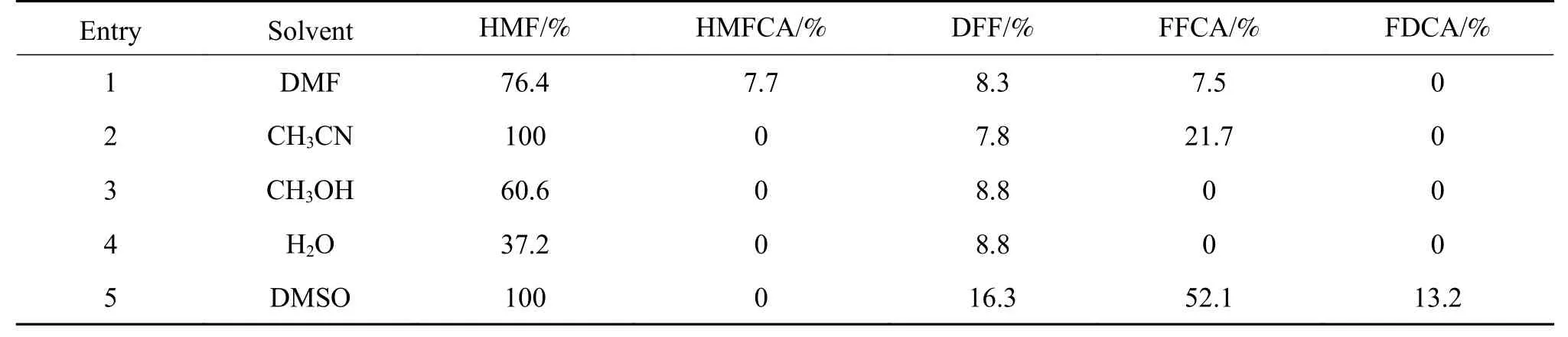
表4 不同溶剂对HMF氧化的影响Table 4 Influence of different solvents on HMF oxidation
2.3.7 不同氧化剂对HMF氧化反应的影响
除了以上所述的因素外,还研究了不同类型的氧化剂对HMF氧化反应的影响。在上述最优化条件下,分别以常压氧气、双氧水和TBHP为氧化剂进行HMF氧化反应,结果见表5。由表5数据可知,以常压氧气和双氧水为氧化剂时,HMF的转化率均高于50%,但并未获得较高的DFF、FFCA和FDCA收率,这可能是由于90 ℃反应18 h,使HMF发生了开环、聚合、水解等副反应,而并未获得较高产率的FFCA。由结果还可以看出,以氧气为氧化剂时,FDCA产率高于FFCA,表明在该反应体系中FDCA的选择性高于FFCA。因此,就本研究催化体系而言,TBHP是比其他氧化剂更有效的氧化剂。
综上所述,MnCl2·4H2O和水杨醛缩金刚烷胺席夫碱组成的原位催化剂,催化HMF制备FFCA的最优条件为:HMF 0.126 g(1 mmol),3%的催化剂用量,金属与配体物质的量比为1∶1,氧化剂TBHP用量为3 equiv.,在DMSO中于90 ℃条件下反应18 h,此时HMF可完全转化,呋喃类氧化产物的总产率达到81%,其中,FFCA的产率达到52.1%。
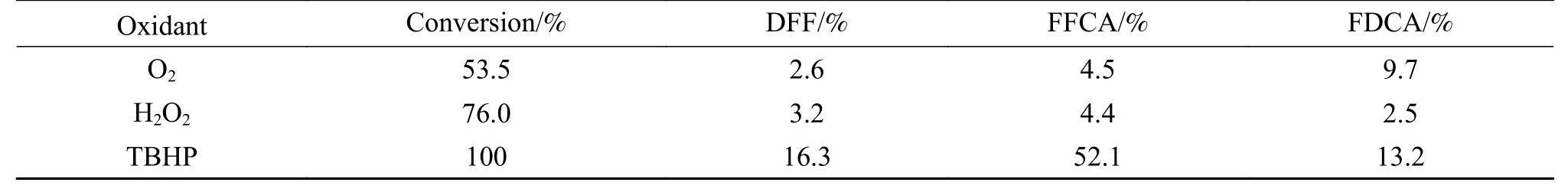
表5 不同氧化剂对HMF氧化反应的影响Table 5 Influence of different oxidant on HMF oxidation
2.4 反应过程分析
如前面所述,因为HMF分子中含有羟基和醛基,所以HMF氧化反应通常有两条反应路径。但通过对不同反应温度和反应时间的优化实验结果可知,Mn基催化剂催化的HMF氧化反应过程中并没有出现中间产物HMFCA,而当反应温度较低或反应时间较短时,可获得一定收率的中间产物DFF,该结果表明,Mn基原位配合物催化的HMF的氧化制备FFCA的反应路径应该是:HMF→DFF→FFCA→FDCA,而并没有经过HMF→HMFCA→FFCA→FDCA这条反应路径,如图9所示。
此外,分别以反应体系中出现的氧化产物为反应底物进行氧化反应,对HMF氧化反应过程进行分析。结果如表6所示。由表6中数据可知,在HMF的氧化反应中,FFCA收率最高为52.1%,同时获得了16.3%DFF和13.2%FDCA,而氧化产物中并未检测到HMFCA。当反应底物为DFF时,在最优的条件下,DFF的转化率达到了100%,FFCA的产率达到了67.2%,同时获得了17.9%的FDCA产率。而当底物是FFCA时,FFCA的转化率仅为17.7%,FDCA的产率为10%。该结果表明,在本催化体系中,HMF转化为DFF,进而继续向FFCA转化的反应速率较快,而FFCA氧化生成FDCA的反应速率较慢,这可能是MnCl2与水杨醛缩金刚烷胺席夫碱原位催化剂对FFCA具有较高选择性的主要原因。
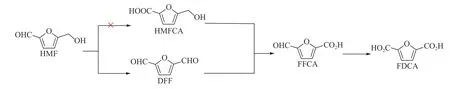
图9 金属配合物原位催化HMF氧化反应路径Figure 9 HMF oxidation reaction paths with in-situ catalyst of metal complexes

表6 不同底物氧化反应的比较Table 6 Comparison of different substrate oxidation reactions
通过HPLC分析结果可知,反应体系中除存在DFF、FFCA和FDCA等呋喃类氧化产物之外,还检测到少量的甲酸(5.6%)、乙酰丙酸(4.4%)及其他未知产物,这主要是由原料HMF发生开环副反应产生。除此以外,反应过程中发现随着反应时间的延长,反应液颜色逐渐变为深棕色,反应液稀释过滤发现有棕黑色沉淀生成,这是由于反应过程中HMF及FDCA发生聚合副反应产生胡敏素等聚合物。
2.5 与其他催化体系比较
相对于DFF和FDCA而言,FFCA化学性质十分活泼,所以合成较为困难,相应的报道的文献也较少,表7列出了近年来催化HMF氧化制备FFCA的相关报道。由表7可以看出,HMF氧化制备FFCA的反应均需在碱性条件下进行,新型杂多酸催化剂Na3H6FeMo6O24·5H2O和贵金属基催化剂AuNPs-sPSB可获得较高产率的FFCA。但这两种催化剂合成成本较高。光催化剂g-C3N4/NaNbO3对HMF氧化反应也表现出一定的促进作用,但转化率较低,同时光催化限制了其工业应用。而过渡金属氧化物MnzFeyOx催化的HMF氧化反应温度和压力较高,操作不易控制。而本研究中采用金属配位原位催化,在中性、温和条件下进行HMF氧化反应,尽管FFCA的选择性与产率与贵金属基和其他新型催化剂还存在一定差距,但由于催化剂合成和HMF氧化反应过程简单,也具有重要的研究意义。
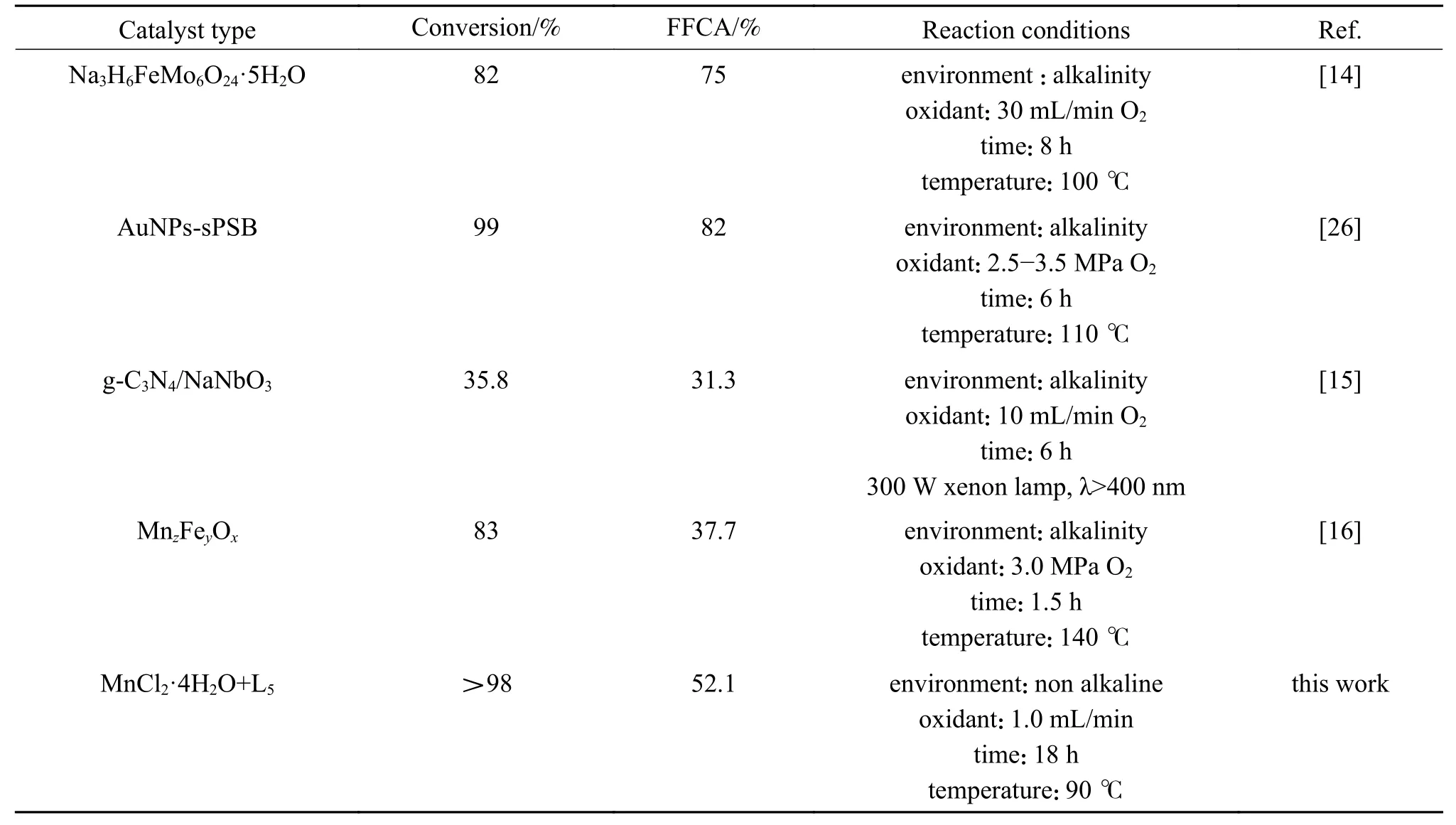
表7 用各种催化剂将HMF氧化为FFCATable 7 Oxidation of HMF to FFCA with various catalysts
3 结 论
本研究合成了一种席夫碱配体,并将所合成的配体和金属盐组成原位催化剂用于HMF选择性氧化反应制备FFCA。以叔丁基过氧化氢为氧化剂,以 MnCl2·4H2O和水杨醛缩金刚烷胺席夫碱组成原位催化剂进行FFCA的合成反应,在最优化条件下,HMF可完全转化,FFCA产率可达52.1%。对金属配合物催化的HMF氧化过程进行分析,结果表明,HMF氧化生成DFF并进而转化为FFCA的反应速率较快,而FFCA向FDCA转化的速率较慢,这是该催化体系对FFCA具有较好选择性的主要原因。
