尿胰蛋白酶抑制剂对热射病大鼠神经系统损伤保护作用机制研究
2022-05-02王丽南孙香蕾金红旭燕北部战区总医院急诊医学部辽宁沈阳110016
王丽南, 王 宏, 时 倩, 孙香蕾, 李 楠, 葛 凤, 金红旭, 高 燕北部战区总医院 急诊医学部,辽宁 沈阳 110016
热射病是由于暴露在热环境和/或剧烈运动所导致的机体产热与散热失衡,以核心温度升高(超过40℃)和中枢神经系统异常为主要特征,如意识障碍、谵妄、抽搐、昏迷等,同时伴有多器官功能损害且危及生命的临床综合征[1]。热射病患者的中枢神经系统症状往往发病较早、受损较重,即使给予积极降温等保护措施,仍有30%左右的患者遗留严重后遗症[2]。因此,对热射病患者神经系统损伤的保护性治疗不容忽视。热休克蛋白70(heatstroke protein 70,HSP70)主要在应激条件下表达,以维持机体内稳态并减少机体组织损伤[3]。有研究报道,HSP70在正常脑组织中几乎不存在,但在热应激、缺血及其他损伤刺激后,脑组织中HSP70的表达增加,并通过其分子伴侣、清除氧自由基、抑制细胞凋亡、抗炎等作用对神经系统起保护作用[4]。尿胰蛋白酶抑制剂(urinaty trypsin inhibitor,UTI)作为一种广谱蛋白酶抑制剂,可通过抑制促炎细胞因子产生起到抗炎作用。有研究报道,UTI可通过减少全身炎症反应,治疗重症胰腺炎、脓毒症、脓毒性休克及多器官功能障碍综合征[5-6]。在呼吸心跳骤停诱导的全脑缺血研究中,UTI可通过抑制白细胞介素6(interleukin 6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等炎症因子来减轻脑水肿和炎症反应,从而改善神经系统评分和保护神经系统功能[7]。有研究发现,UTI可能通过增加HSP70对烫伤大鼠脑组织起到保护作用[8]。本研究旨在初步探讨UTI对热射病大鼠脑组织中HSP70表达及炎症因子的影响,分析UTI在热射病治疗中的作用及其可能机制,寻找可能减少热射病神经系统损伤的有效药物。现报道如下。
1 材料与方法
1.1 实验动物及分组 选取雄性健康清洁级SD大鼠30只(由辽宁长生动物实验中心提供),体质量(225±25)g,大鼠分笼饲养,室温为(26℃±1℃),每日采用灯光照明,12 h昼夜节律变化。实验过程中动物饲养及取材均遵守实验动物管理和保护的有关规定。大鼠随机分为空白对照组(n=10)、热射病模型组(n=10)与药物治疗组(n=10)。
1.2 试剂与器材 UTI选择注射用乌司他丁(广东天普生化医药股份有限公司,批号:031608143),HSP70抗体(Proteinch 公司),鼠抗(美国 abcam 公司),GAPDH内参抗体(美国Santa Cruz 公司),HSP70酶联免疫吸附法检测试剂盒(北京博奥森生物有限公司),大鼠TNF-α酶联免疫吸附法检测试剂盒(南京建成生物有限公司),大鼠白细胞介素1β(interleukin 1β,IL-1β)酶联免疫吸附法检测试剂盒(欣博盛生物有限公司)。人工气候恒温箱(宁波东南器械有限公司),温度湿度测量仪(沈阳医疗器械有限公司),加湿器(奥克斯集团有限公司)。
1.3 研究方法
1.3.1 模型制备及干预措施 空白组大鼠置于常温下。热射病模型组、药物治疗组大鼠应用10%水合氯醛(3 ml/kg)腹腔注射麻醉,当角膜反射与疼痛反射消失且呼吸、心率平稳后视为麻醉成功;将麻醉后的大鼠放置于温度调至42℃、湿度调至(60%±5%)的人工气候箱中[9],每10 min监测1次肛温,待肛温≥42℃时,视为热射病模型建立成功[10]。空白组大鼠尾静脉注射10 ml/kg生理盐水干预;热射病大鼠建模成功后,热射病模型组大鼠经尾静脉注射10 ml/kg生理盐水干预,药物治疗组大鼠经尾静脉给予100 000 U/kg(100 000 U的UTI溶于10 ml生理盐水)的UTI进行干预。常温观察4 h后再次麻醉,予以腹主动脉采血,并解剖留取大鼠脑组织。
1.3.2 血清HSP70、IL-1β及TNF-α水平检测 各组实验大鼠留取5 ml血液标本,以3 000 r/min的速度于离心机离心10 min后取上清液置于-80℃冰箱中保存。采用酶联免疫吸附法检测血清HSP70、IL-1β、TNF-α含量,操作过程按照说明书标准执行,应用酶标仪读取相应的吸光度值,计算血清中各检测指标含量。
1.3.3 检测大鼠脑组织HSP70表达 各组实验大鼠取适量脑组织,提取组织蛋白,应用BCA蛋白浓度测定法进行蛋白质定量。采用聚丙烯酰胺凝胶(SDS-PAGE)电泳法分离目的蛋白。待测样品经上样、电泳、转膜及封闭后予以HSP70一抗(1∶4 000)进行室温下孵育30 min,4℃过夜。于次日予以鼠二抗(1∶10 000)进行孵育2 h。采用增强型化学发光法(enhanced chemiluminescence,ECL),应用Tanon仪器进行曝光,根据显影效果决定是否重复曝光及曝光显影的时间。采用Image-proplus软件分析蛋白条带平均光密度值。以目的蛋白为内参蛋白,平均光密度比值代表目的蛋白的相对表达量。
1.3.4 病理切片制备与观察 每组取2只实验大鼠留作病理标本,将大鼠麻醉后固定于解剖板上,剪开大鼠左侧胸骨旁线,显露心脏,剪开右心耳,夹闭胸主动脉,从左心室插入针头,首先注入生理盐水约200 ml,至右心耳流出清亮液体为止;再更换4%多聚甲醛约200 ml灌注固定,至大鼠肌肉僵硬为止。留取全脑,置于4%多聚甲醛浸泡固定留作病理切片。取甲醛固定好的脑组织,切取4 mm×3 mm×3 mm的大鼠脑组织块置于模具内。进行脱水、透明、侵蜡、包埋,使用组织切片机切取5 μm切片,置于载玻片上,每只大鼠制作2张病理切片。进行苏木素-伊红(hematoxylin-eosin,HE)染色,光镜下观察大鼠脑组织神经元细胞数量。每张切片观察5个视野(400倍高倍视野下随机计数),计算每张病理切片神经元细胞存活数量总数。
2 结果
2.1 热射病大鼠一般状态及肛温变化曲线 热射病模型组、药物治疗组大鼠置于设置好的人工气候箱内约10 min后,大鼠表现为精神亢奋,四处攀爬;约20 min后表现为口唇及四肢末端紫绀,心率加快,呼吸深大,躁动增加;约30 min后,除上述表现外,出现惊厥,撕咬现象,活动逐渐减少,待肛温接近标准后,大鼠表现为意识淡漠,精神萎靡。热应激条件下,大鼠肛温呈持续直线上升(图1)。待核心温度达到42℃视为热射病模型建立成功。
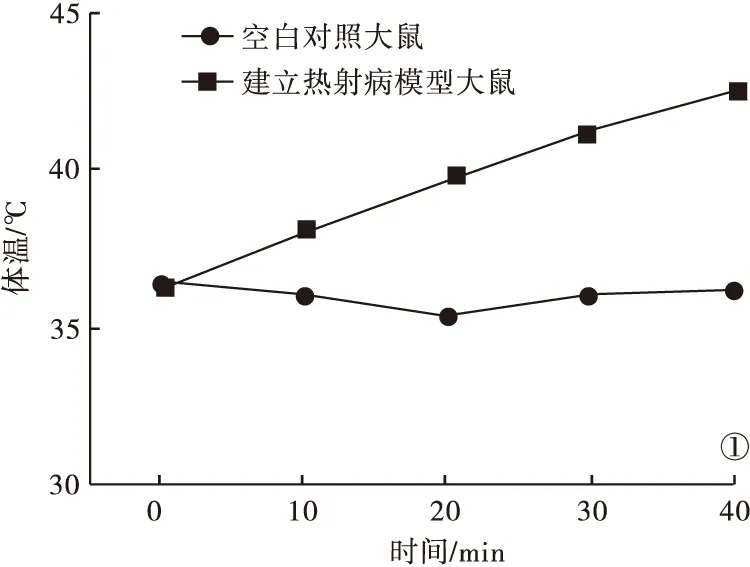
图1 大鼠肛温变化曲线
2.2 血清HSP70、TNF-α、IL-1β表达水平比较 热射病模型组血清HSP70、TNF-α、IL-1β水平明显高于空白对照组;药物治疗组血清TNF-α、IL-1β水平低于热射病模型组,血清HSP70水平高于热射病模型组,差异均有统计学意义(P<0.05)。见表1。

表1 各组大鼠血清HSP70、TNF-α、IL-1β表达水平比较
2.3 脑组织HSP70蛋白表达及神经元细胞损伤情况 热射病模型组大鼠脑组织HSP70蛋白表达量高于空白对照组,神经元细胞数少于空白对照组;药物治疗组大鼠脑组织HSP70蛋白表达量、神经元细胞数高于热射病模型组,差异均有统计学意义(P<0.05)。见表2,图2~3。
3 讨论
热射病根据发病因素及易感人群,分为经典型热射病和劳力型热射病。经典型热射病主要发生于老年人、儿童、免疫力低下或有基础疾病的人群,而劳力型热射病主要发生于青壮年,如运动员、军事训练人员、户外工作者等[1,11]。流行病学研究报道,2006—2010年美国至少有3 132人死于中暑;2013年7月,英国在气温持续超过32℃的几天内约有760人死亡;最为严重的一次为2003年巴黎热浪,造成1.5万人死亡[12-13]。我国个别地区报告的热射病发病情况显示,2017年天津市对7月份中暑患者进行统计,死亡人数为73例[14]。2018年,由于副热带高压异常导致罕见的高温天气,东北地区出现极端天气,造成热射病的集中发生[15]。

表2 脑组织HSP-70蛋白表达及神经元细胞损伤情况

图2 热射病大鼠脑组织HSP70蛋白表达

图3 光镜下大鼠脑组织神经元细胞图(HE染色×400;a.空白对照组;b.热射病模型组;c.药物治疗组)
对于热射病发病机制的研究,主要包括体温调节中枢受损、直接热损伤、全身炎症反应、多器官功能障碍等[16-17]。以往将热射病定义为类脓毒症,主要是由于直接热损伤导致内脏血流减少,肠道屏障受损,血管内皮细胞、上皮细胞受损,肠道功能紊乱,黏膜通透性增加,菌群易位,最终引发全身炎症反应[18]。热射病中枢神经系统损伤的机制可能与高热增加脑组织代谢率,脑血管充血脑组织水肿、颅内压增高,而机体平均动脉压减低,脑灌注减少,导致血脑屏障受损,通透性增加,炎症因子IL-1β、TNF-α、IL-6等大量释放,最终导致神经系统不可逆损伤[19-20]。本研究在高温、高湿环境下建立热射病大鼠模型,观察大鼠行为及意识状态的变化,监测肛温,并通过病理切片观察到热射病模型组大鼠脑神经细胞损伤较空白对照组更严重。
热休克蛋白又称为热应激蛋白,是各种应激诱导下表达的高度保守蛋白,热休克蛋白具有很强的细胞保护作用。在急性、慢性应激过程中,由于蛋白质错误折叠,蛋白质聚集或调节复合物受损,导致信号通路激活异常,而热休克蛋白通过其分子伴侣作用,使蛋白质表达恢复稳态,达到细胞平衡状态[21]。HSP70在正常大脑组织中的表达水平较低,但对各种应激下神经系统起到重要的保护作用[22]。研究发现,在大脑缺血、损伤模型中,免疫细胞产生多种细胞毒性物质,而HSP70可减少一氧化氮的产生及诱导一氧化氮合酶的表达,抑制核转录因子κB(nuclear transcription factor-κB,NF-κB)的激活,使促炎细胞因子TNF-α和活性氧分泌减少,同时,抑制巨噬细胞分泌的炎症因子[23-24]。HSP70在脑缺血、神经系统退行性疾病、癫痫和创伤等神经系统疾病中,具有较好的神经保护作用[25]。有研究报道,HSP70(+)转基因小鼠的热耐受性增加,减少热应激引起颅内高压,维持适当的平均动脉压与脑灌注量,防止高热造成的神经元损伤[26]。在热应激前,诱导HSP70超表达可减少炎症因子(如TNF-α、IL-1β、白细胞介素4等)释放,而在巨噬细胞中超表达的HSP70可阻止脂多糖(lipopolysaccharide,LPS)诱导产生的相关炎症因子释放[27]。由此可见,HSP70可通过其抗炎作用对神经系统起到保护作用。
UTI是一种从人尿液中分离纯化的Kuntza型蛋白酶抑制剂,主要抑制胰蛋白酶、糜蛋白酶、弹性蛋白酶等蛋白酶的活性,还能稳定溶酶体膜,抑制溶酶体酶释放。此外,UTI可减少细胞因子诱导的中性粒细胞趋化剂的产生,减少中性粒细胞蓄积,从而减轻中性粒细胞诱导的内皮损伤,阻断炎症和凋亡通路的激活[28-29]。研究显示,UTI在大脑缺血-再灌注损伤中,通过其抗炎、抗氧化应激作用,减少NF-kB的激活,抑制炎症因子表达,可改善脑血管的神经系统评分,缩小脑梗死面积,降低脑水肿程度,减少脑组织水通道蛋白4(aquaporin 4,AQP4)表达[7,30-31]。在大鼠蛛网膜下腔出血模型中发现,UTI可通过阻断c-Jun 氨基末端蛋白激酶(c-Jun N-terminal protein Kainse,JNK)、NF-κB、P53的活性,降低脑水肿和微血管通透性,从而达到抗炎、抗凋亡的作用[32]。多项研究显示,UTI可通过调节HSP70对心肌、肺、肾等重要器官起保护作用[33-34]。本研究结果显示,UTI可增加热射病大鼠HSP70的表达,同时,降低IL-1β、TNF-α表达,减少神经细胞凋亡,对热射病大鼠脑组织起保护作用。
综上所述,热射病是热性相关疾病中的致命性急症,寻找创新治疗方案将给热射病的转归和预后带来不一样的结局。UTI可通过诱导HSP70超表达,加强抑制炎症因子的作用,进而对热射病神经系统起到保护作用,但其具体的机制有待于进一步的研究。
