利用制药污泥固态发酵产哈茨木霉工艺研究
2022-04-29张昊楠高贵珍
张昊楠,高贵珍,刘 健,孟 想
宿州学院 1.环境与测绘工程学院;2.生物与食品工程学院,安徽宿州,234000;3.新宇药业股份有限公司,安徽宿州,234000
随着制药行业的发展,制药污泥的处理问题逐渐成为研究的热点。制药污泥处理技术以臭氧化污泥减量、污泥好氧消化与污泥制活性炭为主要研究方向。某制药企业以生产盐酸林可霉素原料药为主,每年产生约2 000吨的制药污泥,污泥一般呈现棕黑色且具有淡淡泥土气味。污泥中含有丰富的蛋白质、有机物及矿质元素,如果无处理排放,不仅会污染环境,还会造成资源浪费,因此,制药污泥的循环利用具有重要意义。
木霉菌(Trichoderma spp.)是重要的生防真菌,可以通过重寄生在植物根部,减少植物病害并提高产量[1-2]。国内对于木霉菌的发酵大多采用固体发酵方法,所生产的菌剂可达到足够数量的孢子含量,且活性强、易保藏和运输、所需发酵设备简单,成本低廉[3-4],固体发酵原料主要有麦麸、米糠、甘蔗渣和秸秆等[5-7]。据报道国内已有以农业或工业废弃物为主要固体培养基质发酵生产木霉生防菌剂。而且我国是一个农业生产大国,玉米、水稻和小麦作为主要的粮食作物,每年大约产8×108t作物秸秆[8]。而玉米秸秆相当于玉米生产的副产品,由于没有被合理的利用[9],大部分粮食秸秆都直接在田间堆弃或运输到指定的秸秆电厂焚烧,而焚烧秸秆会引起间接环境污染与增加二氧化碳排放量,对生态平衡产生危害[10-11]。
本文研究采用制药污泥为主要原材料,秸秆作为辅料,进行固体发酵产哈茨木霉,用单因素试验考察秸秆加入量、培养温度、培养时间与培养基初始含水量对哈茨木霉T-22菌株在污泥培养基上生长及产孢量的影响。结合响应面分析法对哈茨木霉固体发酵条件进行优化研究,旨在解决污泥的存放和处理问题,而且廉价的秸秆也可以当作发酵辅料,大大降低生产成本,实现废物的利用再生产,符合国家可持续发展战略要求。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种来源
哈茨木霉T-22菌株,实验所用菌种是由新宇药业股份有限公司环保研究所提供。
1.1.2 试剂及物料
葡萄糖购于国药集团化学试剂有限公司;琼脂购于北京奥博星生物技术有限责任公司;制药污泥由新宇药业股份有限公司好氧池污泥压滤制备;秸秆为小麦秸秆粉粹60目过筛;土豆为市场采购。
1.1.3 培养基配制
PDA固体培养基: 土豆200 g,琼脂20 g,葡萄糖20 g,蒸馏水定容至1 L,pH自然。
含链霉素的PDA培养基:土豆200 g,琼脂20 g,葡萄糖20 g,蒸馏水定容至1 L。在倒平板前,按链霉素:PDA培养基=1∶100的比例加入无菌处理的0.01 g/mL的链霉素,混匀。
污泥培养基:污泥4 g,秸秆2 g,搅拌均匀,混匀置于培养皿中。
1.1.4 孢子液制备及孢子量测定
将木霉菌接种于PDA平板上30 ℃恒温静置培养7天,用无菌的0.05%吐温-80溶液将从平板上洗下来,制备成木霉菌孢子液,以用于后续的固态发酵。发酵结束后,充分拌匀,取5 g固体发酵物于50 mL无菌水中,制成孢子液,分别梯度稀释后,各取200 μL稀释液于含链霉素的PDA培养基上涂布均匀,27 ℃恒温培养3 d,记录平板上的菌落数。
1.1.5 实验仪器
FA2004N电子天平(梅特勒-托利多国际股份有限公司)、DHG-9101-OSA型电热恒温鼓风干燥箱(上海三发科学仪器有限公司)、SHP-250型生化培养箱(上海三发科学仪器有限公司)、GI100T型高压蒸汽灭菌锅(美国致微)、SW-CJ-ID型超净工作台(上海三发科学仪器有限公司)、BM2000型三目生物显微镜(南京江南永新光学有限公司)。
1.2 实验方法
1.2.1 菌株T-22在污泥培养基上的生物学特性
菌株形态研究:将配制好的污泥培养基装入培养皿中,用封口膜封好置于灭菌锅内,在121 ℃下灭菌30 min,冷却后接入200 μL孢子液,27 ℃恒温培养7 d,观察菌株T-22的菌落形态特征。
菌丝与孢子形态研究:取发酵物少许于载玻片上在显微镜下观察哈茨木霉;另取1 g发酵物于10 mL无菌水中制成孢子液,于显微镜下观察孢子形态;利用薄片法(取灭过菌的盖玻片插在接种过哈茨木霉菌的培养基的中心,于27 ℃恒温培养箱培养1 d,待观察到有菌丝生长到薄片上时,去下薄片)制备菌丝薄片,于显微镜下观察哈茨木霉的菌丝形态特征。
1.2.2 单因素优化设计
以产孢量为指标,采用单因子法筛选菌株固体发酵培养基的初始含水量、培养温度、秸秆加入量等指标,确定最佳培养条件。
(1)初始含水量的影响:分别配置含水量为60%、70%、80%的污泥培养基。取配制好的不同初始含水量的污泥培养基装入250 mL锥形瓶中,每瓶100 mL,每个处理重复3次编号为A、B、C。用棉花封口,在121 ℃下灭菌30 min,冷却后接入200 μL孢子液,设定温度恒温培养7 d后,取样测定孢子量。
(2)培养温度的影响:培养温度设置为25 ℃ 、28 ℃ 、31 ℃三个梯度,每个温度重复3次编号分别为A、B、C。用棉花封口,在121 ℃下灭菌30 min,冷却后接入200 μL孢子液,设定温度恒温培养7 d后,取样测定孢子量。
(3)秸秆加入量的影响:污泥与秸秆加入量配比设置4∶1、2∶1、4∶3,每个比例重复3次,编号分别为A、B、C。用棉花封口,在121 ℃下灭菌30 min,冷却后接入200 μL孢子液,设定温度恒温培养7 d后,取样测定孢子量。
1.2.3 响应面优化设计
三因素的确立:参考曾庆才等[12]响应面优化设计。根据单因素实验和Box-Benhnken设计原理,采用软件Design-expert 8.0.6.1进行三因素响应面分析实验,以菌体产孢量为响应量,确定两两单因素对哈茨木霉菌体生长影响。以X作为菌体产孢量,初始含水量(X1)、秸秆加入量(X2)和温度(X3)为三因素,因素三水平分别为:-1、 0和1。试验设计具体见表1。

表1 发酵条件Box-Behnken因素水平表
采用Design-expert 8.0.6.1软件进行响应面优化分析,根据Box-Benhnken中心组合原理,设计实验方法对培养条件进行优化。根据响应面预测的最佳值进行实验,测定哈茨木霉菌株T-22的菌体产孢量以验证响应面预测值的准确性。
2 结果与讨论
2.1 菌株T-22在污泥培养基上的生物学特性
菌株T-22在污泥培养基中长势良好,污泥为其提供了丰富的养料,在培养7 d后,有大量菌丝变绿。显微镜下菌株T-22及其孢子和菌丝的状态良好,有明显可见的分生孢子梗,分生孢子梗上有瓶状结构,瓶状结构顶端有球形分生孢子菌丝呈透明状,上面附有少量孢子(图1)。

图1 哈茨木霉形态特征
2.2 单因素影响实验
2.2.1 初始含水量的影响
当污泥培养基的初始含水量分别为60%、70%、80%时,28 ℃恒温培养,观察菌株T-22的生长状况及计算发酵菌体生长量。当初始含水量为60%,培养5 d时,培养基表面可见少量白色菌丝;培养10 d时,培养基表面菌丝仍呈白色,但白色菌丝的量有一定增加。当初始含水量为70%,培养5 d时,培养基表面可见菌丝变绿,仅少量菌丝为白色;培养10 d时,培养基表面可见菌丝变绿。当初始含水量为80%,培养5 d时,培养基表面有少量白色菌丝,部分菌丝变绿;培养10 d时,培养基表面可见大量白色菌丝,菌丝变绿。由菌丝和孢子生长状态来看,当污泥培养基初始含水量为70%时,菌株T-22生长得最好。由表2与图1可见,当培养基初始含水量为70%时,此刻菌株T-22菌体生长量最大,能达到3.67×109cfu/g,而初始含水量不足70%或者超过70%时,T-22菌株的菌体生长量都会减少。

表2 不同含水量下三组T-22菌株的菌体生长量
2.2.2 培养温度的影响
当污泥培养基的初始含水量为70%时,分别在25 ℃、28 ℃、31 ℃恒温培养,观察菌株T-22的生长状况及计算发酵菌体生长量。当培养温度为25 ℃,培养5 d时,培养基表面可见少量白色菌丝;培养10 d时,培养基表面仍有少量白色菌丝,但有部分菌丝变绿。当培养温度为28 ℃,培养5 d时,培养基表面可见菌丝变绿,仅少量菌丝为白色;培养10 d时,培养基表面可见大量菌丝变绿。当培养温度为31 ℃,培养5 d时,培养基表面仅有少量白色菌丝,培养10 d时,培养基表面仍是少量白色菌丝。由菌丝和孢子生长状态来看,当培养温度为28 ℃,菌株T-22生长得最好。由表3可见,当温度为28 ℃时,此刻菌株T-22菌体生长量最大,能达到3.7×109cfu/g。而当温度不足28 ℃或者大于28 ℃时,T-22菌株的菌体生长量都会减少。而温度越高菌株T-22的生长状况越差,菌体生长量越小。
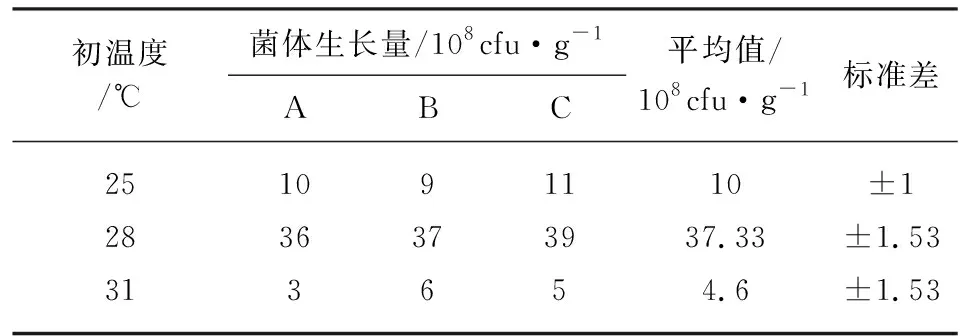
表3 不同温度下三组T-22菌株的菌体生长量
2.2.3 秸秆加入量的影响
当污泥培养基的初始含水量为70%,加入配制好的10 g、20 g、30 g的秸秆,28 ℃恒温培养,观察菌株T-22的生长状况及计算发酵菌体生长量。当秸秆加入量为10 g,培养5 d时,培养基表面可见少量白色菌丝;培养10 d时,培养基表面仍有少量白色菌丝,但有部分菌丝变绿。当秸秆加入量为20 g,培养5 d时,培养基表面可见菌丝变绿;培养10 d时,培养基表面可见大量菌丝变绿。当秸秆加入量为30 g,培养5 d时,培养基表面仅有少量白色菌丝,但部分菌丝变绿;培养10 d时,培养基表面菌丝变绿。由菌丝和孢子生长状态来看,当秸秆加入量为20 g时,菌株T-22生长得最好。由表4可见,菌株生长量随秸秆加入量的增加而增加直到秸秆加入量为20 g时,T-22菌株的菌体生长量达到最大为2.5×109cfu/g。当菌体生长量达到最大值后,随着秸秆加入量的增加,T-22菌株的菌体生长量减少。

表4 秸秆加入量不同三组T-22菌株的菌体生长量
2.3 响应面优化
2.3.1 响应面法优化试验
根据单因素结果,确定Box-Behnken模型较优化水平为:含水量为60%~80%,秸秆加入量为10~30 g,培养温度为25~31 ℃,培养7 d,试验设计和菌体生长量见表5。
根据表5数据,通过软件Design-expert 8.0.6.1处理可得,T-22菌株菌体生长量与单因素变量之间的关系模型:
X=2.03×109-1.58×108X1+3.84×108X2

回归方程的方差分析见表6。根据BBD统计学要求,从不同模型方差分析中的均方及检验结果综合来看,整体模型为极显著P<0.01,失拟性分析得P>0.1,失拟性不显著,因此模型选择正确且稳定,表明方程对实验拟合情况较好,实验误差小。影响因子对菌体生长量影响的贡献排序为:秸秆加入量>温度>初始含水量。

表5 Box-Behnken试验设计与结果

表6 回归方差分析
2.3.2 二次响应面回归模型的建立及方差分析
基于Box-behnken设计的响应面模拟和方差分析得到二次响应曲面模型,结果如图2所示。在当前试验范围内,当秸秆加入量和温度不变,随着初始含水量的升高,菌体生长量变化不明显;当秸秆加入量和初始含水量不变,随着温度的升高,菌体生长量先增加后减少;当温度和初始含水量不变,随着秸秆加入量的增加,菌体生长量先减少后增加。根据菌体生长量的变化速率显示,温度和秸秆加入量对菌体生长量的影响大于初始含水量的影响,并且秸秆加入量对菌体生长量的影响大于温度的影响,与方差分析结果一致。

图2 多因子对菌株T-22菌体生长量影响响应曲面
2.3.3 最优组合的确定及验证试验
为了获得菌株T-22菌体生长量的最佳发酵培养条件,对二项回归方程求偏导可得三元一次方程组:
解方程组可得:X1=58.22,X2=15.66,X3=29.92,即初始含水量为58.22%,秸秆加入量15.66 g,温度为29.92 ℃时菌株T-22菌体生长量最大,预测值达到3.27×109cfu/g。为了验证响应面发优化的最佳培养基的可靠性,进行验证实验,在此条件下,进行三次重复试验,测得菌体生长量的平均值为3.17×109cfu/g,与预测值有较好的拟合性,符合要求。
3 结 论
本研究利用制药污泥作为哈茨木霉固体发酵培养基,并进一步探究哈茨木霉T-22菌株污泥培养基固体发酵的最适条件。单因素实验结果表示,当培养基初始含水量为70%,菌株T-22污泥培养基固体发酵效果最好,菌体生长量达3.67×109cfu/g;当培养温度为28 ℃,菌株T-22污泥培养基固体发酵效果最好,菌体生长量达3.7×109cfu/g;当秸秆加入量为20 g,菌株T-22污泥培养基固体发酵效果最好,菌体生长量达2.5×109cfu/g。基于Box-behnken设计的响应面模拟和方差分析得到了可达极显著水平的二次响应曲面模型,影响因子对菌体生长量影响的贡献排序为:秸秆加入量>温度>初始含水量。哈茨木霉T-22菌株固体发酵在最适条件培养基的初始含水量58.22%,培养温度29.92 ℃,秸秆加入量15.66 g,菌体生长量可达3.27×109cfu/g。该研究结果表明哈茨木霉菌的固态发酵参数初始含水量及最适培养温度,与王永东等[13]、孙斐等[14]、刘时论等[15]等人的研究结果相近,且该研究利用制药污泥固态发酵产哈茨木霉,所产生的菌体量也等同于其他原料生产,原材料成本低,制药污泥得到有效利用,具有明显的经济及环境效益。因此,污泥可以作为哈茨木霉生长的培养基,将药业废弃污泥变废为宝、减少对环境的污染,符合国家可持续发展战略要求。
