前房注射角膜内皮细胞治疗兔大泡性角膜病变的实验研究
2022-04-29方逸凡杨昆昆张世锋侯月阳王丽强黄一飞
方逸凡,杨昆昆,李 钊,张世锋,侯月阳,吴 畏,王丽强,黄一飞
解放军总医院第一医学中心 眼科,北京 100853
角膜内皮细胞是位于角膜后弹力层的六边形单层细胞,通过泵和屏障功能维持角膜正常的水合作用,是维持角膜透明度和发挥视觉功能必不可少的组织结构[1]。人角膜内皮细胞不可再生,且会随着年龄增长或各种疾病的发生而丢失,当失去代偿能力不能维持基质水合作用时,会导致角膜水肿甚至视力下降,临床上称为大泡性角膜病变[2]。角膜移植是治疗大泡性角膜病变的唯一方式,但移植手术对技术要求较高,加之供体来源有限,导致其难以大量开展[3-4]。近年有研究采用前房注射培养原代角膜内皮细胞(corneal endothelial cell,CEC)治疗大泡性角膜病变,在5 年的随访中(10例/11例)取得良好临床效果,简化手术步骤同时充分利用供体角膜,为治疗此疾病提供了里程碑式的技术手段[5-8]。以往机械刮除法将角膜内皮和后弹力层一起去除,造成角膜内皮细胞前房注射治疗效果差异大,难以评价种子细胞的疗效[9]。本研究改良动物模型的制备方法,仅去除内皮组织而不损伤后弹力层,并通过前房注射细胞的方式进行治疗,以期为前房注射疗法的临床转化提供临床前研究数据和均一稳定的动物模型。
材料与方法
1 实验动物 选用雄性新西兰白兔21只,体质量2.5~3.0 kg,由解放军总医院实验动物中心提供[合格证号:SCXK(京)2020-0002],饲养于温度23℃,湿度40%,12 h光照/黑暗交替环境中,活体动物的实验操作均在8:00 - 17:00进行。实验过程符合美国视觉与眼科学研究协会(ARVO)制定的规范,实验方案经解放军总医院动物实验伦理委员会审查批准(2021-X17-27)。
2 主要试剂和仪器 泪道引流管(山东福瑞达医疗器械有限公司);1 mL和20 mL注射器(山东威高);盐酸赛拉嗪注射液(吉林省华牧动物保健品有限公司);盐酸咪达唑仑注射液(恩华);医用透明质酸钠凝胶(博士伦 爱维);肝素钠注射液(山东省惠诺药业有限公司);胎牛血清(Gibco);高糖DMEM培养基(Corning);青链霉素(Gibco);胶原酶Ⅰ(Sigma);ZO-1抗体(invitrogen#33-9100);硫酸庆大霉素注射液(辰欣药业有限公司);盐酸奥布卡因滴眼液(日本参天药业);妥布霉素地塞米松滴眼液(NOVARTIS);0.4%锥虫蓝染液(Gibco);茜素红(sigma);15°角膜穿刺刀(TRIMMER);手术显微镜(Leica);前节OCT(Carl Zeiss Visante OCT,Germany);倒置相差显微镜(OLYMPUS Ⅸ53);光学显微镜(OLYMPUS BX53)。自行制备内皮刮除器械:在现有泪道冲洗器上基础上,将泪道探针尾部硅胶管移动至顶端并超出2 mm作为内皮刮除的工作部;去除多余硅胶管,不锈钢探针在距顶端2.5 cm处反折135°,尾部包绕在注射器针筒上,各连接部位依次固定(图1)。
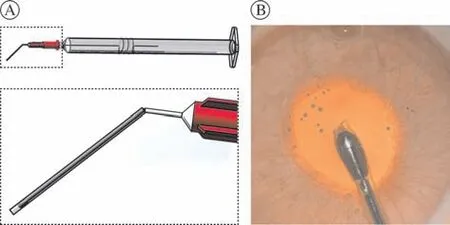
图1 内皮刮除器械设计和制备 A:示意图;B:术中操作图Fig.1 Design and preparation of endothelial scraping equipment A: equipment design; B: operation in rabbits
3 兔原代角膜内皮细胞培养和鉴定 原代细胞培养按照“两步法”[7,10]获得单细胞:3只1 kg雄兔安乐死后取眼球,去除眼周结缔组织,浸泡在1%青链霉素-PBS溶液中30 min,显微剪剪下角膜巩膜环,浸泡在无血清的高糖DMEM中,有齿镊夹住巩膜环,无齿镊沿角膜缘撕除后弹力层。完整的后弹力层放在2 mg/mL胶原酶Ⅰ中,37℃、5%CO2培养箱消化1~2 h。观察到角膜内皮细胞形成团簇后加入1 × TE酶消化3 min,进一步分离成更小的细胞,1 000 r/min离心5 min,10% FBS +高糖DMEM培养基重悬细胞沉淀,接种在6孔板中,此细胞为P0代,隔天换液,3 d传代,P2代细胞用于移植及后期实验。4%多聚甲醛固定15 min,0.3% Triton-100破膜,山羊血清工作液封闭30 min,按说明书步骤1∶100稀释ZO-1抗体,4℃过夜,1∶500稀释绿色荧光二抗,DAPI染核,荧光显微镜拍照。
4 大泡性角膜病变模型制备 动物禁食8 h,赛拉嗪和咪达唑仑1∶1混合,按照0.35 mL/kg比例肌内注射全身麻醉,取左侧卧位,术眼眼周碘伏消毒铺单,盐酸奥布卡因滴眼液表面麻醉后,庆大霉素(400 U/mL)冲洗结膜囊。15°角膜穿刺刀在10点位做角巩膜缘切口,肝素-BSS水(5 U/mL)冲洗前房,注入黏弹剂,自制硅胶针头刮除全部角膜内皮,手动注吸黏弹剂,0.04%锥虫蓝染色2 min,证实内皮细胞刮除干净后10-0缝线缝合角巩膜穿刺口。
5 实验分组和处理 按照随机数表法将18只兔分为2组,每组9只。两组均由同一术者建立大泡性角膜病变模型。操作时使用29G胰岛素针头从透明角膜斜行穿刺,实验组(CEC组)注射100 µL细胞悬液(含106个细胞 + Y27632),对照组(Con组)注射等体积无血清DMEM + Y27632,术后保持全麻状态,术眼向下卧位3 h促进细胞黏附。术后术眼使用妥布霉素地塞米松滴眼液点眼,3次/d。注射时遵循盲法,即事先由另一人负责制备细胞悬液并进行实验动物分组和标号,术者前房注射前不清楚注射液种类。
6 前节OCT测角膜厚度 分别在注射后1 d、4 d、7 d、14 d使用前节OCT高分辨率角膜四象限模式扫描角膜0°~180°、45°~225°、90°~270°和135° ~315°的截面,取中央角膜厚度的平均值用于统计学分析[11]。
7 前节照相评估角膜混浊程度 分别在注射后1 d、4 d 、7 d、14 d拍摄眼前节照片,使用0~4的等级对角膜透明度进行评分[12]:0分=完全透明;1分=轻微混浊,虹膜和瞳孔易见;2分=略微不透明,虹膜和瞳孔隐见;3分=不透明,瞳孔难见;4分=完全不透明,看不到瞳孔。评分由本专业非实验人员独立完成。
8 角膜组织学观察 注射14 d后,过量戊巴比妥钠静脉注射处死动物,取角膜组织,撕除1/3后弹力层,内皮面向上用1%茜素红染色3 min,PBS洗3次后铺片显微镜下观察[13];剩余2/3角膜组织用4%多聚甲醛固定后,梯度乙醇脱水,常规石蜡包埋切片,厚度6 µm,苏木精-伊红染色,显微镜下观察角膜组织学变化。
9 统计学分析 使用Graphpad7.0进行统计学分析,两组角膜厚度为计量资料,均以±s表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
结 果
1 大泡性角膜病变模型评价 术中锥虫蓝染色显示角膜内皮刮除范围均匀完整(图2A),术后HE和茜素红结果显示后弹力层完整,未发生脱离且内皮细胞被成功刮除,说明模型制备成功(图2B,图2C)。
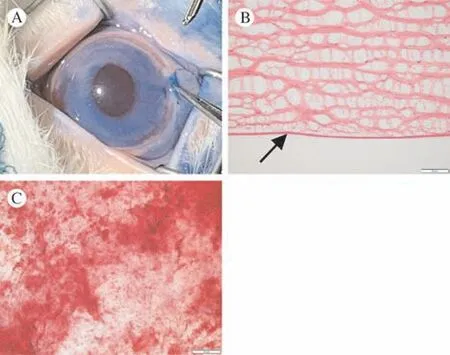
图2 内皮刮除效果评估 A:刮除后0.04%台阶蓝染色确定刮除范围;B:刮除后立即取材进行HE染色,观察后弹力层(箭头所示)连续且完整;C:刮除后茜素红染色未见内皮结构Fig.2 Evaluation of the effect of endothelial A: 0.04% Trypan blue staining after scraping to determine the scraping area;B: HE staining after scraping; Descemet's membrane was intact and continuous (arrow); C: no endothelia remained in alizarin red
2 原代角膜内皮细胞培养和鉴定 倒置相差显微镜下观察到角膜后弹力层在培养基中呈卷曲状态,胶原酶消化能力较为温和,长时间的消化破坏了细胞与后弹力层间的钙黏蛋白并很好地保持了内皮细胞的活性,重悬贴壁后呈典型的“六边形”形态(图3B)。采用免疫荧光检测细胞表面紧密连接蛋白ZO-1可以观察到蛋白的表达(图3C),证实该消化方法对于角膜内皮的膜表面蛋白损伤较小且无其他细胞沾染。
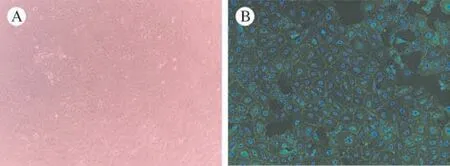
图3 兔原代角膜内皮体外培养及鉴定 A:内皮细胞贴壁后倒置相差显微镜图(4×);B:内皮细胞免疫荧光染色(10×)(蓝色:DAPI;绿色:Z0-1)Fig.3 In vitro culture and identification of rabbit primary corneal endothelium A: image of endothelial cells in culture dish(4×); B: endothelial cell immunofluorescence staining (10×)(Blue: DAPI; Green: ZO-1)
3 角膜厚度透明度观察 CEC组在细胞注射7 d时可达到临床治愈(角膜厚度 < 500 µm),Con组角膜厚度大于CEC组,差异有统计学意义(P<0.05),14 d时两组角膜厚度均大致恢复正常(图4B),其他时间点两组角膜厚度差异无统计学意义(P> 0.05)。在上述时间点分别进行眼前节照相,进行混浊程度评分,结果与角膜厚度变化一致;7 d时CEC组基本恢复透明而对照组仍混浊,14 d后基本恢复透明状态(图5A,图5B)。
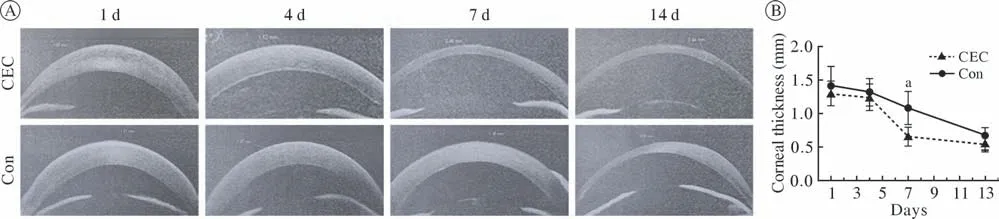
图4 两组角膜厚度变化:与Con组相比,CEC组在细胞注射7 d后角膜厚度显著降低(aP<0.05)Fig.4 Corneal thickness changes: compared with the Con group, the corneal thickness in the CEC group decreased significantly at 7 days after the cell injection (aP<0.05)
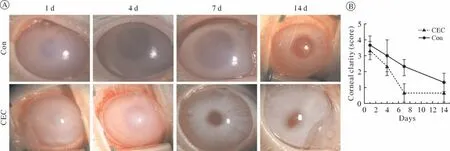
图5 两组角膜混浊程度分析 A:裂隙灯拍照,在第7天时CEC组大致恢复透明而Con组混浊;B:角膜混浊度评分随时间变化折线图(n=9)Fig.5 Analysis of corneal opacity in the two groups A: slit-lamp photograph: the CEC group was almost transparent on 7 d, but the Con group was still opaque; B: the corneal opacity score (n=9)
4 组织学观察 14 d时HE染色见Con组角膜基质部分水肿,上皮下散在大泡形成,CEC组较Con组基质纤维排列更为致密有序(图6A);茜素红染色见CEC组存在规则的“六边形”内皮结构(图6B),Con组仍存在部分区域内皮缺失,且内皮形态呈现“多形性”(图6C)。
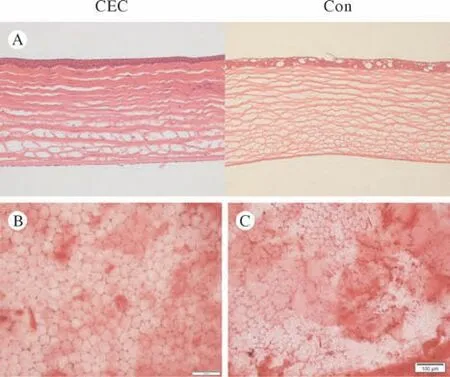
图6 两组组织学观察 A:HE染色;B:CEC组茜素红染色;C:Con组茜素红染色Fig.6 Histology observation A: HE staining; B: the Alizarin Red staining of the CEC group; C: the Alizarin Red staining of Con group
讨 论
目前,角膜供体来源缺乏,细胞疗法治疗大泡性角膜病变被认为是一个再生医学与组织工程结合的新兴研究领域,在理论上提供了角膜内皮组织的无限来源,同时降低了免疫排斥反应[14-15]。Pan等[16]将小鼠成纤维细胞通过小分子化合物成功诱导为角膜内皮样细胞,并采取前房注射的方式在兔大泡性角膜病变中取得成功,进一步扩大了种子细胞来源和谱系;Ali等[17]将多能干细胞诱导的内皮样细胞前房注射到恒河猴大泡性角膜病变中取得一定疗效,证明了前房注射移植细胞在高等动物中的应用价值。尽管兔角膜内皮细胞具有增殖能力,但损伤后14 d角膜内皮并不能完全自行愈合;而本实验组注射细胞后7 d即可达到临床愈合,愈合时间短于兔角膜内皮的自行愈合。由此说明前房注射功能性种子细胞替代病变或丢失的角膜内皮可以治疗大泡性角膜病变,本研究结果与既往报道大致相同[18],本实验中使用的种子细胞来源于同种异体细胞的体外扩增,严格按照随机、对照、盲法的操作,进一步证实前房注射细胞这一疗法的有效性。
同时本实验改良了现有手术器械,保留了兔角膜后弹力层。后弹力层是角膜内皮的基底膜,作为细胞黏附的支架位于内皮的基底侧[19]。基底膜的成分与相应的整合素结合,通过招募细胞接头蛋白、磷酸化结合蛋白和结合接头蛋白至肌动蛋白细胞骨架来启动从细胞外到细胞内的信号传递[20]。因此保留后弹力层对于注射细胞的黏附至关重要。既往构建大泡性角膜病变动物模型使用的20G硅胶针头(Inami & Co.,Ltd.,Tokyo,Japan)造价较为昂贵,手术时间长且不易通过角膜穿刺口[21]。本文自制了一种组装简单、经济实用、操作简便、损伤部位准确可控的手术器械,在动物模型的制备中取得与上述器械相似的手术效果[18,22-24]。为之后可能的小分子化合物筛选、药物载体或支架构建,以及多种来源种子细胞的功能验证提供了一种工具。2013年Koenig[25]发现Fuchs角膜内皮营养不良的患者病程早期去除病变的角膜内皮后角膜重新恢复透明,这一手术也保留了患者的后弹力层,进一步扩大了该类型手术器械的使用范围,如DWEK(descemetorhexis without endothelial keratoplasty)临床治疗[26]。因此,该手术器械不仅可以用于动物模型构建,将来或许也可用于临床治疗。
小分子化合物Y27632是ROCK通路抑制剂,可以通过激活PI3K/Akt信号传导,促进CEC黏附和增殖进而促进角膜损伤修复,与种子细胞共递送可以增加其功能,已成为内皮细胞前房递送和培养的常规添加物质[6,14]。其衍生物已作为临床药物在日本常规应用[27]。本实验中两组采用该小分子化合物是为了评价角膜内皮细胞的在体内是否有功能,不能排除该小分子化合物本身促进角膜内皮再生的作用。
前房注射是经透明角膜以简单和微创的方式传递CEC。细胞注射后,必须保持2~3 h的俯卧位,与ROCK抑制剂Y-27632地共递送,细胞更容易黏附[23]。本研究注射106个细胞是根据既往文献报道确定[14],对于细胞的浓度梯度未进行进一步探讨,仍存在着自身细胞迁移和注射后种子细胞的混合作用干扰问题,对于前房注射细胞的最适宜数量和最终命运转归未进行深入研究。
总之,本研究通过细胞前房注射探究其对改良兔大泡性角膜病变动物模型的治疗作用,证实了前房注射疗法的有效性;改良式动物模型可作为未来种子细胞验证、药物和小分子化合物筛选的临床前研究模型。
