盐渍化胁迫下接种不同丛枝菌根真菌对番茄耐盐性的影响
2022-04-29李逸雯凌康杰王婧绮牟丽娟江晋岚刘瑞强
曹 磊,李逸雯,凌康杰,王婧绮,鄢 蕙,牟丽娟,江晋岚,方 芳 ,刘瑞强
(1.浙江师范大学化学与生命科学学院,浙江 金华 321004;2.东北林业大学林学院,黑龙江 哈尔滨 150040)
0 引言
【研究意义】土壤盐渍化是指能溶于水的盐分随着地底层水上升至泥土表层,盐类沉积物累积在地表的现象[1]。盐分的过分累积不仅引起植物体离子稳态失衡、活性氧大量积累与营养吸收受阻等生理代谢紊乱[2],还会使得土壤中的物理与化学特性产生变异[3],土壤中的有效态微量元素含量也会随之减少[4]。当前全国的盐渍化的土地大约有14.9 亿亩,占全国总的人均可利用耕地面积的比例约9.4%[5],在我国的形势极为严峻[6]。因此需要一种应用性强且安全的生物技术手段,促进和推动我国盐碱化地区的作物耐盐的抗性和产量的稳定发展。【前人研究进展】丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)根系的吸收面积增强主要通过外生菌丝的扩展以此提高植物对土壤中养分的汲取,使植物能够抵抗盐胁迫[7]。根内孢囊霉(Rhiaophagus intraradices,R.i)、摩西斗管囊霉(Funneliformis mosseas,F.m)、幼套近明球囊霉(Clariodeoglous etunicatum,,C.e)、地表多样孢囊霉(Diversispora versiformis,D.v)都是作为广谱型的AM 真菌。研究发现,芦笋(Asparagus officinalis L.)接种R.i 真菌后有助于改善其细胞内的环境和有效吸收氮元素,以此增强芦笋的耐盐性[8]。将C.e 真菌接种在紫茎泽兰的植株中,可以提高紫茎泽兰地上生物量的分配以及其他指标的生长[9]。将F.m 真菌接种于玉米植株,其侵染的比例和孢子的产量明显优于同类其他植物[10]。【本研究切入点】然而,这些研究多侧重于菌根真菌对植物抗盐胁迫及其生长方面的影响[11],关于不同丛枝菌根真菌对番茄抵抗盐胁迫中作用的差异研究鲜见报道。番茄(Solanum lycopersicum L.)不论作为人类的食用蔬菜还是应用在药物研究方面,都有珍贵的价值。然而,我国土地盐渍化的形势使得番茄的产量受到极大影响[12]。通过接种合适的AMF 来增强番茄对盐环境的抗性是一种解决盐渍化下番茄作物种植的安全且高效的方法。【拟解决的关键问题】本研究从4 种AMF 菌种中筛选出2 种促生效应良好的菌种作为对比材料,采用土培法对番茄接菌处理并添加不同浓度梯度的盐溶液,在比较两者生理动态的同时,重点探究不同丛枝菌根真菌对番茄的耐盐抗性和其各类生长指标变化的影响,能够给盐渍化胁迫环境下的其他设施作物的高效安全种植和科学管理提供技术支持和理论依据。
1 材料与方法
1.1 试验设计
试验时间为2019 年5 月至2020 年9 月,试验地点位于在浙江师范大学植物生态学实验室。番茄的种子选用颗粒饱满的中蔬4 号品种,以无菌水催芽后栽种于装有等量富含有机质的红壤和河沙混合的塑料盆(规格:长420 mm、深140 mm、厚12 mm)中,其中基质土壤以红壤和河沙土各1 kg 配比、栽培基质5 L,蛭石0.125 kg。其中基质土的pH 值为6.31、有机质的需求占比为1.55%、全氮7.44%、速效磷、钾分别为35 mg·kg−1、477 mg·kg−1、盐分含量0.03%。在高压灭菌锅的高温下将材料灭菌2 h;其中底肥放入3~4 粒有机氮肥,底肥施足后,整个苗木生长期,无需追加底肥的施肥,如果土壤泛白严重,可在番茄叶片表面进行喷洒施肥。
番茄盆栽用土量深110 mm,每盆6 株,在苗株生长到两叶一心后,每盆经过筛选留下长势约为4~5 cm 的植株3 株。预实验从4 种AMF 菌种中筛选出2 种促生效益最优的菌种作为材料,共设定3 个处理:未接菌的对照组(CK)、接种根内孢囊霉(R.i)与摩西斗管囊霉(F.m)的接菌对照组。以上每个对照中设置2 个盐浓度: 0 和100 mmol·L−1(在预试验中经过仔细筛选对比,100 mmol·L−1的效果能够达到预期目标,因此选为本试验的试验浓度),各设3 个重复,均在26 ℃和15 h 光照的温室环境中进行。接菌处理的番茄每盆添加60 g 菌剂接种物,未接菌处理的每盆中(对照CK)添加等量的灭菌菌剂。接菌时间在30 d 后进行不同浓度盐处理,每天早上每株浇50 mL 盐水,一盆6 株,共300 mL。每隔15 d 测定番茄的生长、光合及抗氧化指标,共测3 个周期,植株生长85 d 时测定其菌根侵染率,并 重点探究不同AMF 对番茄促生作用及抗盐效应差异。
1.2 试验方法
曲利苯蓝染色法主要用于测定菌根侵染率[13];测定过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性以及过氧化氢酶(CAT)的活性方法分别采用愈创木酚法、NBT 光化还原法以及紫外吸收法;测定丙二醛(MDA)和脯氨酸(Pro)含量分别采用硫代巴比妥酸法[14]以及茚三酮显色法[15];叶绿素荧光参数采用便携式荧光仪测定[16]、叶片光合参数的测定用叶片光合参数仪[17]、酶试剂盒测定RuBP 羧化酶和果糖-1 以及6-二磷酸酯酶(FBPase)活性[18]。
在对盆栽中的番茄苗盐处理后的第15 天开始采用不同分级法测定其盐害指标[19],共分为5 级。第0 级:植株处于正常健康的生长水平,未发现遭受盐害的任何影响;第1 级:番茄苗生长稳定,极少数的植株底端有少数叶片出现褪绿的症状;第2 级:植株的生长水平减弱,番茄植株的个别叶片已经出现黄化或枯萎的现象;第3 级:番茄植株叶片有二分之一褪绿、黄化以及枯萎的症状,仅存3~4 片正常生长的绿叶;第4 级:番茄植株的生长水平处于极其缓慢阶段,盆中植株仅有1~2 片正常绿叶;第5 级:植株生长水平极度受限,此时植株的叶片已经彻底黄化。
盐害指数/%=[Σ (第N 级苗×第N 级株数)/5 级×番茄总株数]×100;
番茄菌根依赖性指数(MD,%)测定[20]:对不同处理下的番茄苗的生物量(g)(根、茎和叶干重)进行精准测定,先将番茄的叶片用超纯水清洗后,用滤纸把叶片的水分擦干,然后对植物体杀青(时间为30 min,温度设定为105 ℃),接着放入烘箱(设定温度值为80 ℃)烘干,静置室温后用梅特勒高精度天平称其干重。
其计算公式如下:
番茄菌根依赖性指数(MD)=[接种AMF后番茄总生物量(M+)/未接种AMF番茄总生物量(M−)]×100%
1.3 数据处理
用Excel 2016 试验数据整理,SPSS 25.0 生物统计学软件对试验数据进行分析,分析比较试验结果的显著性差异(α=0.05)以及平均值和标准误的计算采用单因素方差分析法和邓肯法。绘制图表用Origin 8 .5 软件。
2 结果与分析
2.1 优势AMF 的筛选以及不同AMF 对盐胁迫下番茄菌根侵染率影响
不同AMF 对番茄的根系依赖性差异显著,其中F.m 的菌根依赖性和侵染密度分别为54.8%、4.01%,R.i 组为50.9%、4.02% ;D.v 菌根依赖性和侵染密度分别为28.79%、0.81%, C.e 组仅为27.72%、0.79%。(表1)。在盐胁迫环境下接菌对番茄根系的亲和力会显著降低,但F.m 组与R.i 组依赖性仍高于D.v 和C.e 组,说明F.m 与R.i 两种菌种能与番茄建立良好共生关系,由此筛选出F.m 和R.i 是侵染效果较好的优良菌种。
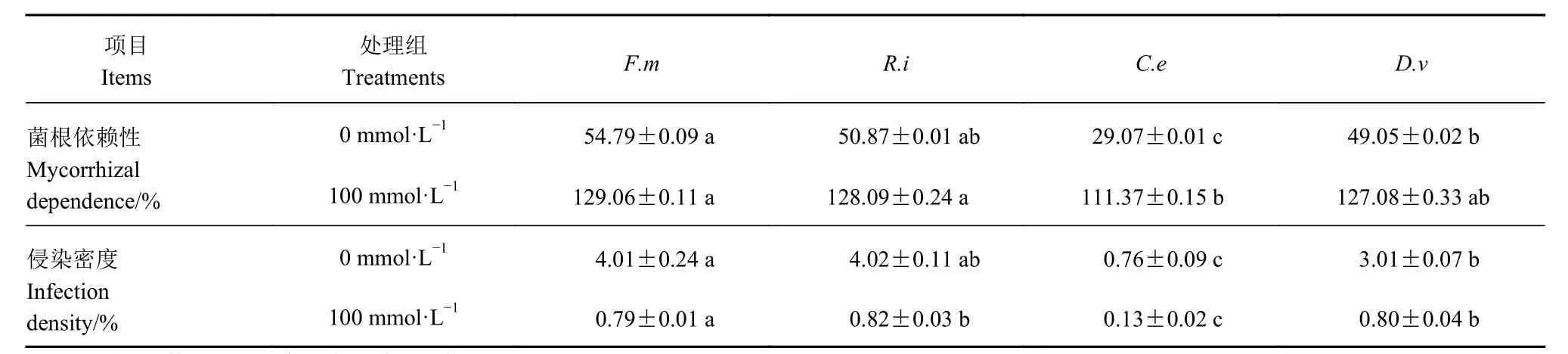
表 1 不同AMF 对盐胁迫下番茄菌根依赖性及侵染密度的影响Table 1 Effects of AMF on mycorrhizal dependence and infection density of tomato plants under salt stress
F.m 及R.i 对番茄根系的侵染情况,通过精细观测和计算发现,无盐处理的F.m、R.i 侵染率分别达54.6%、44.7%(图1),而高盐胁迫后则分别为26.8%、19.0%。这表明AMF 可以有效保护番茄根系免受盐胁 迫损伤,且F.m 对番茄根系的依存度强于R.i。

图1 不同AMF 对盐胁迫下番茄菌根侵染率的影响Fig. 1 Effects of AMF on mycorrhizal infection rate of tomato plants under salt stress
2.2 不同AMF 对盐胁迫下番茄抗氧化酶系统的影响
随着盐处理时间延长,未接菌的CK 组的抗氧化酶活性皆低于接菌组,且F.m 与R.i 接菌组的SOD活性在第15 天时呈现升高的趋势,第30 天以后趋势降低;F.m 与R.i 处理组的POD 以及CAT 活性则呈不断增长的趋势(表2);F.m 无盐胁迫处理与F.m 100高盐处理下,番茄的SOD、POD 和CAT 活性的增长率分别高达42.3%、112.2%、41%和47.4%、32.9%、35.7%;R.i 无盐胁迫处理下,番茄的SOD、POD 和CAT 活性的增长率分别高达23.7%、97.1%、25.3%和21.7%、29.7%、18.3%;施加2 种AMF 菌剂后,番茄植株的抗氧化酶活性显著提高。
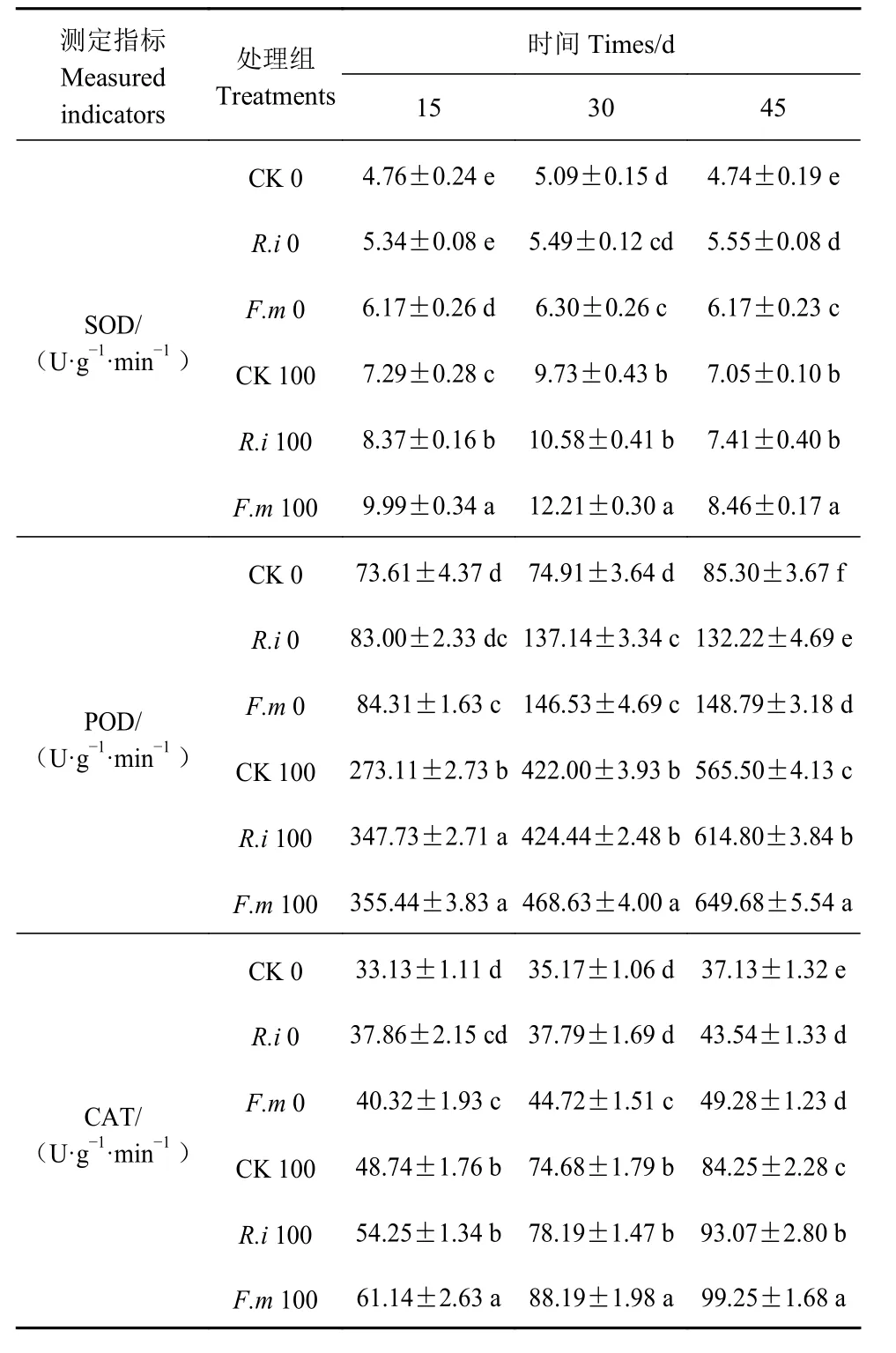
表 2 盐胁迫下AMF 处理后番茄抗氧化酶系统的变化Table 2 Changes on antioxidant enzymes of tomato plants under AMF-treatment against salt stress
2.3 不同AMF对盐胁迫下番茄脯氨酸动态变化及MDA的影响
盐处理后的15~45 d,非盐胁迫下的F.m 组的番茄脯氨酸(Pro)含量较CK 0 呈下降趋势,在15 d时,盐胁迫下的F.m 的番茄脯氨酸(Pro)含量较CK 100 呈大幅提升且随胁迫时间的延长,分别在35 d、45 d 时呈下降的趋势;在15 d、30 d 时,非盐胁迫下的R.i 的番茄脯氨酸(Pro)含量较CK 0 呈急剧增长趋势;在35 d、45 d 时,盐胁迫下的R.i 的番茄脯氨酸(Pro)含量较CK 100 趋势基本持平(表3)。在15 d、35 d、45 d 时非盐胁迫下的F.m 组的丙二醛含量呈现细微降低的趋势;盐胁迫下的F.m 组的MDA含量变化呈现持续增长趋势;无胁迫处理R.i 的丙二醛含量在各时间段基本保持不变;盐逆境下的R.i 的丙二醛含量在各时间段内不断降低。

表3 盐胁迫下AMF 处理后脯氨酸及MDA 含量的变化Table 3 Proline and MDA contents after AMF-treatment under salt stress
从AMF 侵染后脯氨酸(Pro)含量来看,盐胁迫下F.m 最大降幅达60.7%,R.i 仅28%。而CK 组在15 d、35 d、45 d 时,MDA 含量升幅高达142%,增长速率表现为CK>R.i>F.m。高盐处理45 d 后CK 组、R.i 组与F.m 组MDA 含量较处理30 d 时分别增高约1 .7 倍、1.5 倍和1.4 倍。
2.4 不同AMF 对盐胁迫下番茄光合变化的影响
在盐逆境下,非接菌组的番茄叶片的PSll 最大光化学量子产量值(Fv/Fm)值随胁迫时间延长从15~45 d 均 呈 降 低 趋 势;而F.m 100和R.i 100 的Fv/Fm值随胁迫时间延长在15~30 d 先降低而后到第45 d 时呈增高的趋势。F.m、R.i 处理下番茄Fv/Fm最高增长率分别为7.5%、5.6%。盐逆境下,CK 100 在15 d 时番茄初始荧光(Fo)值显著升高;盐逆境下非接菌组的番茄植株的净光合速率(Pn)和气孔导度(Gs)呈现降低的趋势。经过F.m、R.i 处理后,番茄最小荧光(Fo)值降幅分别高达18.3%、9.0%;Fv/Fm最高增长率为7.5%、5.6%;Pn、Gs均有提高,最大增幅分别可达49.1%和35.4%(图2)。
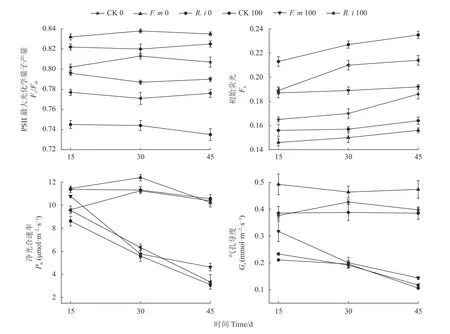
图2 盐胁迫下AMF 处理后对番茄叶绿素荧光参数和光合气体参数影响Fig. 2 Effects of AMF-treatment on chlorophyll fluorescence and photosynthetic gas parameters of tomato plants under salt stress
接菌组光合相关的酶活性均有不同水平的增加,其中无盐处理时,R.i 组FBPase 和RuBP 羧化酶活性在第45 天分别高于对照组29.5%、22.7%(图3),而F.m 对两种酶活性有更好的调控作用,比CK 分别高31.2%和22.5%。盐处理后两种酶活性均降低,15 d 时F.m 组两种酶活性较无盐组分别低6.7%、9 .4%,但接菌组酶活性仍大于对照组。

图3 盐胁迫下AMF 处理后对番茄FBPase 活性与RuBP 酶活性的影响Fig. 3 Effects of AMF-treatment on FBPase and RuBP activities of tomato plants under salt stress
2.5 不同处理组番茄盐害指数的影响变化
盐胁迫组均表现出叶片黄化、萎蔫等盐害症状,接菌组的盐害指数显著低于未接菌组,F.m 组最低,其中F.m 和R.i 组的盐害指数分别为35.63、51.23(表4),与R.i 相比F.m 组的盐害指数降低了30.2%。经过接菌处理下的盐害指数相较于CK,F.m 与R.i组分别降低了57.9%、33.9%,接菌组F.m 是R.i 的1.7 倍。

表4 不同处理组番茄盐害指数的影响变化Table 4 Changes on salt injury index of tomato plants under treatments
3 讨论与结论
丛枝菌根真菌(AMF)可与多于90%的陆生植物构建共生体系[21],在物种竞争与土壤中的微生物有益物质的循环中有主要的调控作用[22]。AMF 定殖并与宿主产生共生关系之后,直接或间接地影响和促进植物生长发育、矿质营养吸收等[23],增强其抗盐逆境能力。AMF 侵染可调节番茄叶片光合特性和维持光合关键酶活性,降低盐环境对光合系统造成的伤害从而增强寄主植物的抗盐能力。菌丝入侵植物根系皮层细胞后通过菌丝体的不断分叉最终为丛枝结构[24],菌根侵染率反映了菌根形成和共生真菌对植物的亲和力,衡量其生态适应性。冯固等[25]研究发现,虽然AMF 能够提高植物的抗盐胁迫能力,但盐离子会抑制其孢子萌发和初级芽管伸长导致菌根侵染率降低,各菌剂处理效果存在差异。就侵染率与侵染密度而言,本研究的结果发现AMF 各菌剂处理效果均呈降低趋势,且F.m 组和R.i 组仍高于D.v组和C.e 组,经过100 mmol·L−1浓度的高盐处理后,D.v 组均达到最大增幅,分别为R.i 组的1.22 倍、1.02倍,由此我们筛选出F.m、R.i 是对盐环境适应力较强的优质品种,但F.m 对番茄根系的侵染效果较R.i更佳。所以可以准确得出F.m 和R.i 对侵染番茄根系有一定优势,且F.m 更适于定殖于番茄根部。
活性氧代谢调节酶如SOD、POD 以及CAT 在植物体细胞内的作用极为重要,主要通过分解清除过量超氧根离子和H2O2,从而提高植物体在盐胁迫的环境下对氧化应激的抵抗能力,细胞损伤程度主要通过它们在植物体内的活性变化来表现[26]。试验发现盐胁迫下番茄抗氧化酶系统总体呈上升趋势,是因为抗氧化酶系统被刺激激活产生了抵抗作用。接种F.m 和R.i 后番茄叶片的SOD、POD、CAT 活性显著增强,这与Guo 等[27]探索盐逆境下AMF 对牡丹(Paeonia suffruticosa Andr.)抗氧化酶活性影响所得结论相似,阐明丛枝菌根真菌可以增强植株抗氧化酶活性,其中F.m 组显然高于R.i 组,在F.m 处理下,SOD、POD、CAT 的活性增长率均达到最大。可知F.m 定殖于番茄更有利于植物体内免疫相关酶类的合成,增强番茄抗氧化酶防御系统。减轻氧化损伤,并改变Pro 和MDA 含量,缓解渗透胁迫与膜脂过氧化。两种菌剂对盐逆境下番茄生长状况均有改善的趋势,盐害指数较对照均呈下降趋势。
丙二醛参与植物体内的物质循环,在逆境胁迫下可通过增加脯氨酸的含量来维护植物渗透调节平衡及膜结构的完整性[28]。而当胁迫程度较高时,膜脂过氧化反应使得丙二醛含量急剧增加[29]。当高盐胁迫的强度过大,会致使植物体细胞膜脂受损,导致脯氨酸的含量增加[30]。MDA 含量用来评估植株体内的膜系统受伤程度以及对胁迫的抵抗性[31]。试验得出,在高盐逆境胁迫后番茄的丙二醛含量升高,接种AMF 会使得植物的抗氧化酶活性不断增高,MDA 含量增速明显减少,增长速率表现为CK>R.i>F.m。说明AMF 能诱导酶促防御系统响应,减少丙二醛含量的过度积累,缓解氧化造成的损伤,提高宿主在植物体内的抵抗高盐胁迫的能力。这与邹晖等[32]、吴秀红等[33]发现,内生菌根可增加植物的酶活性含量,以此来减少丙二醛含量的结果相同。因此AMF 对番茄体内各种物质保护能力会随着盐胁迫的延续性而变弱,且接种不同丛植根菌真菌对盐胁迫的响应程度各异,接种F.m 能够更好增强番茄植株应对盐害的耐受性。
植物细胞膜脂受损,将引起体内渗透系统紊乱,脯氨酸作为调控作用物质[34],在植物处于高盐环境下,会通过显著提高Pro 含量来维护植物体分子结构的稳定性[35]。试验分析显示,经过盐胁迫处理后的植株体内Pro 的含量会显著增加,而通过接种AMF 后可降低植株体内Pro 含量的累积,与CK 组脯氨酸含量相比F.m 组和R.i 组最大降幅分别为60.66%、27.97%,证实AMF 能高效降低盐胁迫带给番茄的危害,这与Elhindi 等[36]发现AMF 可降低甜罗勒(Ocimum basilicum L.)体内Pro 含量并缓解盐胁迫的结果相似,说明AMF 菌剂可提升抗盐应激反应中植物的抗盐能力,维持植物体内的渗透平衡。
反映植物光合系统调节状况的重要指标是叶绿素荧光参数和光合气体参数[37],最大光化学量子效率(Fv/Fm)和初始荧光Fo与植物的光抑制程度密切相关[38]。植物光合能力强弱通过叶绿素荧光特性及叶片光合参数反映,在植物处于逆境胁迫下更能表达植物抗盐性[39]。朱先灿等[40]在对玉米的探究中发现接种菌根能改善光合特性,以此加强盐环境下宿主的光合作用能力。本研究结果也呈现类似趋势:不同AMF 对番茄光合参数的影响程度各异,但各处理组的番茄Fv/Fm、Pn及Gs等参数均显著增加,说明AMF 能够使气孔限制减弱,维持高水平光合速率。
RuBP 羧化酶和FBPase 均在光合碳循环起关键的调节作用,能直接影响光合产物的累积和光合循环效率[41]。RuBP 羧化酶和FBPase 活力减低是光合衰退的内在体现因素,结果表明,高盐逆境会促使植株的RuBP 羧化酶和FBPase 活性减弱,而AMF 侵染缓解了盐胁迫对两种光合关键酶活性的阻抑,促进植物体对物质的羧化储存,有利于光合产物的积累,这与Zhang 等发现AMF 能调节芦笋(Asparagus officinalis L.)光合酶活性,启动光保护机制的结果类似。由此表明,AMF 可通过改善光能吸收、电子传递等光合过程,减缓盐胁迫对光合关键酶活性的抑制,能够促进植物进行光合作用,增强共生体应对不利环境的抵御能力[42]。且F.m 影响效果更佳。
对于AMF 应对盐胁迫的危害的治理效果意见不一。张淑彬等[43]通过对植株生长效应等指标的综合分析,评定结果表明摩西斗管囊霉的综合效果高于其他AM 真菌,在对沙打旺(Astragalus adsurgens Pall.)接菌处理发现能够产生很好的作用。本试验分析了各接菌处理组对番茄盐胁迫的盐害指数和促生效益的数据,发现在各项指数上,F.m 与番茄的共生体系对盐胁迫的抵御能力较R.i 更好,F.m 为与番茄建立最优共生体系的高效菌种。说明AMF 接种不同的植株产生作用有异。综上,F.m 对盐逆境下番茄的生理状况及光合水平均有较为显著的改善作用,由此筛选得到F.m 为番茄高效AMF 菌种。
综上所述,AMF 真菌能够减少盐分累积,从而降低对番茄的盐害损伤。其主要通过抗氧化酶活性地不断增高,MDA 含量增速明显减少、减缓盐胁迫对光合关键酶活性的抑制,促进光合作用来提高共生体对不利环境的抵御能力及植株对矿质营养吸收、介导植物理化代谢过程等增强番茄对盐胁迫逆境下的耐受能力。笔者从4 种丛枝根菌真菌中筛选出F.m 作为高效促生菌种,可将其应用于番茄规模化生产实践,为盐渍土改良和生态环境治理提供一种低成本、少限制且对环境友好的生物学措施。为其在浙江盐渍地区番茄设施产业的种植奠定基础,同时为进一步构建优良的作物-AMF 共生耦合体系、最终运用高效的生物防治技术有力推动设施农业的健康可持续发展。
