喀斯特石漠化地区火龙果林退化对土壤生态酶化学计量指标的影响
2022-04-28王治福喻阳华熊康宁李廷铃刘海燕
王治福,喻阳华,熊康宁,杨 珊,秦 瑶,李廷铃,刘海燕
(贵州师范大学喀斯特研究院/国家喀斯特石漠化防治工程技术研究中心,贵州 贵阳 550001)
0 引言
【研究意义】我国西南喀斯特区域景观异质性强,水土流失、漏失和石漠化严重,具有明显的脆弱性[1]。加之石漠化区土层浅薄且不连续、人为对植被干扰较大,这必然对植物产生逆境胁迫,形成结构缺失、功能低效的退化林[2],因而在该地区进行植被恢复和生态环境建设显得尤为重要。但喀斯特石漠化地区植被退化过程中土壤酶活性及化学计量的变化机制和土壤养分转化机理尚不明晰,因此,研究土壤酶活性和生态酶化学计量不仅对评估石漠化区生态系统养分循环与限制状况以及恢复重建具有重要意义,也对完善生态化学计量学理论有一定的参考价值。【前人研究进展】土壤胞外酶主要指来自土壤中动植物、微生物活动及其残体的分解物[3],是土壤有机质降解、转化和矿化的媒介,也是其分解过程中重要的限速因子[4]。生态酶化学计量是指生态系统中参与营养元素C、N 和P 循环的土壤胞外酶活性的比值,通常以微生物分泌的碳(C)循环酶β-葡萄糖苷酶(β-Glucosidase,βGC)、氮(N)循环酶N-乙酰-β-D-葡萄糖苷酶(N-acetyl-β-D-glucosidase,NAG)和亮氨酸氨基肽酶(Leucine aminopeptidase,LAP)、磷(P)循环酶酸性磷酸酶(Acid phosphatase,ACP)表示[5]。这些酶参与末端的催化反应,可以指示土壤微生物养分需求与养分限制状况[6]。植被退化是在人为或自然干扰下形成偏离干扰前或参照系统的状态。与干扰前或参照系统相比,植被退化在结构上表现为物种组成和结构变化;在功能上表现为生物生产力降低,森林活力、组织力和恢复力下降,生物间相互关系改变以及生态学过程发生紊乱等[2]。目前,退化生态系统中土壤酶活性及其化学计量已经引起了科学家们的广泛关注。有研究表明,土壤酶活性随着植被退化加剧呈下降趋势[7−8]。植被退化对土壤理化性质和土壤酶有一致性影响,说明土壤酶能反映土壤中各种化合物的转化进程,对土壤肥力的形成和积累具有关键影响[9−10]。同时,李海云等[11]研究表明土壤理化、酶活性和土壤C、N、P 化学计量等因素对不同退化草地土壤质量状况的响应较为灵敏。喻岚晖等[12]研究发现青藏高原草甸退化引起了该地区的土壤氮限制,表明生态酶化学计量对土壤养分变化响应敏感。火龙果(Hylocereus undatus)属仙人掌科(Cactaceae),为多年生攀援性肉质灌木[13],因其抗旱能力强、果实品质优、经济效益高的特点,广泛种植于喀斯特石漠化地区,成为喀斯特石漠化地区生态治理的物种选择之一,为喀斯特石漠化地区退化生态系统的恢复和社会的经济建设发挥显著作用[14−16]。【本研究切入点】目前学者们多关注于火龙果林的品种选育[17]、果实贮藏加工[18]和营养成分[19−20]等方面研究,针对退化火龙果林土壤酶活性和生态酶化学计量尚有待深入探讨。【拟解决的关键问题】以无退化(None degradation,ND)、轻度退化(Light degradation,LD)、中度退化(Moderate degradation,MD)、重 度 退 化(severe degradation,SD)4 个退化梯度的火龙果林为对象,对0~30 cm土壤理化性质、酶活性和生态酶化学计量进行测度,探究喀斯特石漠化地区不同退化火龙果林土壤酶活性及生态酶化学计量变化特征,揭示喀斯特石漠化地区火龙果林退化过程中土壤养分限制因子,为喀斯特石漠化地区火龙果林植被的恢复和可持续经营提供科学依据。
1 材料与方法
1.1 研究区域概况
研究区位于贵州省贞丰县与关岭县交界处北盘江花江段,105°36'30″E—105°46'30″E、25°39'13″N—25°41'00″N,是典型喀斯特高原峡谷石漠化区。主要表现如下:(1)干热型河谷气候。该区年均温18.4 ℃,年均降雨量1 100 mm,且时空分布不均,岩溶性干旱现象严重,为半亚热带湿润季风气候[21];(2)河谷地貌典型。属典型喀斯特高原峡谷,地势起伏海拔370~1 473 m,河谷深切,地下水深埋,地表干旱,生境干热特征显著;(3)石漠化发育强烈。区内基岩裸露面积在70%以上,土层浅薄,保水性、耐旱性差,以中-强度石漠化为主[21]。(4)植被次生性明显。以火龙果(Hylocereus undatus)、花椒(Zanthoxylum bungeanum)、核桃(Juglns regiaa)等 经果林为主。
1.2 样地设置与样品采集
2021 年7 月,通过对研究区火龙果林的实地调查,在海拔较为一致的区域,选取同一林龄的火龙果林,参考前人的方法[22−23],依据火龙果林生长状况如:株高、冠幅,枝条颜色、枯枝率、结果枝条数、枝条长度、枝条厚度、单果重等指标,将火龙果林划分为无退化(ND)、轻度退化(LD)、中度退化(MD)、重度退化(SD)共4 种退化程度(表1),每个退化类型设3 个重复,样地之间距离大于10 m,共12 个样地。
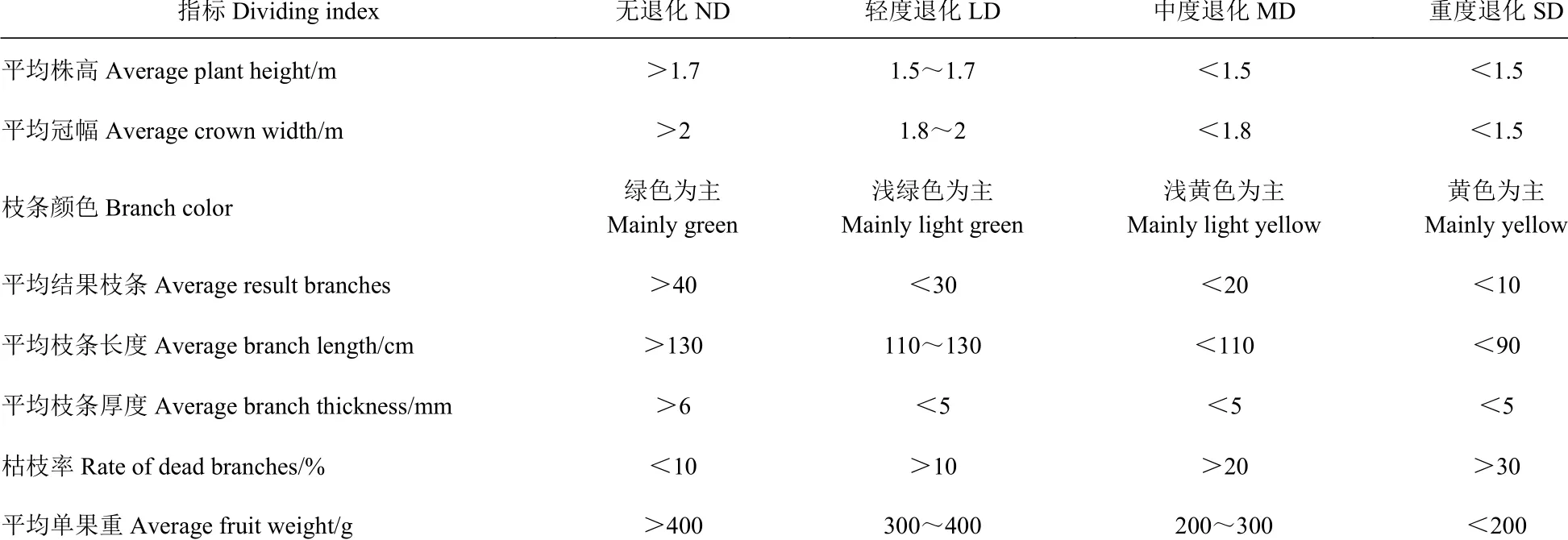
表 1 火龙果林退化程度划分标准Table 1 Classification standards of pitaya forest degradation
采用直径5 cm 的土钻按“S”型钻取深度为0~10、10~20、20~30 cm 的土样(不足30 cm 的以实际深度为准),按5 个点的土样混合,然后用四分法取出约1 kg 样品,马上放入冷藏箱内。土样带回实验室后,剔除石砾、根系和动物残体等杂物,过2 mm 筛分为两部分,一部分自然风干,用于土壤理化性质测定,另一部分4 ℃下保存,用于土壤酶活 性的测定。
1.3 土壤样品测定
土壤理化性质参照《土壤农化分析方法》测定[24]。其中,土壤含水量(Soil moisture content,SMC)通过环刀法计算得出;土壤pH(按土水质量比1∶2.5)采用 pH 计测定,土壤有机碳(Soil organic carbon,SOC)采用重铬酸钾-外加热法测定,全氮(Total nitrogen,TN)采用凯氏定氮法测定,全磷(Total phosphorus,TP)采用HClO4-H2SO4法测定,速效磷(Available phosphorus,AP)采用NH4F-HCl 法测定,速效氮(Available nitrogen,AN)采用碱解扩散法测定。
土壤酶活性参照焦鹏宇等[25]的方法分别测定酶β-葡 萄 糖 苷 酶(βGC)、N-乙 酰-β-D-葡 萄 糖 苷 酶(NAG)、亮氨酸氨基肽酶(LAP)和酸性磷酸酶(ACP)的活性,酶活性单位以μmol·d−1·g−1表示。
1.4 数据分析
采用SPSS 25 处理数据。采用单因素方差分析(One-way ANOVAS)、双因素方差分析(Two-way ANOVAS)和Duncan 法检验不同退化程度、土层各变量的差异性,采用Pearson 相关分析各因子间的关系,采用Canoco 5 对土壤理化性质、酶活性和生态酶化学计量进行冗余分析(RDA)。图表数据均采用平均值±标准误表示。采用ln(βGC)/ln(NAG+LAP)表示土壤C∶N 酶活性比,ln(βGC)/ln(ACP)表示土壤C∶P 酶活性比,ln(NAG+LAP)/ln(ACP)表示土壤N∶P 酶活性比。酶化学计量的矢量长度(Vector length,L)和矢量角度(Vector angle,A),计算如下[25,26]:

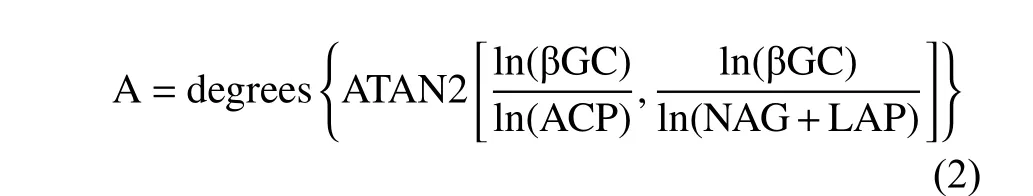
2 结果与分析
2.1 土壤理化性质变化特征
火龙果林土壤理化性质受火龙果林退化程度、土层及其交互作用的显著影响(图1)。各退化程度土壤pH 均呈酸性,且差异不显著(图1-a),说明火龙果林退化对pH 无显著影响。SMC 在不同退化之间呈先增后减趋势(图1-b),SD 较ND 下降19.47%,说明土壤水分亏缺可能会导致火龙果林生长退化。SOC、TN、AN 和AP 在各退化梯度间表现出差异(P<0.05,图1-c、图1-d、图1-f 和图1-g),说明C、N 和P 元素对火龙果林生长具有重要影响。土壤C∶N 在SD 显著低于其他退化梯度,N∶P 显著高于其他类型,C∶P 无显著差异(图1-h、图1-i 和图1-j),说明土壤养分失衡可能导致土壤质量的下降,显著影响火龙果林生长。结果表明火龙果林表层0~10 cm的土壤水分散失较大[27],各土壤养分(TP 除外)呈表 聚特征。


图1 不同退化火龙果林土壤理化性质Fig. 1 Physiochemical properties of pitaya forests with varied degrees of degradation注:不同大写字母表示同一土层内不同退化程度间差异显著,不同小写字母表示同一退化程度不同土层间差异显著(P<0.05);F:重要性,D:退化,S:土层,D×S:退化与土层交互作用,图2~3 同。Note: Data with different capital letters indicate significant differences between varied degrees of degradation in same soil layer; data with different lowercase letters indicate significant differences between different layers of soil with same degree of degradation (p<0.05); F: Significance; D:degradation; S: soil layer, D×S: degradation and soil interaction; Same for Figs. 2 and 3.
2.2 土壤酶活性变化特征
退化程度和不同土层显著影响土壤酶的活性,但交互作用无显著差异(图2)。土壤βGC 和ACP 活性变化范围分别为21.35~35.32、3.74~6.77 μmol·d−1·g−1(图2-a、图2-c),其中,土壤βGC 在0~20 cm 土层随退化加剧表现先增高后降低,在20~30 cm 土层中仅SD 显著低于其他退化阶段;而土壤ACP 在0~30 cm 土层呈现相同趋势(10~20 cm 土层除外),总体上随退化加剧先上升后下降。说明随火龙果林退化加剧,表征C 与P 循环的胞外酶活性均显著下降。土壤NAG 和LAP 变幅分别为7.92~11.89、8.66~13.22 μmol·d−1·g−1(图2-b、图2-d),其中NAG 仅在10~20 cm 和20~30 cm 土层存在显著差异(P<0.05);而LAP 在0~10、10~20、20~30 cm 土层中均为SD、MD 显著大于ND,受退化程度显著影响。土壤LAP+NAG(17.02~24.95 μmol·d−1·g−1)总体呈逐渐增加趋势(图2-e)。结果表明,4 种酶活性均随土壤深度的 增加而显著降低,呈表聚现象。
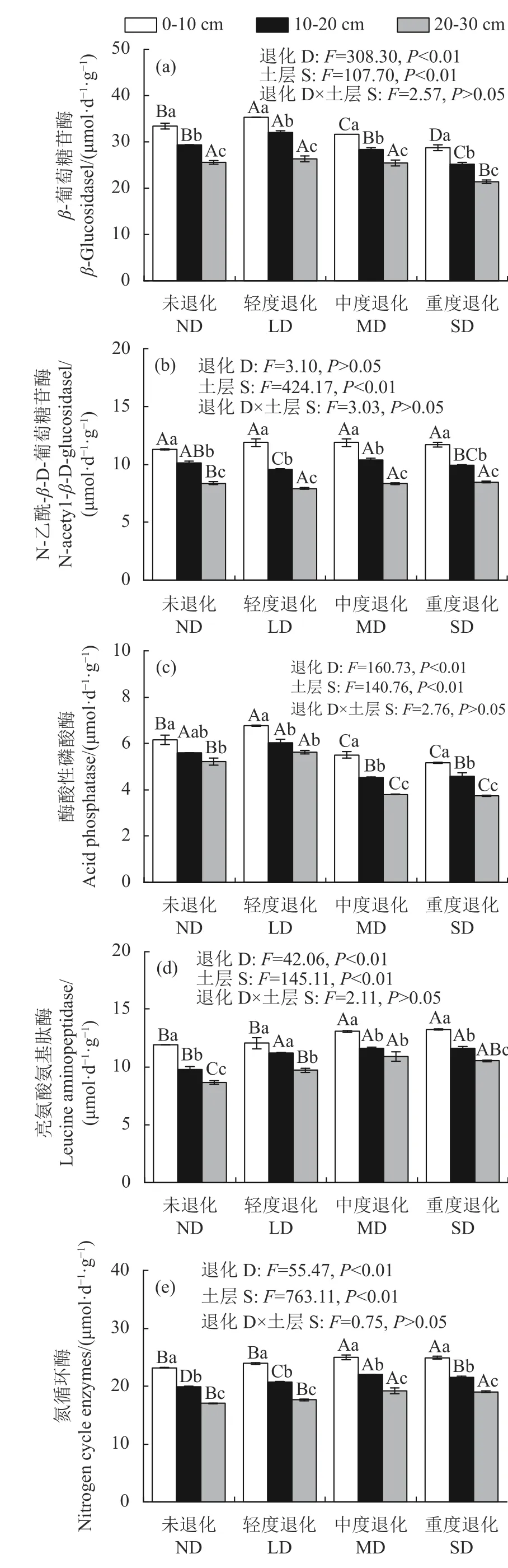
图2 不同退化程度火龙果林土壤酶活性变化特征Fig. 2 Characteristic changes on soil enzyme activity of pitaya forests with varied degrees of degradation
2.3 土壤生态酶化学计量及矢量变化特征
生态酶化学计量及矢量特征受退化和土层显著影响,它们之间的交互作用对生态酶化学计量和矢量特性均存在显著影响(P<0.01,图3)。其中,ln(βGC)/ln(NAG+LAP)变化区间为1.04~1.14(图3-a),在0~30 cm 随退化梯度显著降低(LD 除外)。ln(βGC)/ln(ACP)和ln(NAG+LAP)/ln(ACP)变化范围分别为1.86~2.43、1.66~2.23(图3-b、图3-c),受退化的显著影响,均表现为MD 和SD 显著高于ND(P<0.05)。说明退化火龙果林微生物资源利用策略发生变化,采取不同途径利用资源。不同退化矢量L 在10~20 cm 和20~30 cm 土层存在显著差异,且在MD 为最大值(图3-d)。不同退化矢量A 均小于45°(图3-e),说明不同退化火龙果林土壤微生物受N 限制。具体而 言,ND 和LD 显 著 高 于SD 和MD(P<0.05),表明微生物 N 限制随着退化加剧而逐渐增强。此外,不同土层生态酶化学计量和矢量特征仅在SD 和MD 差异显著(P<0.05),说明土层显著影响生 态酶化学计量的垂直分布。

图3 不同退化火龙果林土壤生态酶化学计量及矢量特征Fig. 3 Chemometric and vectorial characteristics of ecological enzymes in soils of pitaya forests with varied degrees of degradation
2.4 土壤理化性质与酶活性及生态酶化学计量相关性
Pearson 相关分析表明,土壤理化性质与土壤酶活性、生态酶化学计量和矢量特征密切相关(图4)。具体而言,βGC 和NAG、LAP、NAG+LAP 与SMC呈显著负相关,生态酶化学计量及矢量特征与SMC无显著相关。此外,大多数酶活性及生态酶化学计量与土壤养分呈显著正相关。土壤AN 和AP 与土壤C、N、P 循环酶显著正相关,与ln(βGC)/ln(ACP)显著负相关。N 循环酶均与SOC 呈显著正相关,另外LAP 和ln(NAG+LAP)/ln(ACP)与TN 正相关,ln(βGC)/ln (NAG+LAP)与SOC 和TN 负相关。相比之下,生态酶化学计量中仅ln(βGC)/ln(NAG+LAP)与C∶N 呈正相关,与N∶P 显著负相关。矢量L 与AN 和AP 呈显著负相关,A 与TN 显著负相关。表明土壤理化性状对酶活性和生态酶化学计量显著相关,具有较强的促进或抑制作用。由相关性分析结果可知,土壤pH、TP 和C∶P 与土壤酶活性和生态酶化学计量无显著关系,故剔除。进一步做RDA分析表明,土壤理化性质共解释土壤酶活性、生态酶化学计量及矢量特征83.4%的变异,RDA1 和RDA2共解释变量的80.98%,土壤AP(F=19.9;P=0.002)、TN(F=18.1; P=0.002)和 AN(F=3.8; P=0.026)是影响土壤酶活性和生态酶化学计量的显著影响因子,分别解释47.5%、24.3%和4.5%的变异(图5)。表明火龙果林退化对土壤酶活性和生态酶化学计量的 影响是通过调控土壤N、P 养分来实现。

图4 土壤理化性质与酶活性、生态酶化学计量及矢量特征相关性Fig. 4 Correlation between physiochemical properties and enzyme activity, ecoenzymatic stoichiometry, and vector of soil

图5 土壤酶活性、生态酶化学计量及矢量特征的冗余分析Fig. 5 Redundant analysis on enzyme activity, ecoenzymatic stoichiometry, and vector of soil
3 讨论与结论
3.1 不同退化火龙果林土壤酶活性变化特征
土壤酶活性在土壤生物化学过程中起着关键作用,是土壤生物化学反应的催化剂,反映土壤中营养元素转化能力和微生物活性,能迅速指示土壤肥力和质量变化趋势[28]。本研究结果表明,在0~30 cm土层,βGC 和ACP 总体上均随退化加剧呈先增高后降低的趋势(20~30 cm 土层βGC、10~20 cm 土层ACP 除外),均以LD 阶段活性最强、ND 次之,表明火龙果退化加剧使得C、P 循环酶的活性减弱。究其原因,是退化初期火龙果代谢更为旺盛,土壤透气性更好,利于根系分泌物累积,导致酶代谢活动增强[10],使得土壤βGC 与ACP 活性在LD 阶段最高。而随退化加剧,植株高度、冠幅、高度、根系活力均降低,生长代谢减缓,导致地上与地下生物量减少,使得由植被分泌或分解产生的酶来源下降[29]。同时,受长期人为经营活动的影响,容重增加、土壤板结,不利于土壤中气体的交换[30],抑制了土壤呼吸和微生物活性[29],进而导致土壤βGC 和ACP 的活性减弱。另外,使用除草剂等农药,使残留物在土壤中成累积状态,微生物细胞膜蛋白质与磷脂间稳定的极性键或疏水性键受到农药的胁迫而被解离,土壤酶系统功能受损,从而抑制酶活性[31]。而高盐条件下,微生物吸收了大量离子(Na+、Cl−等)进入细胞,伤害酶和膜系统[32],并抑制植物根系生长,降低土壤中活性微生物的种群数量,从而减少土壤酶的合成[33]。该区土壤NAG、LAP 活性变化规律与李邵宇等[34]研究结果不同,这可能与施用肥料有关;长期施肥显著提高了土壤NAG 活性[35],原因是该区越退化越施肥的耕作方式,导致肥料因吸收能力下降而不断积累,使土壤微生物所需底物增加,通过其结构和功能变化而影响酶活性[36]。还可能因为施用农药浓度、持续时间和土壤类型的差异造成相反趋势,土壤微生物受到农药的胁迫而应激释放出的物质,以及胞内酶,有利于提高土壤酶活性[31],且不同土壤酶类型对农药施用的响应不同,如NAG 和LAP 活性受草甘膦激活[37]。N 循环酶(NAG+LAP)活性总体上随退化加剧呈上升趋势,在MD 和SD 显著高于ND 和LD(P<0.05),这与喻岚晖[38]研究结果基本一致,说明火龙果林退化过程中可分解N 素的酶活性较高,暗示随着退化程度的加剧,微生物需要分泌更多的 N 循环酶来获得养分以满足自身对于N 素的需求策略[38]。根据已有对退化土壤生态系统的研究可知,土壤酶活性与土壤生态系统的退化、产酶生物、生境理化性质以及酶类自身的性质等均有关[12]。为此,要阐明酶活性的变化趋势与原因,仍需结合各方面的影响因素考量,有待进一步研究。
3.2 喀斯特石漠化地区火龙果林土壤养分限制因子
土壤生态酶化学计量可以反映土壤养分资源的有效性和微生物对养分需求的变化[41]。在本研究中,土壤酶ln(βGC)/ln(NAG+LAP)变化范围为1.04~1.14,与Sinsabaugh 等研究[42]得出的生态酶化学计量C∶N(酶C∶N 为1.41)相比较低;而酶化学计量ln(βGC)/ln(ACP)和 ln(NAG+LAP)/ln(ACP)变化区间分别为1.86~2.43、1.66~2.23,与Sinsabaugh等研究[42]得出的生态酶化学计量C∶P 和 N∶P(酶C∶P 为0.62,N∶P 为0.44)相比较高,反映出研究区不同退化火龙果林主要受N 元素的制约。并且,所有退化梯度土壤酶活性的矢量角度均小于45°,核实该研究区受N 元素限制。这与李邵宇等[34]和Guo 等[43]研究结果相似。其中,土壤酶ln(βGC)/ln(NAG+LAP)和A 随退化加剧而降低,均表现在SD 为最小。结果表明,在SD 阶段火龙果林土壤N 限制最为严重。土壤酶ln(βGC)/ln(ACP)、ln(NAG+LAP)/ln(ACP)和L 在LD 没有显著差异,表明火龙果林退化初期对C、P 需求变化趋势大致相同。随着退化加剧,均表现在MD 最高,而后降低,表明随着退化加剧火龙果林对C 的需求大于 P 的需求,对C、N 需求存在权衡关系。本研究与以往报道热带、亚热带地区森林中大部分存在土壤P 元素限制研究结果不一致[44,45],而与焦鹏宇等[25]对中亚热带不同林龄马尾松林土壤酶学计量特征和Guo 等[43]对中国西南地区喀斯特地貌森林生态系统研究结果一致。相比大尺度区域,在小尺度区域上,不同地形[46]、林分[47]、林龄[48]、土地利用方式[49]等差异均会使土壤养分发生变化,从而表现出不同区域土壤养分限制存在差异。如喻岚晖等[12]对青藏高原退化草甸土壤生态酶化学计量的研究发现,草地退化引起了该地区的土壤氮限制。
3.3 土壤酶活性及生态酶化学计量的关键驱动因素
土壤酶活性与生态酶化学计量受资源有效性的调控[50]。RDA 分析表明,土壤理化性质共解释土壤酶活性、生态酶化学计量及矢量特性83.4%的变异,其中土壤AP 和TN 是影响土壤酶活性及生态酶化学计量的关键影响因子,分别解释了47.5%和24.3%的变异,表明在火龙果退化过程中这2 个因素对土壤酶活性和生态酶化学计量的变化起主要驱动作用。这与曾泉鑫等[51]研究结果基本一致。且相关性分析表明,AP、AN 含量与βGC、NAG、LAP、NAG+LAP 和ACP 显著正 相 关,AP 和AN 含 量越高,能够同时促进土壤微生物分泌C、N、P 循环相关酶。土壤TN 含量也是土壤酶活性和生态酶化学计量变异的因子,这与孙彩丽等[49]研究结果一致,相关分析表明,TN 与LAP 和ln(NAG+LAP)/ln(ACP)呈显著正效应,与ln(βGC)/ln(NAG+LAP)和Vector A 呈负效应。此外,ln(βGC)/ln(NAG+LAP)与土壤C∶N 显著正相关,与土壤N∶P 负相关关系,说明土壤养分化学计量比也能影响生态酶化学计量。然而,钟泽坤等[52]和乔航等[48]研究发现土壤SOC 分别是驱动黄土丘陵区撂荒农田和亚热带区不同林龄油茶人工林土壤酶活性及生态酶化学计量的关键驱动因子,表明不同生态系统驱动因子存在差异,体现了特定的生态系统中土壤酶活性和生态酶化学计量关系的复杂性。但本研究尚未涉及土壤微生物研究,因此未来还需要结合土壤微生物进一步研究,以更好阐明火龙果林养分循环与限制机制。
综上所述,喀斯特石漠化地区火龙果林退化对土壤酶活性和生态酶化学计量存在显著影响。表征土壤C、P 循环酶活性总体上随退化梯度均降低,土壤N 循环酶活性总体上随退化加剧而增加,且各土壤酶呈表聚特征。土壤生态酶化学计量C∶N 随退化加剧显著降低,而酶C∶P 和酶N∶P 随退化加剧而上升,在MD 为最高,矢量长度随退化加剧而增加,矢量角度则随退化加剧而降低,表明土壤微生物资源分配策略发生变化。结果表明喀斯特石漠化区火龙果林土壤微生物总体受土壤N 限制且随退化加剧而有所增大,AP 和TN 含量是影响土壤酶和生态酶化学计量变异的主要驱动因素。
ZHOU W, ZHOU Y C. Soil enzyme activities under different vegetation types in Beipan River karst gorge district [J]. Scientia Silvae Sinicae, 2010, 46(1): 136−141.(in Chinese)
YU L H, WANG J, LIAO L R, et al. Soil microbial biomass, enzyme activities and ecological stoichiometric characteristics and influencing factors along degraded meadows on the Qinghai-Tibet Plateau [J].Acta Agrestia Sinica, 2020, 28(6): 1702−1710.(in Chinese)
