适配体修饰的绞股蓝皂苷靶向脂质体的制备及抗肿瘤研究*
2022-04-28赖宗强吴丽宁黎渊弘唐云峡
赖宗强,吴丽宁,黎渊弘,唐云峡
(广西医科大学第二附属医院药学部,南宁 530007)
目前肝癌治疗困难,常规治疗手段进入瓶颈,难以取得新突破。现代研究证实绞股蓝皂苷(gypenosides,Gyp)具有抗多种肿瘤功效[1],具有巨大开发潜力。但是绞股蓝用于抗肿瘤时本身缺乏靶向性,药物作用效率不高,而且绞股蓝总皂苷口服后很容易被降解代谢[2-3],因此需要大剂量或频繁给药。因此,迫切需要研发新型靶向药物制剂提高绞股蓝的抑癌效果,同时改善其吸收代谢,才有利于绞股蓝的进一步推广和应用。中药纳米载药制剂可提高药物的生物利用度[4],提高药物的稳定性,还可以通过修饰原件增强中药的靶向性[5]。脂质体是应用最多的中药纳米制剂载体之一,其具有优良的生物相容性、生物安全性,易通过各种修饰实现靶向性等特点[6-7]。适配体(aptamer,Apt)是一类经筛选得到的单链DNA或RNA,可通过三维结构以高亲和力特异性结合在靶标上,具有分子量小、易于修饰合成、低毒低、低免疫原性、组织渗透性强等优势。因此,Apt被广泛应用于药物靶向治疗及肿瘤检测等领域[8-10]。用Apt修饰中药载药系统的研究鲜有报道。因此本研究基于Gyp的抗肝癌作用,结合脂质体载药的优良特性,连接能够靶向肿瘤标志物Ep-CAM的Apt(SYL3C)[11],制备中药纳米载药系统SYL3C-Gyp@Lipo,并检测其表征特性、药物释放度及对肝癌细胞的靶向杀伤功能。
1 材料与方法
1.1主要材料
鞘磷脂(SM)、胆固醇(Chol)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)、DSPEPEG(2000)-MAL均购自Avanti polar lipids公司(USA)。Gyp购自上海阿拉丁生化科技股份有限公司,DMSO试剂、MTT试剂盒购自博士德公司,枸橼酸钠缓冲液、香草醛、Cy 5.5荧光染料、鱼精蛋白、Triton X-100均购自北京索莱宝科技有限公司,聚碳酸酯膜购自密理博中国有限公司,其余试剂均为分析纯级别。Apt由生工生物工程(上海)股份有限公司合成,其序列为:5’-CACTACAGAGGTTGCGTCTGTCCCACGTTGTCATGGGGGGTTGGCCTG-(T)5-SH-3’。
1.2实验仪器
Sorvall Biofuge Stratos型高速离心机(德国Thermo公司),Alpha1-4 LSC型冷冻干燥机(德国Martin Christ公司),L-117小型喷雾干燥器(北京来亨仪器设备有限公司),TU-1901型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司),Nano-S型激光粒度分析仪(英国Malvern公司),H-7650型透射电子显微镜(日本日立公司)。
1.3实验方法
1.3.1 Apt功能化的Gyp靶向脂质体的制备 将溶解在氯仿中的SM、Chol、DSPE-PEG2000和DSPEPEG(2000)-MAL按摩尔质量比55∶40∶4.7∶0.3加入圆底烧瓶中,旋转蒸发仪60℃蒸发10 min,形成干燥薄膜,真空干燥仪干燥过夜以去除残留的有机溶剂。将瓶底的脂质薄膜用l mL 300 nmol的枸橼酸缓冲液(pH=4.0)进行水化,50℃水浴超声20 min后,在液氮、60℃水浴反复冻融5次。将产物装入脂质体挤推器,依次通过200 nm、100 nm的聚碳酸酯膜各20次,形成直径在100 nm左右的空白脂质体Lipo。按照药物∶脂质体比1∶10,取适量空白脂质体和Gyp PBS溶液(1 mg/mL),45℃恒温振摇90 min,冰浴条件下探头超声10 min(超声时间2 s,间隔时间2 s,功率为100 W),即制备包裹Gyp的脂质体Gyp@Lipo,透析除去游离的Gyp。取包药脂质体Gyp@Lipo 10 mg,加入2 nmol的SYL3C Apt,氮气保护环境下室温反应24 h。加入2 nmol的β-半胱胺除去未反应的MAL基团。透析除去多余的β-半胱胺和SYL3C,即得靶向药物传递系统SYL3CGyp@Lipo,4℃储存备用。为了进行荧光表征,制备荧光脂质体,即在上述加入绞股蓝步骤中额外加入占总脂质体质量0.5%的Cy 5.5红色荧光染料,可得到带红色荧光的脂质体:Gyp@Lipo-Cy5.5和SYL3C-Gyp@Lipo-Cy5.5。
1.3.2 Gyp定量分析方法的建立[12] Gyp对照品和空白脂质体用5%香草醛冰醋酸溶液—高氯酸(2∶8)混合液显色,在400~1 100 nm处进行光谱扫描,得到最大吸收波长为555 nm,且该处空白脂质体无干扰,故选择测定波长为555 nm。然后建立定量分析Gyp的标准曲线,即精密称取Gyp对照品,加水配置成质量浓度为0.05 mg/mL、0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL的系列对照品溶液。分别取对照品溶液1 mL置于15 mL具塞试管中,精密加入混合液2 mL,摇匀,密塞,置60℃水浴中加热15 min,取出,立即放入冰水中冷却2 min,精密加入冰醋酸10 mL,摇匀,以试剂作空白,分光光度法于(555±5)nm波长处测定吸光度(A)值。以A值为纵坐标,质量浓度(C)为横坐标,绘制标准曲线。
1.3.3包封率测定 采用鱼精蛋白沉淀法进行测定。吸取2 mL SYL3C-Gyp@Lipo,添加0.5 mL鱼精蛋白(10 mg/mL)混匀,接着加入3 mL生理盐水并静置5 min,然后离心30 min(3 000 r/min)。收集沉淀,加入10%曲拉通-X100溶解,用生理盐水定容,然后取溶液测定Gyp含量,即得到包封的药物量。
1.3.4载药脂质体的表征 使用Zetasizer分析仪(Nano S)动态光散射法(Dynamic light scattering,DLS)对样品粒径和电位大小进行测量;通过透射电子显微镜H-7650观察拍摄样品的形态。
1.3.5释放度考察 使用离心方法进行体外药物释放实验,即将10 mg SYL3C-Gyp@Lipo在37℃下溶于10 mL pH 5.4或pH 7.4的PBS缓冲液中,以100 r/min摇动。在预定的时间间隔,将样品以5 000 r/min离心10 min,收集上清,通过前述分光光度法测定上清液中的Gyp含量,计算释放率。
1.3.6靶向性检测 为研究载药脂质体与HepG2细胞的靶向结合能力,采用流式细胞仪进行检测。取对数生长期的HepG2和HL-7702细胞(人肝正常细胞),用50μL PBS重悬细胞。加入45μL PBS、10μL胎牛血清(FBS)和各组材料(Gyp@Lipo-Cy5.5和SYL3C-Gyp@Lipo-Cy5.5,浓度为500μg/mL)混匀,加入细胞混悬液,混匀,于4℃下避光孵育30 min,然后PBS洗涤细胞,1 000 r/min离心5 min。重复洗涤细胞3次并重悬,流式细胞术检测荧光脂质体与细胞的结合率。
1.3.7药物传递系统对肿瘤细胞的杀伤性考察
使用MTT法测定药物体外细胞毒性。每组设6个复孔,取对数生长期的HepG2和HL-7702细胞,接种于96孔板内,细胞数控制在1.5×104个/孔。随后加入药物与细胞共培养,根据加入药物不同,设置分组为:Gyp组(加入Gyp)、Gyp@Lipo组(加入Gyp@Lipo脂质体)、SYL3C-Gyp@Lipo组(加入SYL3C-Gyp@Lipo脂质体);每组设置不同给药浓度(脂质体中Gyp含量浓度),设置4个给药浓度为:100 µg/mL、300 µg/mL、600 µg/mL、900 µg/mL。分组给药后,将细胞在5% CO2、37℃培养箱中培养24 h。孵育结束后,每孔细胞分别加入20μL MTT,置于37℃、5%CO2的培养箱中30 min;1 500 r/min离心10 min,弃去上清,每孔加入200μL DMSO,避光振荡10 min,之后用全自动酶标仪检测570 nm波长处的OD值。为了进一步验证脂质体的靶向杀伤性能,本研究设计了封闭实验,设置SYL3C封闭组,即先将HepG2细胞与过量Apt SYL3C先孵育2 h,PBS洗涤后再加入SYL3C-Gyp@Lipo进行共培养24 h;还设置分组:Free SYL3C组,即单纯Apt SYL3C与细胞共孵育24 h;SYL3C-Gyp@Lipo组,即脂质体SYL3C-Gyp@Lipo与细胞共孵育24 h。孵育结束后各组按前述步骤进行细胞毒性检测。
1.4统计学方法 采用SPSS 22.0软件对实验数据进行统计分析。计量资料用均数±标准差()表示,组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1靶向载药脂质体的表征
通过分光光度法建立Gyp定量分析的标准曲线,以吸光度(A)值为纵坐标,质量浓度(C)为横坐标,进行线性回归,得回归方程A=0.317 9 C+0.088 49,r=0.993 4,由此可计算出载药脂质体的Gyp包封率为63.87%。
通过TEM(图1A)可以看到,制备的载药纳米粒子SYL3C-Gyp@Lipo分散性良好,大小均匀,呈现圆球形或椭圆球形,同时可以观察到脂质体的双层膜。表明载药纳米脂质体制备成功。各组纳米粒子的电位分布和粒径分布见图1B和图1C:空白脂质体Lipo的平均水化粒径为121.23 nm,在包裹Gyp药物和修饰SYL3C Apt后,平均粒径分别增大至128.24 nm与133.28 nm。空白脂质体表面电荷为+(12.87±1.24)mV,包裹药物后降为+(7.53±1.29)mV;SYL3CApt为带负电的DNA,故修饰后脂质体表面电位进一步降至-(10.15±1.35)mV,这也说明Apt修饰成功。
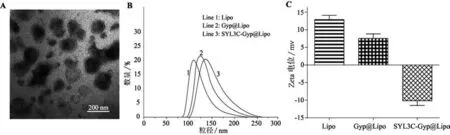
图1 载药脂质体的表征
2.2靶向载药脂质体的体外药物释放率
在pH为7.4时,SYL3C-Gyp@Lipo载药脂质体释放缓慢,96 h内释放药物不超过80%,说明与游离药物相比,脂质体制剂呈现出一定的缓释作用;而为了模拟载药脂质体进入肿瘤微酸环境的释放,研究设计了在pH为5.4时观察载药脂质体的释放情况,可以看到,在pH 5.4的酸性环境下,SYL3CGyp@Lipo释药速度较快,48 h释放率就已超过80%,而经过96 h释放率超过90%,见图2。
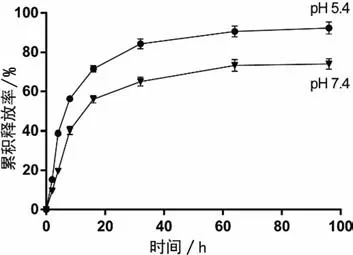
图2 SYL3C-Gyp@Lipo在不同pH值(pH 7.4、pH 5.4)环境96 h内药物累积释放曲线图
2.3靶向载药脂质体的体外靶向实验
为了确定靶向载药脂质体的体外肿瘤靶向能力,使用流式细胞术分析比较SYL3C-Gyp@Lipo的细胞结合效率(图3)。结果可以看到非靶细胞HL-7702对SYL3C-Gyp@Lipo没有特异性结合(图3B),而靶细胞HepG2细胞与SYL3C-Gyp@Lipo的结合率明显较高(图3A)。

图3 流式细胞术检测载药脂质体SYL3C-Gyp@Lipo的体外靶向性能
2.4靶向载药脂质体对肿瘤细胞的体外杀伤性
当脂质体与HL-7702细胞共孵育时(图4A),在相同Gyp药物浓度下,SYL3C-Gyp@Lip组与Gyp@Lipo组的细胞活力无明显差异(P>0.05);然而与HepG2细胞共孵育(图4B),当Gyp含量浓度大于300μg/mL,SYL3C-Gyp@Lipo比Gyp@Lipo具有更明显的细胞杀伤能力(P<0.05),且呈剂量依赖性,但是其毒性也略低于游离Gyp(P<0.05)。通过靶向脂质体SYL3C-Gyp@Lipo对不同细胞的杀伤效果差异进行比较(图4C),结果显示当给药浓度Gyp含量大于300μg/mL,SYL3C-Gyp@Lipo对HepG2细胞的杀伤能力强于HL-7702细胞(P<0.05)。

图4 靶向载药脂质体的体外细胞毒性
为了进一步验证脂质体的靶向杀伤性能,本研究设计了封闭实验,从结果中可以看出(图5),游离Apt SYL3C对HepG2细胞活力几乎无影响,细胞活力保持在90%左右;而封闭组和SYL3C-Gyp@Lipo组对细胞均有抑制作用,但SYL3C-Gyp@Lipo组对细胞的杀伤效果更好,该组细胞活力更低(P<0.05)。

图5 载药脂质体的特异靶向杀伤肿瘤细胞功能验证
3 讨论
Gyp通过多靶点多途径发挥抗癌功效,但是经口服用途径很容易被降解,因此需要大剂量或频繁给药。而将Gyp制备成载药脂质体后,在胃肠道中能够受到保护,避免被快速代谢,可减少每次给药剂量;另外脂质体还有缓释功能,能减少给药频率。但是Gyp脂质体制剂的靶向性、药物传递效率有待提高。因此本研究选用能特异性靶向肿瘤标志物的Apt SYL3C,用Apt修饰Gyp脂质体(Gyp@Li-po),构建一个可保护药物且具有缓释功能的靶向药物传递系统(SYL3C-Gyp@Lipo)。
本研究通过薄膜分散法制备的脂质体,制备过程中添加了PEG2000,PEG2000不仅增加了纳米脂质体在体内的循环时间,而且由于PEG层的存在,可在脂质体膜内、外形成空间位阻,从而阻碍水分子及药物分子跨膜流动[13],不仅起到保护药物作用,避免其在胃肠道快速降解,还使得载药脂质体在96 h内呈现出一定地缓释作用,延长了药物在体内的循环时间及药物在肿瘤局部的暴露时间。肿瘤细胞内为微酸性环境,所以本研究探索了pH为5.4的酸性环境下药物的释放情况,结果显示48 h释放率80%以上,96 h释放了90%以上。在酸性环境下药物的快速释放,可能是因为酸性环境下脂质体结构的裂解而造成的。已经进入细胞的脂质体裂解释放的大量药物,可以迅速发挥作用,抑制细胞的增殖,增强了对细胞的杀伤作用。
上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)可作为多种肿瘤的诊断标志和治疗靶标,在本研究中,靶向EpCAM的SYL3C Apt的修饰赋予了纳米脂质体的肿瘤识别性能,增强了药物的主动靶向传递。对比表达EpCAM的肝癌细胞HepG2和不表达EpCAM的正常肝细胞HL-7702,由于SYL3C Apt的修饰,增强了肿瘤细胞对SYL3CGyp@Lipo的识别,因此HepG2对载药脂质体SYL3C-Gyp@Lipo的摄取更多;MTT实验也提示SYL3C-Gyp@Lipo能特异性杀伤HepG2肿瘤细胞。为进一步证实脂质体的靶向杀伤性能,用Apt YL3C封闭结合位点后再与SYL3C-Gyp@Lipo共培养,载药脂质体的细胞杀伤性能明显降低,也再次表明SYL3C-Gyp@Lipo对肿瘤细胞的主动靶向杀伤性能,使得SYL3C-Gyp@Lipo特异性地作用于肿瘤细胞,减少对正常细胞的毒副作用。而且,由于EpCAM在多种肿瘤细胞表达,在理论上SYL3CGyp@Lipo也能够靶向其他的肿瘤细胞,起到广泛的肿瘤特异性杀伤作用。
本研究制备了一个具有高效载药的Apt功能化的Gyp靶向脂质体纳米药物传递系统。这个系统由于Apt能够特异性的识别并结合肿瘤特异位点,以及由于脂质体对药物的缓释等优良性能,使得纳米药物传递系统能够富集肿瘤部位并对其持续杀伤。此外,通过选择合适的不同的Apt,理论上它可以靶向任何类型的肿瘤细胞,对肿瘤的靶向治疗具有巨大潜力。因此,也为绞股蓝乃至中药制剂的研究和应用提供了新思路。
