基于转录组测序分析并验证与肝癌预后相关的miRNA*
2022-04-28黄诗萍廖舟翔莫婉灵李辉杨丽超黄雪静何敏
黄诗萍,廖舟翔,莫婉灵,李辉,杨丽超,黄雪静,何敏,△
(广西医科大学 1.公共卫生学院;2.实验动物中心,南宁 530021)
微小RNA(microRNA,miRNA)是一种长度为22~24个核苷酸的非编码小RNA,可在转录后水平调控基因表达。胞外的miRNAs主要存在于外泌体中或与蛋白质结合形成复合体,避免了核酸酶的降解,因此在血液或组织中能够特异、稳定地检测到miRNAs,使其有望成为理想的恶性肿瘤生物标志物[1-3]。
肝癌(hepatocellular carcinoma,HCC)中普遍存在异常表达的miRNAs,参与调控细胞增殖、凋亡、侵袭和转移等生物学过程[4]。而HCC细胞侵袭和转移的特性是影响HCC患者术后复发、导致不良预后的重要因素。越来越多研究证明,miRNA表达水平与HCC患者的临床病理特征相关,有望作为HCC预后的生物标志物[5-8]。但目前对于miRNA的研究仍处于探索阶段,许多与HCC相关的miRNA尚未得到充分验证[9]。
本次研究采用转录组RNA测序技术和生物信息学分析方法,筛选出差异表达的miRNAs,RT-qPCR验证miR-429表达水平,利用数据库和文献分析miR-429与HCC患者预后的关系,为HCC预后监测提供新的参考依据。
1 材料与方法
1.1 材料
人正常肝细胞HL7702和HCC细胞株Huh7、HepG2、Hep3B均购自中国科学院细胞库(上海);DMEM培养基、MEM培养基和胎牛血清均购自美国Gibco公司;RNA提取试剂TrizolTM Reagent购自美国Invitrogen公司;逆转录试剂miRNA第一链cDNA合成(加尾法)购自上海生工公司;ChamQ Universal SYBR qPCR Master Mix购自南京诺唯赞生物科技有限公司;引物合成由上海生工公司完成。
1.2 方法
1.2.1转录组RNA测序HL7702、Huh7、HepG2、Hep3B 4种细胞总RNA抽提、质检和文库构建由深圳华大基因完成。使用DNBSEQ平台进行样本测序,对测序的原始数据中低质量、接头污染以及未知碱基N含量过高的reads进行过滤以保证结果的可靠性。得到clean reads之后,使用HISAT和Bowtie2进行人类参考基因组序列比对,得到转录本,计算后获得基因表达量。
1.2.2差异表达基因的通路分析 采用DIANATOOLS数据库中的miRPath V.3(http://www.microrna.gr/miRPathv3)对差异表达基因进行京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析。使用KEGG进行信号通路分类注释,以P<0.05且FDR<0.05为差异具有统计学意义。以P<0.05为阈值进行筛选并进行可视化。火山图和层次聚类分析热图分别用R语言(4.4.1版)的ggplot2和pheatmap包制作。
1.2.3生存分析用Kaplan-Meier plotter(http://kmplot.com/analysis/)数据库对筛选出来的miRNAs做生存分析。
1.2.4实时荧光定量PCR(RT-qPCR)验证miRNA
用TrizolTM Reagent提取正常肝细胞(HL7702)和HCC细胞(Huh7、HepG2、Hep3B)的总RNA,用miRNA第一链cDNA合成(加尾法)试剂进行逆转录,反应条件:37℃,60 min;85℃,5 min;4℃,30 min。PCR的反应参数如下:预变性95℃,30 s;变性95℃,10 s,退火和延伸60℃,30 s(40个循环)。以U6为内 参,用2-ΔΔCT法计算miR-429的相对表达量。miR-429上游引物序列为:5’-TAATACTGTCTGGTAAAACCGT-3’,U6上游引物以及下游通用引物来自miRNA第一链cDNA合成(加尾法)试剂盒。
1.2.5文献分析miR-429对PubMed、PHMC健康与医学大全期刊全文库、中国生物医学文献服务系统、中国知网和万方数据库进行检索,收集国内外从建库至2021年12月期间的文献,中文检索词有“肝癌”与“miR-429”,英文检索词有“hepatocellular carcinoma”或“liver cancer”与“miR-429”或“miRNA-429”或“microRNA-429”或“miR-429”。文献纳入标准:(1)根据病理标准诊断的HCC病例对照、横断面或队列研究;(2)研究中有具体样本例数、miR-429的表达水平和miR-429与HCC预后关系的分析结果,有明确的分组信息。排除标准:符合以下任一标准则排除相关文献或研究,(1)动物实验、细胞实验、综述、病例报告、会议摘要、信函;(2)研究中缺乏明确的分组、样本例数少于10例;(3)数据不完整或无法提取的研究。信息提取内容包括作者、发表时间、国籍、样本类型、样本量、影响miR-429表达的相关因素及与HCC患者预后相关的危险因素等研究内容。
1.3 统计学方法
采用SPSS 20.0软件对数据进行分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,进一步组间两两比较采用SNK-q检验,方差不齐时用Dunnett’s T3检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 筛选差异表达miRNAs
将正常肝细胞HL7702和HCC细胞株Huh7、HepG2、Hep3B进行全转录组测序,以HL7702为对照,两两比较分析测序结果显示,与HL7702相比,miRNAs分别在Huh7细胞中有178个上调,159个下调,HepG2细胞有188个上调,163个下调,Hep3B细胞有202个上调,177个下调(图1A~1C)。柱状图分别对应在Huh7、HepG2和Hep3B中表达上调和下调的miRNA个数,以及在3种HCC细胞中共同上调和下调的miRNA个数,在3种HCC细胞中共同上调的有39个,共同下调的有61个(图1D)。进一步对HCC细胞中差异表达的这100个miRNAs进行层次聚类分析,可以直观地看出在正常肝细胞和HCC细胞之间存在表达差异的miRNAs(图1E)。
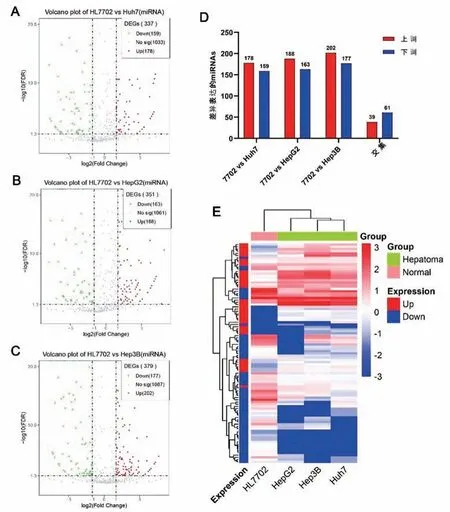
图1 筛选正常肝细胞和HCC细胞间差异表达miRNAs
2.2 差异表达miRNAs的KEGG通路富集分析
将筛选出的100个差异表达miRNAs,放入DIANA TOOLS中的miRPath V.3进行KEGG通路 富集分析发现,差异表达miRNAs主要富集在多糖降解、癌症中的蛋白聚糖、ErbB信号通路、黏着连接、调节干细胞多能性的信号通路、糖鞘脂生物合成—乳脂和新乳脂系列等信号通路。其中miR-429能够在4条信号通路中被富集到,见表1和图2。

表1 差异表达miRNAs的KEGG通路富集结果
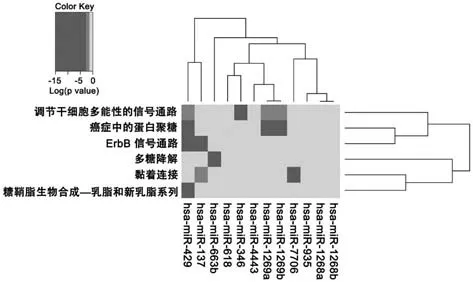
图2 差异表达miRNAs的KEGG通路富集热图
2.3 HCC患者中miR-429的生存分析
从KEGG信号通路富集结果来看,miR-429可富集到多条信号通路,因此选择其进一步分析。用Kaplan-Meier plotter数据库对其进行生存分析,发现miR-429表达高的HCC患者总体生存期较表达低者短(HR=1.63,95%CI:1.14~2.31,P=0.006 2),提示miR-429高表达是HCC患者生存时间的危险因素,见图3。

图3 miR-429的生存分析
2.4 miR-429表达水平的RT-qPCR实验验证
转录组RNA测序结果显示miR-429在Huh7、HepG2和Hep3B表达升高(图4A),采用RT-qPCR验证miR-429在4种细胞中的表达情况,结果显示,与正常肝细胞HL7702比较,miR-429在Huh7、HepG2和Hep3B细胞中的表达均升高(P<0.05),与RNA测序结果一致,见图4B。

图4 miR-429的表达水平分析
2.5 文献分析miR-429
根据文献检索策略,共检出文献46篇,删除重复文献后,阅读标题和摘要进行初筛,进一步仔细阅读全文,最终选择3篇文献进行分析[10-12]。文献筛选过程见图5A。三项研究显示miR-429在HCC组织和HCC细胞中高表达,并且高miR-429表达与HCC的不良预后相关,HCC患者中miR-429越高,无复发(无病)生存期和总体生存期越短。Huang等[10]和Li等[11]的研究中通过多因素分析发现,miR-429是HCC患者生存时间的危险因素。见表2、图5B。

表2 纳入文献的信息

图5 文献分析miR-429
3 讨论
本研究通过对差异表达的miRNAs进行KEGG通路富集分析,发现了差异表达的miRNAs主要富集在多糖降解,癌症中的蛋白聚糖,ErbB信号通路,黏着连接,调节干细胞多能性的信号通路,糖鞘脂生物合成—乳脂和新乳脂系列等信号通路。其中ErbB属于表皮生长因子受体家族(epidermal growth factor receptor family),是一类能够参与恶性肿瘤发生发展的重要蛋白。ErbB受体家族受体的激活(通过同源或异二聚体)触发两条主要的下游通路,PI3K/AKT和MAPK信号通路[13]。Wang等[14]的研究表明ErbB3通过C端的磷酸化激活位点,可与PI3K结合,从而激活PI3K/AKT信号通路,促进了膀胱癌的增殖和上皮间充质转化过程。Li等[15]的研究发现ErbB2可以激活PI3K/AKT和MAPK/ERK信号通路,促进宫颈癌细胞的增殖。
本研究发现miR-429出现在多条富集的信号通路上,可能是一个重要的与HCC相关的miRNA。就目前的报道看,miR-429一方面在肾癌、乳腺癌、胃癌、胶质瘤、食管癌、口腔鳞状细胞癌、鼻咽癌、胰腺癌等癌症中充当抑癌基因,另一方面在前列腺癌、子宫内膜癌、肺癌中充当促癌基因,而在HCC、结直肠癌、膀胱癌和卵巢癌中的角色则是矛盾的[9]。聚焦在HCC相关研究时,可以发现miR-429有两种不同的异常表达模式:(1)miR-429在HCC组织和HCC细胞中低表达,可以通过直接结合靶基因或被lncRNA负调控,影响HCC细胞的增殖、凋亡和上皮间质转化等过程[16-18],或者与靶基因结合后再调控Raf/MEK/ERK-EMT、NF-κB等信号通路,影响HCC细胞的迁移、侵袭等生物学行为[19-20],但与HCC的预后关系不明;(2)miR-429在HCC组织和HCC细胞中高表达,miR-429可以促进HCC细胞增殖、抑制凋亡[10],通过靶向RBBP4/E2F1/OCT4轴调控肝脏肿瘤形成细胞[11],还可以靶向结合PTEN基因,导致PI3K/AKT信号通路激活,介导HCC细胞的转移[12]。这三项研究报道了miR-429的表达水平和肿瘤大小或数量、微血管浸润、肿瘤分期等临床病理特征相关,还和黄曲霉毒素暴露、乙型肝炎e抗原阳性存在相关性;学者们通过Kaplan-Meier分析发现miR-429过表达和HCC患者无复发(无病)生存率和总体生存率越低呈显著相关,多个研究的多因素分析结果还表明了miR-429是HCC患者生存时间的危险因素[10-12]。本研究的转录组RNA测序和RT-qPCR结果显示miR-429在3种HCC细胞中高表达,这和Li等[11]所报道的表达趋势基本一致。通过数据库分析和文献分析发现了miR-429表达高的HCC患者生存期较表达低者短。这些证据提示了miR-429可以调控HCC的发生发展和影响HCC患者预后,其可能是一个潜在的肿瘤治疗靶点或预后监测指标,但需要多中心的临床数据进一步验证。
