外周血炎症细胞比值对Ⅱ、Ⅲ期可切除直肠癌术后同步放化疗患者急性不良反应和预后的影响*
2022-04-28方兴中杨建美梁海燕
方兴中,杨建美,梁海燕
(甘肃省兰州市第一人民医院,甘肃兰州 730050)
我国结直肠癌发生率在3.1/10 万~10.7/10 万,其中70%左右为直肠癌[1-2]。直肠癌症状隐匿,多数患者就诊时已发展至Ⅱ、Ⅲ期,根治术仍是目前彻底治愈Ⅱ、Ⅲ期直肠癌的首选方案,美国国家综合癌症网指南[3]推荐根治术+术后放化疗作为Ⅱ、Ⅲ期可切除直肠癌的首选方案。虽然该方案可提高Ⅱ、Ⅲ期可切除直肠癌患者抗肿瘤疗效,但患者复发转移风险依旧较高,且部分患者放化疗急性不良反应较严重,可能中断术后放化疗方案,影响其生存状况[4]。因此分析Ⅱ、Ⅲ期可切除直肠癌患者放化疗急性不良反应情况及预后不良的发生风险,提前开展预防或对症治疗对改善患者预后意义重大。
炎症反应在恶性肿瘤发生、发展中具有重要作用,恶性肿瘤患者不仅局部组织出现炎症,而且外周血细胞数及总白蛋白等全身炎症指标也发生改变[5-6]。中性粒细胞与淋巴细胞比值(neutrophil/lymphocyte ratio, NLR)、血小板与淋巴细胞比值(platelet/lymphocyte ratio, PLR)、中性粒细胞与白蛋白比值(neutrophil/albumin ratio, NAR)是实验室检查中方便、快捷的外周血炎症细胞指标。目前国内外有研究发现NLR、PLR、NAR 与直肠癌患者预后关系密切[7-9],但是缺乏NLR、PLR、NAR 对Ⅱ、Ⅲ期可切除直肠癌术后同步放化疗患者急性不良反应和预后影响的报道。本研究分析81 例Ⅱ、Ⅲ期可切除直肠癌患者的临床资料,探讨能早期预测术后同步放化疗急性不良反应及预后的高效、安全的生物化学指标。
1 资料与方法
1.1 一般资料
选取2014年11月—2016年11月甘肃省兰州市第一人民医院收治的Ⅱ、Ⅲ期可切除直肠癌患者81 例作为研究对象。其中男性49 例,女性32 例,年龄18~65 岁,平均(49.83±7.14)岁。本研究经医院伦理委员会审批通过,患者均自愿签署知情同意书。
1.2 纳入、排除及剔除标准
1.2.1 纳入标准①符合《中国早期结直肠癌筛查及内镜诊治指南(2014,北京)》[10]诊断标准;②年龄>18 岁、治疗前活检为腺癌;③预计生存期>6 个月;④接受R0 全直肠系膜切除术联合放化疗;⑤卡氏(Kamofsky, KPS)功能状态评分>70 分;⑥临床分期Ⅱ、Ⅲ期;⑦首次进行抗肿瘤治疗。
1.2.2 排除标准①伴有精神疾病、神经系统疾病者;②伴有血液系统疾病者;③伴有局部感染、全身感染、严重心脑血管疾病者;④伴有免疫缺陷或重要脏器功能障碍者;⑤合并其他部位肿瘤者;⑥既往有药物滥用史、合并其他抗肿瘤治疗者;⑦妊娠及哺乳期女性;⑧合并肠穿孔、肠梗阻、腹部手术史者;⑨治疗期间死亡者。
1.2.3 剔除标准①自然失访者;②依从性差者;③自行终止治疗者。
1.3 方法
1.3.1 放化疗方案患者R0 全直肠系膜切除术后,参照文献[11]进行放化疗,盆腔三维适形放疗剂量为45.0~50.4 Gy,共25~28 次,1.8~2.0 Gy/次。首先利用团注造影剂CT 扫描模拟定位,层厚5 mm,层距5 mm,扫描范围为盆腔及下腹部,数据传输至Eclipes 治疗计划系统,在扫描图像上勾画体表轮廓、肿瘤区、临床靶区、计划靶区及膀胱等重要组织器官。临床靶体积包括原发肿瘤高危复发区域(直肠癌术后瘤床、直肠周围系膜、骶前、坐骨直肠窝)和区域淋巴引流区(髂总血管淋巴引流区、直肠系膜区、髂内血管淋巴引流区、闭孔淋巴引流区)。计划靶区为临床靶区各方向均匀外扩0.5 cm,以有效保护盆腔正常组织器官。同步放疗口服卡培他滨825 mg/m2,2 次/d,每周5 d。参照美国国立肿瘤研究所制定的常见不良反应事件评价标准4.0(CTCAE)[12]评价患者急性不良反应。
1.3.2 随访所有患者术后以门诊复查、电话等方式随访,中位随访时间5年(放化疗期间每周门诊随访1 次,直至放化疗治疗结束),放化疗结束后前2年,每3 个月复查1 次;第3年起,每6 个月复查1 次;每年进行1 次结直肠镜检查。统计随访期间无病生存、总生存状况,出现癌因死亡者则终止随访。
1.3.3 资料收集收集可能影响患者放化疗急性不良反应及预后的资料,包括性别、年龄、体质量指数(body mass index, BMI)、吸烟史、饮酒史、基础疾病,肿瘤最大直径、病理分期、KPS 评分、距肛门距离、分化程度、肿瘤位置、浸润深度、手术方案、术后化疗方案、外周血炎症细胞比值等。
1.3.4 外周血炎症细胞比值的检测所有患者于R0全直肠系膜切除术后、辅助放化疗前2周采集空腹静脉血,使用全自动血细胞分析仪(日本SYSMEX 公司XN系列)检测血常规,计算NLR、PLR、NAR。
1.3.4 外化疗急性不良反应分级①白细胞:白细胞≥3.0×109/L 为<2 级,白细胞<3.0×109/L 为≥2 级。②腹泻:无、腹泻时间<2 d为<2级。能耐受,腹泻时间>2 d;不能耐受,需治疗;血性腹泻为≥2级。③放射性皮炎:正常或红斑为<2 级。干性脱皮,水泡、瘙痒;湿性脱皮、溃疡;剥脱性皮炎,需手术处理坏死组织为≥2级。
1.4 统计学方法
数据分析采用SPSS 18.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线;影响因素的分析采用单因素和多因素Cox 比例风险回归模型;用Kaplan-Meier 法绘制生存曲线,比较用Log-rank χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 同步放化疗急性不良反应分级患者外周血NLR、PLR、NAR比较
白细胞<2 级组与≥2 级组患者外周血NLR 比较,经t检验,差异无统计学意义(P>0.05)。两组患者外周血PLR、NAR 比较,差异有统计学意义(P<0.05),白细胞<2 级组低于≥2 级组。见表1。
表1 白细胞减少患者外周血NLR、PLR、NAR比较(±s)
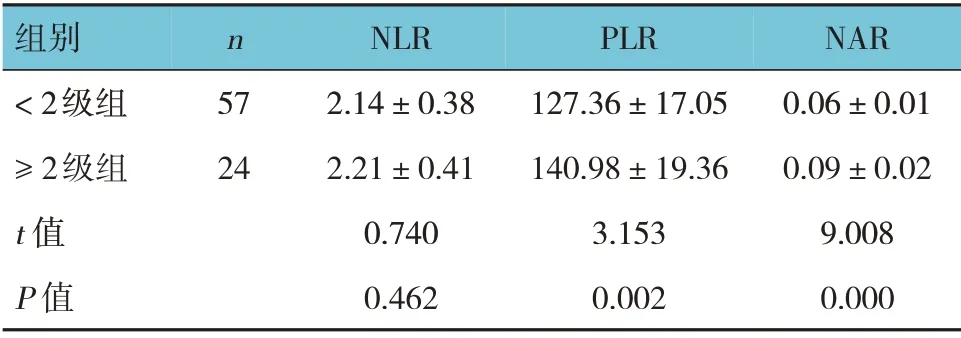
表1 白细胞减少患者外周血NLR、PLR、NAR比较(±s)
组别<2级组≥2级组t 值P 值n 57 24 NLR 2.14±0.38 2.21±0.41 0.740 0.462 PLR 127.36±17.05 140.98±19.36 3.153 0.002 NAR 0.06±0.01 0.09±0.02 9.008 0.000
腹泻<2 级组与≥2 级组患者外周血NLR、PLR比较,经t检验,差异无统计学意义(P>0.05)。两组患者外周血NAR 比较,差异有统计学意义(P<0.05),腹泻<2 级组低于≥2 级组。见表2。
表2 腹泻患者外周血NLR、PLR、NAR比较 (±s)
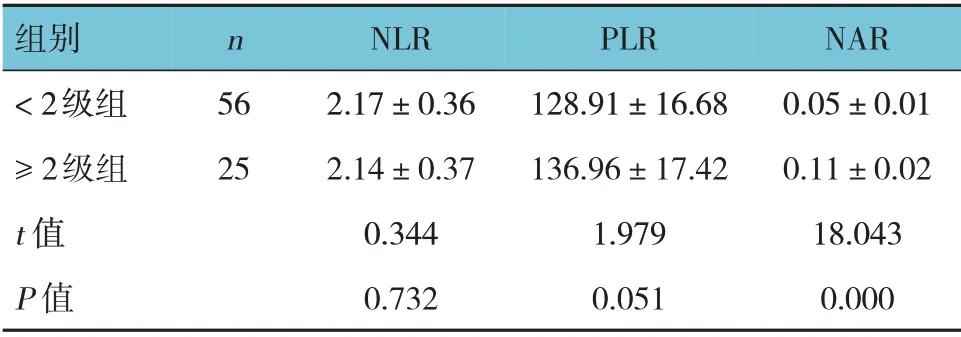
表2 腹泻患者外周血NLR、PLR、NAR比较 (±s)
组别<2级组≥2级组t 值P 值n 56 25 NLR 2.17±0.36 2.14±0.37 0.344 0.732 PLR 128.91±16.68 136.96±17.42 1.979 0.051 NAR 0.05±0.01 0.11±0.02 18.043 0.000
放射性皮炎<2 级组与≥2 级组患者外周血NLR、PLR 比较,经t检验,差异无统计学意义(P>0.05)。两组患者外周血NAR 比较,差异有统计学意义(P<0.05),放射性皮炎<2 级组低于≥2 级组。见表3。
表3 放射性皮炎患者外周血NLR、PLR、NAR比较(±s)
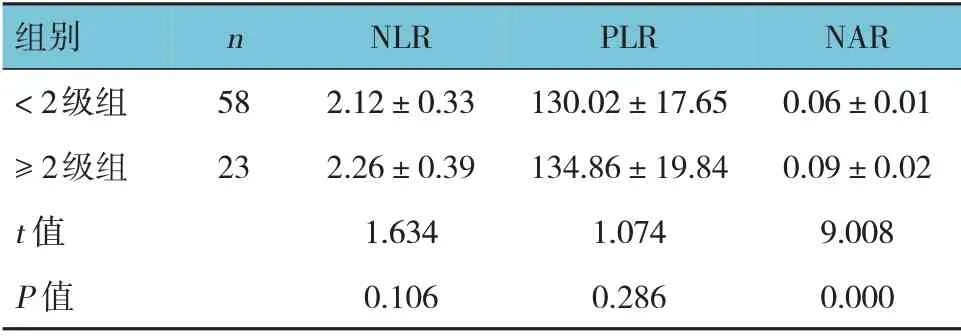
表3 放射性皮炎患者外周血NLR、PLR、NAR比较(±s)
组别<2级组≥2级组t 值P 值n 58 23 NLR 2.12±0.33 2.26±0.39 1.634 0.106 PLR 130.02±17.65 134.86±19.84 1.074 0.286 NAR 0.06±0.01 0.09±0.02 9.008 0.000
2.2 影响Ⅱ、Ⅲ期可切除直肠癌患者预后的因素
81 例患者中失访10 例,剩余71 例患者中46 例(64.79%)无病生存,52 例(73.24%)生存。
单因素Cox 比例风险回归分析结果显示,病理分期、分化程度、淋巴结转移、NLR、PLR、NAR 是直肠癌患者复发转移的危险因素(P<0.05)。见表4。
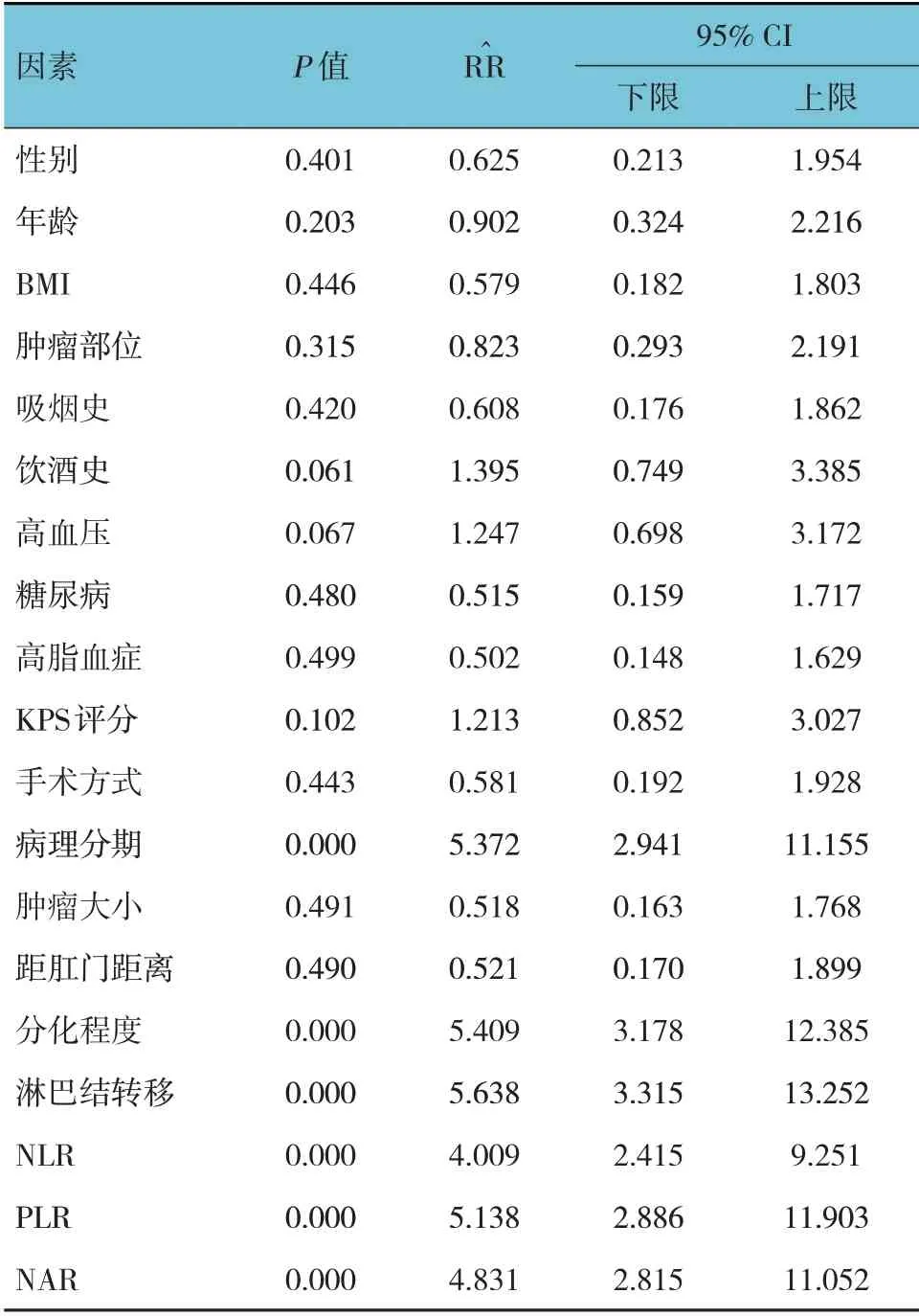
表4 直肠癌患者复发转移因素的单因素Cox比例风险回归分析参数
以患者是否出现复发转移为因变量(否=0,是=1),病理分期、分化程度、淋巴结转移、NLR、PLR、NAR为自变量(自变量赋值为原始数值),引入水准是0.05,剔除水准是0.10,进行逐步多因素Cox 比例风险回归分析。结果显示:病理分期[=6.044(95%CI:2.657,13.748)]、分化程度[=5.557(95% CI:2.443,12.640)]、淋巴结转移[=4.540(95% CI:1.996,10.328)]及NAR[=4.047(95% CI:1.779,9.206)]是直肠癌患者复发转移的独立危险因素(P<0.05)。见表5。
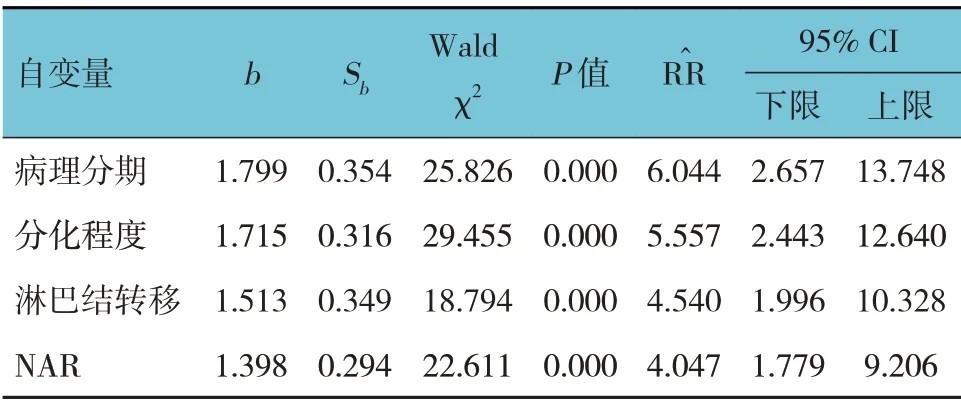
表5 直肠癌患者复发转移因素的逐步多因素Cox比例风险回归分析参数
单因素Cox 比例风险回归分析结果显示,病理分期、分化程度、淋巴结转移、NLR、PLR、NAR 是直肠癌患者死亡的危险因素(P<0.05),见表6。
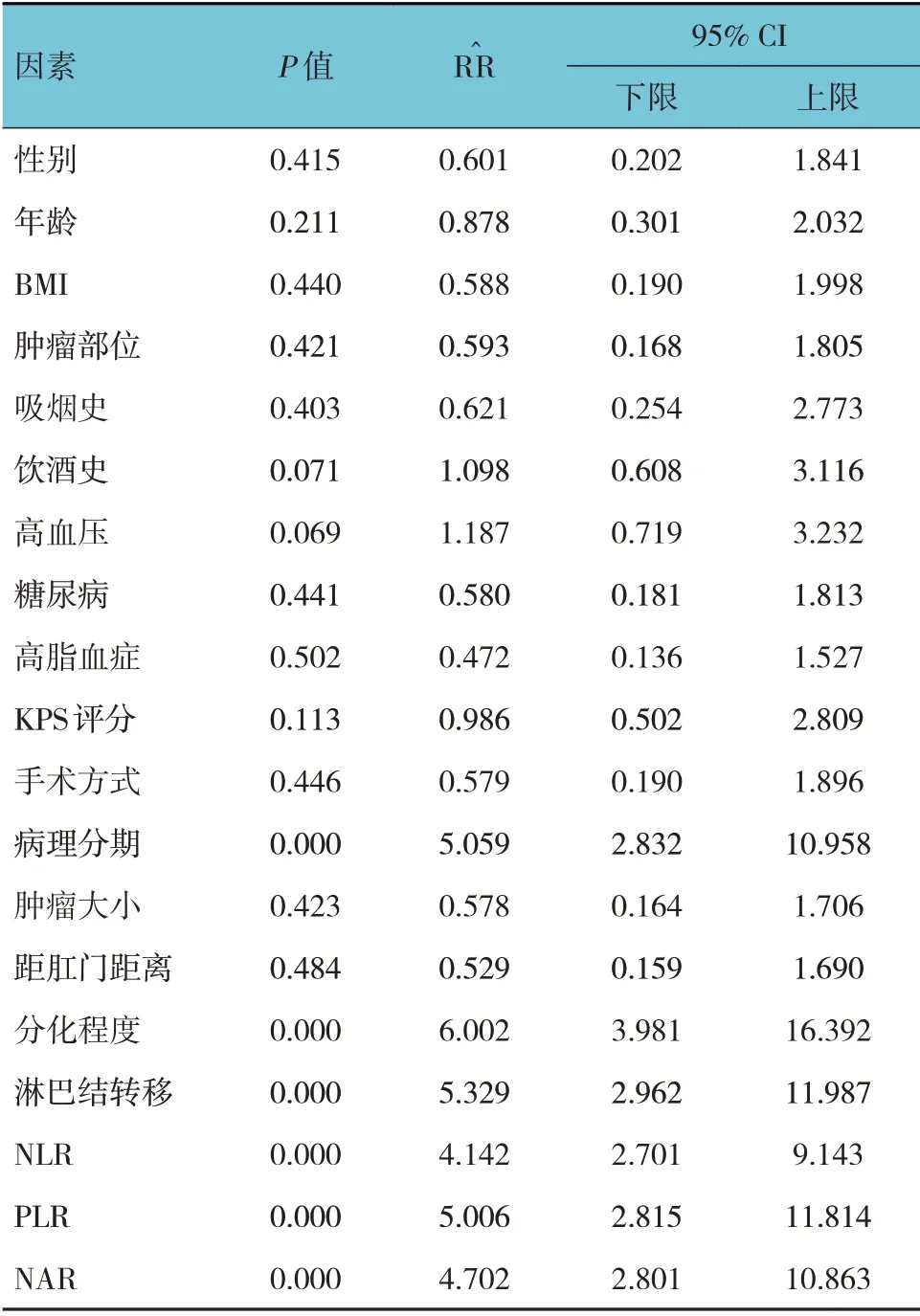
表6 直肠癌患者死亡因素的单因素Cox比例风险回归分析参数
以患者是否生存为因变量(是=0,否=1),病理分期、分化程度、淋巴结转移、NLR、PLR、NAR 为自变量(自变量赋值为原始数值),引入水准是0.05,剔除水准是0.10,进行逐步多因素Cox 比例风险回归分析。结果显示:病理分期[=3.850(95% CI:1.692,8.757)]、分化程度[=3.785(95% CI:1.664,8.610)]及NAR [=3.857(95% CI:1.696,8.775)]是直肠癌患者死亡的独立危险因素(P<0.05)。见表7。
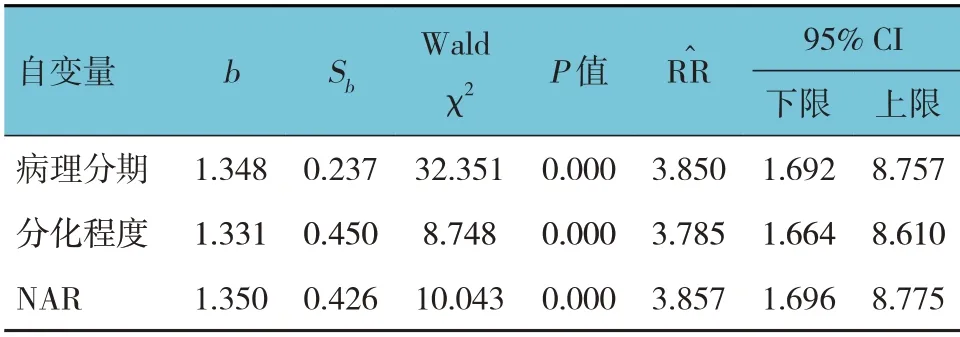
表7 直肠癌患者死亡因素的多因素Cox比例风险回归分析参数
2.3 外周血NAR预测直肠癌患者预后的价值
ROC 曲线结果显示,外周血NAR 最佳截断值为0.05 时,预测Ⅱ、Ⅲ期可切除直肠癌患者无病生存的敏感性为76.09%(95% CI:0.609,0.869),特异性为72.00%(95% CI:0.504,0.871),曲线下面积(area under curve, AUC)为0.766(95% CI:0.669,0.862)。见图1。
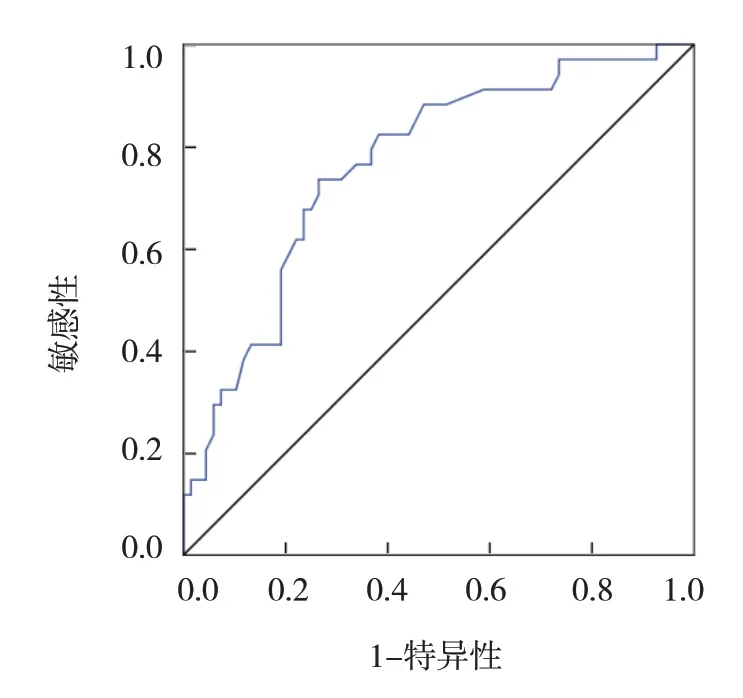
图1 外周血NAR预测直肠癌患者复发转移的ROC曲线
ROC 曲线结果显示,外周血NAR 最佳截断值为0.06 时,预测Ⅱ、Ⅲ期可切除直肠癌患者生存的敏感性为75.00%(95% CI:0.608,0.855),特异性为73.68%(95% CI:0.486,0.899),AUC 为0.730(95%CI:0.627,0.833)。见图2。

图2 外周血NAR预测直肠癌患者死亡的ROC曲线
2.4 外周血NAR水平与患者生存的关系
以外周血NAR 0.05 为界,将NAR≥0.05 患者作为NAR 高水平组,NAR<0.05 患者作为NAR 低水平组。随访结束时,34 例NAR 高水平组患者无病生存17 例,37 例NAR 低水平组患者无病生存29 例,两组患者无病生存曲线比较,差异有统计学意义(χ2=5.400,P=0.020)。见图3。

图3 不同NAR水平直肠癌患者的无病生存期曲线
以外周血NAR 0.06 为界,将NAR≥0.06 患者作为NAR 高水平组,NAR<0.06 患者作为NAR 低水平组。随访结束时,32 例NAR 高水平组患者生存19 例,39 例NAR 低水平组患者生存33 例,两组患者总生存曲线比较,差异有统计学意义(χ2=5.473,P=0.019)。见图4。
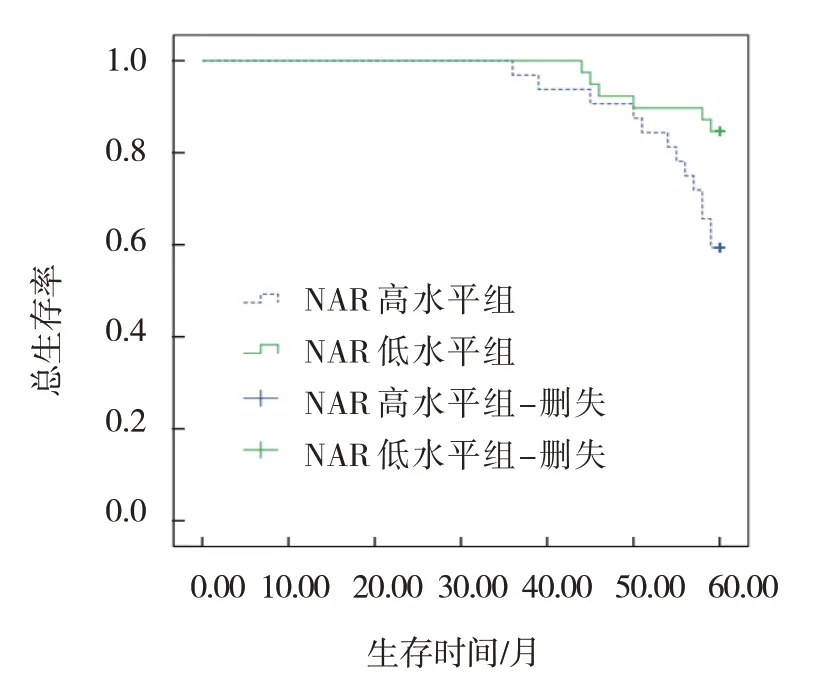
图4 不同NAR水平直肠癌患者的总生存曲线
3 讨论
Ⅱ、Ⅲ期可切除直肠癌术后辅助放化疗可有效降低术后肿瘤复发转移风险,但术后肿瘤远处转移仍是肿瘤患者死亡的主要原因[13]。因此早期有效预测患者预后、尽早开展对症防治对改善预后意义重大。炎症微环境是肿瘤微环境的重要组成部分,在肿瘤微环境中,免疫系统会激活中性粒细胞、淋巴细胞等多种炎症细胞,并在肿瘤细胞增殖、分化、迁徙、转移等病理生理过程中发挥重要作用[14]。国内外研究发现,部分外周血炎症细胞因子可能与恶性肿瘤患者预后有关[7-9]。
中性粒细胞可反映细胞的炎症、感染、损伤情况,作为免疫系统中最丰富的白细胞之一,中性粒细胞通过促血管生成、免疫抑制、肿瘤细胞转移等多种机制在恶性肿瘤进展中发挥作用。MADY 等[15]研究结果表明,多数恶性肿瘤患者存在NLR 升高现象。癌细胞可激活血小板,将其作为抵御血液剪切力和自然杀伤细胞的物理屏障,活化的血小板还可调节造血、免疫细胞向肿瘤部位迁移,导致癌症相关炎症。白蛋白不仅是衡量机体营养状况的有效指标,而且是恶性肿瘤患者全身性炎症反应的标志物之一。本研究结果表明,白细胞<2 级组的PLR、NAR 低于≥2 级组,腹泻<2 级组的NAR 低于≥2 级组,放射性皮炎<2 级组的NAR 低于≥2 级组,说明PLR、NAR 可能与Ⅱ、Ⅲ期可切除直肠癌术后同步放化疗患者急性不良反应有关,尤其NAR 影响可能更明显。笔者推测其作用机制可能与白蛋白降低诱发的毒素吸收及一系列活性因子变化有关[16]。
JEON 等[17]研究指出,NLR 升高可能是预测直肠癌患者病理完全反应的标志物,并且与无病生存期缩短有关。KIM 等[18]研究显示,NLR、PLR 水平升高是直肠癌手术患者病理完全反应不良的预测因素;多因素分析显示NLR 是影响局部晚期直肠癌新辅助放化疗患者预后的独立危险因素,NLR 低表达患者5年生存率更高。TAWFIK 等[19]研究NLR、PLR、NAR 对直肠癌新辅助化疗患者病理完全反应的影响,发现NAR 是患者病理完全反应的独立影响因素。本研究中Cox 比例风险回归分析结果显示,病理分期、分化程度、淋巴结转移及NAR 是直肠癌患者复发转移的独立危险因素;病理分期、分化程度及NAR 是直肠癌患者死亡的独立危险因素,与TAWFIK 等[19]的研究结果类似。ROC 曲线结果表明,外周血NAR 预测直肠癌患者预后效能良好,具有一定临床应用价值。生存曲线结果也印证NAR与Ⅱ、Ⅲ期可切除直肠癌患者预后有关,高水平NAR 可增加术后复发转移风险,减小生存收益。
综上所述,Ⅱ、Ⅲ期可切除直肠癌患者外周血NAR 水平与直肠癌术后同步放化疗急性不良反应及预后有关,NAR 高水平患者发生高级别急性不良反应和预后不良的风险较高。
