EZH2抑制剂对膀胱癌T24细胞上皮间质转化的影响及其机制研究*
2022-04-28陈翔何天基冉俊武王伟姚远周毅石海林
陈翔,何天基,冉俊武,王伟,姚远,周毅,石海林
(柳州市人民医院泌尿外科,广西柳州 545000)
膀胱癌是泌尿系统常见恶性肿瘤,发病率居男性恶性肿瘤前列,且发病率和病死率逐年升高[1]。膀胱癌细胞主要为尿路上皮细胞,有研究显示,上皮间质转化(epithelial mesenchymal transition,EMT)是上皮来源恶性肿瘤细胞侵袭及转移的主要原因之一,与病情进展关系密切[2]。Zeste基因增强子同源物2(enhancer of zeste homolog 2, EZH2)是多梳蛋白抑制复合物家族成员之一,可催化组蛋白H3 的甲基化过程,参与调控多种靶基因沉默。有研究显示,EZH2 与膀胱癌、前列腺癌等多种恶性肿瘤的发生、发展关系密切[3-4]。GSK126 是一种新型的EZH2 抑制剂,可抑制肿瘤细胞中EZH2 高表达状态。目前,关于GSK126 对膀胱癌细胞EMT 过程的调控报道较少,本研究旨在探究其对膀胱癌T24 细胞EMT 过程的影响及可能机制,为膀胱癌的治疗提供新思路。
1 材料与方法
1.1 细胞系
人膀胱癌细胞系T24 购自中国科学院上海生命科学研究院细胞资源中心,置于含100 u/mL 青霉素、100 mg/L 青霉素的RPMI 1640 培养基,在37℃、5%二氧化碳及饱和湿度条件下培养。
1.2 主要试剂及仪器
EZH2 抑制剂GSK126、二甲基亚砜(dimethyl sulfoxide, DMSO)(美国Sigma 公司),Matrigel 基质胶(美国Corning 公司),RPMI 1640 培养基、胎牛血清(武汉普诺赛生命科技有限公司),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)试剂盒(美国Thermo Fisher 公司),兔抗人EZH2、β-catenin 单抗、小鼠抗人Ecadherin、Vimentin、非受体型酪氨酸蛋白激酶2(JAK2)、磷酸化JAK2(p-JAK2)、信号转导及转录活化因子3(STAT3)、磷酸化STAT3(p-STAT3)单抗(美国Abcam 公司),辣根过氧化物酶(horseradish peroxidase, HRP)标记的IgG 相应二抗(北京中杉金桥生物技术有限公司)。
Transwell 小室(美国Corning Incorporated 公司),7300 qRT-PCR 仪(美国ABI 公司),电泳仪(美国Bio-Rad 公司)。
1.3 方法
1.3.1 药物配置将GSK126 溶于DMSO 中获得浓度为2 000 μmol/L 的母液,置于-20℃冰箱冷冻保存备用,实验前用RPMI 1640 培养基稀释至终浓度为10 μmol/L、20 μmol/L、40 μmol/L 的GSK126 溶液。
1.3.2 分组及干预方法取对数生长期的T24 细胞,胰蛋白酶消化,调整细胞密度为1.5×105个/mL,重新接种于96 孔板,随机分为空白组、GSK126 低剂量组、GSK126 中剂量组、GSK126 高剂量组,每组设5 个复孔,贴壁生长后,吸去培养基,分别用终浓度为0 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L 的GSK126细胞培养基继续培养。
1.3.3 MTT法检测细胞增殖能力取4组干预24 h、48 h、72 h 的T24 细胞,每孔加入5 g/L 新鲜制备的MTT 溶液,继续培养4 h,吸去培养基,每孔加入DMSO 150 μL,充分混匀溶解结晶,用酶标仪检测290 nm 波长处的吸光度(Absorbance, A)值,A 值越大代表细胞密度越高,增殖能力越强。
1.3.4 Transwell法检测细胞侵袭能力取4 组干预24 h 的T24 细胞,胰蛋白酶消化,RPMI 1640 培养基重悬,调整细胞密度为2.0×105个/mL 备用。RPMI 1640 培养基与Matrigel 基质胶按1∶6 稀释,包被Transwell 小室滤膜,置于24 孔板,上层加入各组细胞悬液2.0×105个/mL,下层加入含10%胎牛血清的RPMI 1640 培养基,继续培养48 h,无菌棉签擦除滤膜上层细胞,结晶紫染色,随机取5 个视野,计数穿膜细胞数[5]。
1.3.5 划痕实验检测细胞迁移能力取4 组T24 细胞接种至24 孔板,待细胞融合为单层细胞后,用无菌枪头在培养板上划直线,培养液冲洗划痕使其边缘整齐,拍照测量初始划痕宽度,各组加入相应浓度含药培养基后同条件继续培养48 h,再次拍照测量划痕宽度,计算细胞迁移率,细胞迁移率%=[(初始划痕宽度-48 h 划痕宽度)/初始划痕宽度]×100%。
1.3.6 qRT-PCR检测EZH2、E-cadherin、Vimentin、β-catenin mRNA 的表达收集各组GSK126 干预48 h 细胞,采用TRIzol 法提取细胞总RNA,琼脂糖凝胶电泳鉴定,酶标仪测定RNA 浓度,逆转录成cDNA,进行qRT-PCR 反应。按照试剂盒说明书设定20 μL反应体系:SYBR Premix Ex Taq 10.5 μL,10 μmol/L正反向引物各1.0 μL,cDNA 2 μL,ddH2O 5.5 μL。反应条件:94℃预变性5 min;94℃变性15 s,28℃退火45 s,72℃延伸60 s,共38 个循环。以β-actin 为内参对照,用2-ΔΔCT法计算目的基因相对表达量。引物序列见表1。

表1 qRT-PCR引物序列
1.3.7 Western blotting 检测EZH2、EMT 和JAK2/STAT3信号通路相关蛋白的表达收集各组GSK126干预48 h 细胞,转移至离心管,加入500 μL 细胞裂解液,冰上裂解25 min,12 000 r/min 离心15 min,离心半径10 cm,取上清液沸水水浴10 min,BCA 法测定总蛋白,取50 μg 蛋白进行恒定电流的十二烷基硫酸钠聚丙烯酰胺凝胶电泳,电转仪转分离胶至硝酸纤维素膜,加入封闭液室温封闭2 h,加入EZH2(1∶200)、E-cadherin(1∶200)、Vimentin(1∶400)、βcatenin(1∶200)、p-JAK2(1∶400)、JAK2(1∶400)、p-STAT3(1∶200)、STAT3 一抗(1∶200),4℃过夜,TBST充分洗涤,加入1∶2 000 稀释相应二抗,室温孵育4 h,TBST 再次洗涤,化学发光法显影。采用Image J 图像分析软件分析蛋白条带灰度值,计算目的蛋白与内参β-actin 灰度值的比值,即为该蛋白相对表达量。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用单因素方差分析或重复测量设计的方差分析,进一步两两比较用SNK-q法。P<0.05 为差异有统计学意义。
2 结果
2.1 各组细胞增殖能力比较
空白组及GSK126 低、中、高剂量组细胞培养24 h、48 h、72 h 的增殖能力比较,采用重复测量设计的方差分析,结果:①不同时间细胞增殖能力有差异(F=15.498,P=0.000);②4 组细胞增殖能力有差异(F=5.162,P =0.013);③4 组细胞增殖能力变化趋势有差异(F=12.314,P=0.000)。进一步两两比较结果:细胞培养24 h,GSK126 中、高剂量组细胞增殖能力低于空白组(P<0.05),且GSK126 高剂量组低于GSK126 中剂量组(P<0.05);细胞培养48 h 和72 h,GSK126 低、中、高剂量组细胞增殖能力低于空白组(P<0.05),且随GSK126 剂量升高而降低(P<0.05);随着时间延长,各组细胞增殖能力均增强(P<0.05)。见表2。
表2 各组细胞增殖能力比较 (±s)
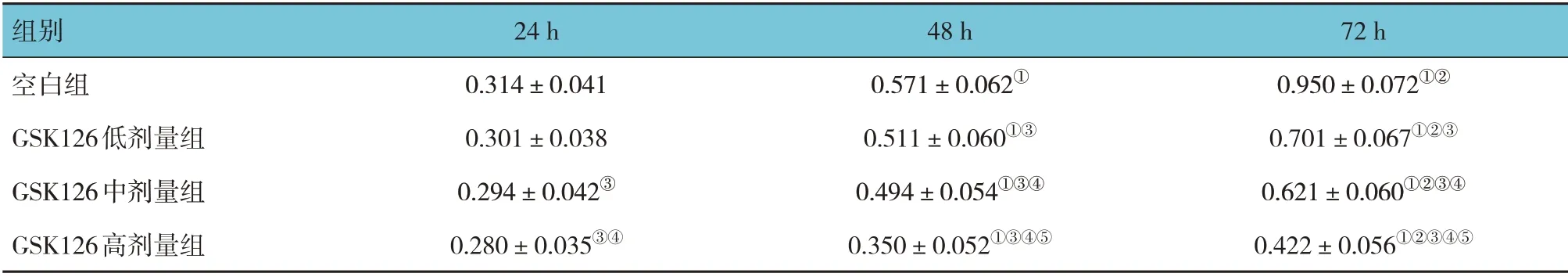
表2 各组细胞增殖能力比较 (±s)
注:①与24 h比较,P <0.05;②与48 h比较,P <0.05;③与空白组比较,P <0.05;④与GSK126低剂量组比较,P <0.05;⑤与GSK126中剂量组比较,P <0.05。
72 h 0.950±0.072①②0.701±0.067①②③0.621±0.060①②③④0.422±0.056①②③④⑤组别空白组GSK126低剂量组GSK126中剂量组GSK126高剂量组24 h 0.314±0.041 0.301±0.038 0.294±0.042③0.280±0.035③④48 h 0.571±0.062①0.511±0.060①③0.494±0.054①③④0.350±0.052①③④⑤
2.2 各组细胞侵袭和迁移能力比较
空白组及GSK126 低、中、高剂量组穿膜细胞数、迁移率比较,经方差分析,差异有统计学意义(F=79.685 和52.3001,均P=0.000)。进一步两两比较结果:与空白组比较,GSK126 低、中、高剂量组穿膜细胞数、迁移率均降低(P<0.05),且随GSK126 剂量升高而降低(P<0.05)。见表3。
表3 各组穿膜细胞数、迁移率比较 (±s)

表3 各组穿膜细胞数、迁移率比较 (±s)
注:①与空白组比较,P <0.05;②与GSK126低剂量组比较,P <0.05;③与GSK126中剂量组比较,P <0.05。
迁移率/%85.49±9.20 62.31±9.11①43.20±8.54①②36.87.±6.21①②③52.301 0.000组别空白组GSK126低剂量组GSK126中剂量组GSK126高剂量组F 值P 值穿膜细胞数/(个/HP)120.40±11.37 94.20±10.26①53.80±10.20①②31.60±9.51①②③79.685 0.000
2.3 各组EZH2、E-cadherin、Vimentin、β -catenin mRNA相对表达量比较
空白组及GSK126 低、中、高剂量组EZH2、Ecadherin、Vimentin、β-catenin mRNA 相对表达量比较,经方差分析,差异有统计学意义(F=198.091、95.147、85.140 和60.217,均P=0.000)。进一步两两比较结果:与空白组比较,GSK126 低、中、高剂量组EZH2、Vimentin、β-catenin mRNA 相对表达量均降低(P<0.05),且随GSK126 剂量升高而降低(P<0.05);与空白组比较,GSK126 低、中、高剂量组E-cadherin mRNA 相对表达量均升高(P<0.05),且随GSK126 剂量升高而升高(P<0.05)。见表4。
表4 各组EZH2、E-cadherin、Vimentin、β-catenin mRNA相对表达量比较 (±s)
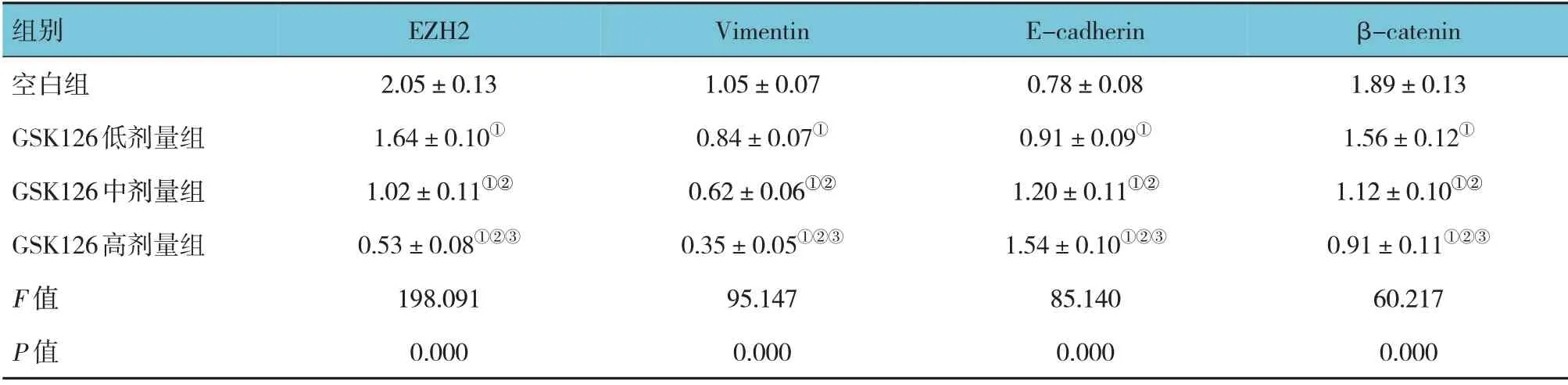
表4 各组EZH2、E-cadherin、Vimentin、β-catenin mRNA相对表达量比较 (±s)
注:①与空白组比较,P <0.05;②与GSK126低剂量组比较,P <0.05;③与GSK126中剂量组比较,P <0.05。
组别空白组GSK126低剂量组GSK126中剂量组GSK126高剂量组F 值P 值β-catenin 1.89±0.13 1.56±0.12①1.12±0.10①②0.91±0.11①②③60.217 0.000 EZH2 2.05±0.13 1.64±0.10①1.02±0.11①②0.53±0.08①②③198.091 0.000 Vimentin 1.05±0.07 0.84±0.07①0.62±0.06①②0.35±0.05①②③95.147 0.000 E-cadherin 0.78±0.08 0.91±0.09①1.20±0.11①②1.54±0.10①②③85.140 0.000
2.4 各组EZH2、EMT相关蛋白相对表达量比较
空白组及GSK126 低、中、高剂量组EZH2、Ecadherin、Vimentin、β-catenin 蛋白相对表达量比较,经方差分析,差异有统计学意义(F=532.016、107.842、253.016 和305.871,均P=0.000)。进一步两两比较结果:与空白组比较,GSK126 低、中、高剂量组EZH2、Vimentin、β-catenin 蛋白相对表达量均降低(P<0.05),且随GSK126 剂量升高而降低(P<0.05);与空白组比较,GSK126 低、中、高剂量组Ecadherin 蛋白相对表达量升高(P<0.05),且随GSK126 剂量升高而升高(P<0.05)。见表5和图1。

图1 各组EZH2、EMT相关蛋白的表达
表5 各组EZH2、EMT相关蛋白相对表达量比较 (±s)
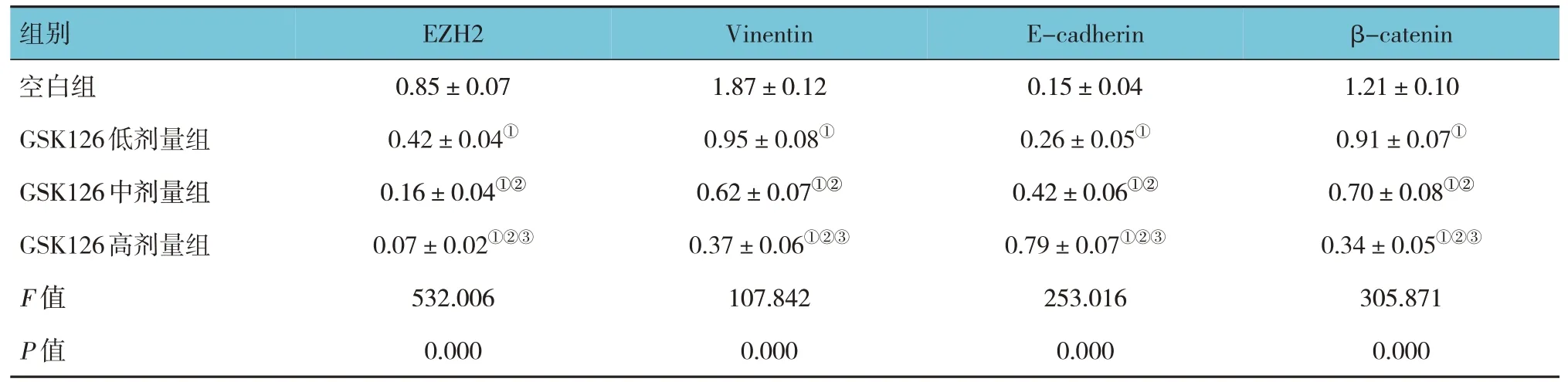
表5 各组EZH2、EMT相关蛋白相对表达量比较 (±s)
注:①与空白组比较,P <0.05;②与GSK126低剂量组比较,P <0.05;③与GSK126中剂量组比较,P <0.05。
组别空白组GSK126低剂量组GSK126中剂量组GSK126高剂量组F 值P 值β-catenin 1.21±0.10 0.91±0.07①0.70±0.08①②0.34±0.05①②③305.871 0.000 EZH2 0.85±0.07 0.42±0.040.95±0.08 0.16±0.04①②0.62±0.07①②0.07±0.02①②③0.37±0.06①②③532.006107.842 0.0000.000①Vinentin 1.87±0.12①E-cadherin 0.15±0.04 0.26±0.05①0.42±0.06①②0.79±0.07①②③253.016 0.000
2.5 各组JAK2/STAT3 信号通路相关蛋白相对表达量比较
空白组及GSK126 低、中、高剂量组p-JAK2/JAK2、p-STAT3/STAT3 蛋白相对表达量比较,经方差分析,差异有统计学意义(F=159.007 和217.835,均P=0.000)。进一步两两比较结果:与空白组比较,GSK126 低、中、高剂量组p-JAK2/JAK2、p-STAT3/STAT3 蛋白相对表达量均降低(P<0.05),且随GSK126 剂量升高而降低(P<0.05)。见表6和图2。
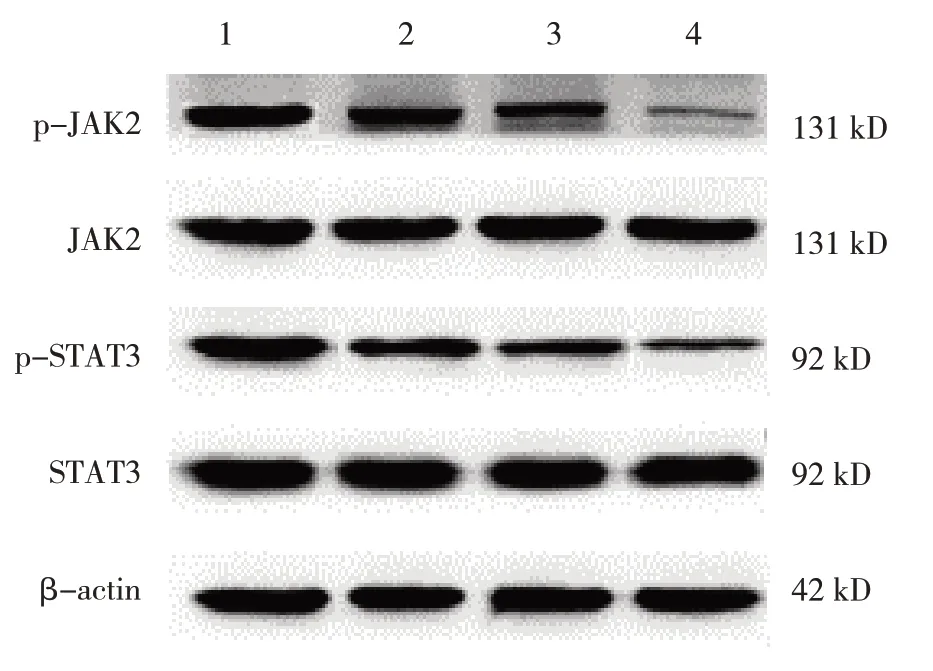
图2 各组JAK2/STAT3信号通路相关蛋白的表达
表6 各组JAK2/STAT3信号通路相关蛋白相对表达量比较 (±s)

表6 各组JAK2/STAT3信号通路相关蛋白相对表达量比较 (±s)
注:①与空白组比较,P <0.05;②与GSK126低剂量组比较,P <0.05;③与GSK126中剂量组比较,P <0.05。
p-STAT3/STAT3 0.91±0.12 0.75±0.08①0.46±0.07①②0.22±0.05①②③217.835 0.000组别空白组GSK126低剂量组GSK126中剂量组GSK126高剂量组F 值P 值p-JAK2/JAK2 0.95±0.07 0.61±0.05①0.43±0.04①②0.15±0.03①②③159.007 0.000
3 讨论
近年来,随着铂类化疗药物的普及、分子靶向药物的应用,膀胱癌患者总体生存率得到显著提高,精准靶向治疗成为热点研究领域[6-7]。但临床调查结果显示,膀胱癌术后复发转移风险较高,术后12 个月内复发率为10%~60%,预后生存期短[8]。膀胱癌属于尿路上皮细胞癌,病死率高。病灶转移和复发是导致膀胱癌患者死亡的重要原因。近年来研究显示,膀胱癌EMT 过程是复发转移的关键环节,膀胱上皮细胞在内外因素诱导下向间质细胞转化,该过程中细胞间黏附作用降低,癌细胞向远端侵袭和转移能力增强,最终导致病灶复发和转移[9]。表观遗传在膀胱癌发生、发展中发挥重要作用,EZH2基因是调控表观遗传的主要因子之一,参与组蛋白甲基化、EMT 等过程[10-11]。因此,抑制EZH2基因表达能抑制膀胱癌EMT 过程,从而为膀胱癌的治疗提供新的研究方向。
EZH2基因定位于人7 号染色体,编码746 个氨基酸,与果蝇E(z)蛋白的同源性为60.5%[12]。EZH2参与调控多种恶性肿瘤的进展。既往研究显示,EZH2 在结直肠正常黏膜组织、良性病变及腺癌中的阳性表达率依次升高,说明EZH2 参与结直肠癌变过程[13]。另有研究表明,EZH2 在肌层浸润性膀胱癌患者病灶中高表达,且与淋巴结转移关系密切,提示EZH2 可能参与膀胱癌EMT 过程,但仍需证据支持[14]。本研究首先通过检测EZH2 抑制剂GSK126 对膀胱癌活性的影响,结果显示,细胞培养24 h,GSK126 中、高剂量组细胞增殖能力均低于空白组;与空白组比较,GSK126 低、中、高剂量组细胞培养48 h、72 h 的细胞增殖能力及培养24 h 的穿膜细胞数、迁移率均降低,且具有剂量依赖性,提示抑制EZH2 可有效抑制T24 细胞增殖、侵袭和迁移能力,EZH2 与膀胱癌细胞活性密切相关。此外,本研究通过检测EMT 相关基因和蛋白的表达,结果发现,GSK126 各剂量组Vimentin、β-catenin mRNA 和蛋白相对表达量均低于空白组,E-cadherin mRNA 和蛋白相对表达量高于空白组,且均具有剂量依赖性,进一步证实抑制EZH2 可能抑制T24 细胞EMT 过程。Vimentin 属于细胞骨架蛋白,广泛分布于内皮细胞、淋巴细胞等间质细胞,是细胞EMT 的重要因子。有研究证实,Vimentin 参与肝癌细胞、肺泡上皮细胞等多种细胞EMT 过程[15-16]。β-catenin 是诱导EMT 的重要信号通路,未活化的β-catenin 与E-cadherin 结合,可维持上皮细胞形态及细胞间的黏附作用,当E-cadherin 表达被抑制,β-catenin 转入细胞质,在细胞质中不断累积,达到一定水平后转入细胞核,促进侵袭、迁移等靶基因的表达[17-18]。
此外,本研究发现,与空白组比较,GSK126 低、中、高剂量组p-JAK2/JAK2、p-STAT3/STAT3 蛋白相对表达量均降低,且随GSK126 剂量升高而降低,提示EZH2 抑制剂可能通过抑制JAK2/STAT3 信号通路中JAK2 和STAT3 蛋白磷酸化,抑制膀胱癌T24 细胞EMT,且具有剂量依赖性。JAK2/STAT3 信号通路是细胞因子转导的关键通路,JAK2 可通过激活下游STAT 级联反应,调控癌细胞增殖、迁移等过程。既往有研究显示,抑制JAK2/STAT3 信号通路相关蛋白磷酸化可抑制胰腺癌[19]、肾细胞癌[20]的增殖和迁移,抑制肿瘤恶性生物学行为过程。因此,抑制特异性EZH2 表达能抑制膀胱癌EMT 过程,可能与抑制JAK2/STAT3 信号通路有关。
综上所述,本研究应用不同浓度EZH2 抑制剂均可抑制膀胱癌T24 细胞增殖、侵袭及迁移能力,且可有效抑制膀胱癌T24 细胞EMT 过程,其调控机制可能与抑制JAK2/STAT3 信号通路中JAK2 和STAT3蛋白磷酸化有关,可为临床膀胱癌的精准治疗提供更多思路。
