纳米银与六价铬对污水生物处理的复合影响*
2022-04-27周婷婷宋晓梅郑煜铭苑志华
周婷婷 宋晓梅 郑煜铭 苑志华#
(1.中国科学院城市环境研究所,中国科学院城市污染物转化重点实验室,福建 厦门 361021;2.中国科学院大学,北京 100049;3.安徽理工大学地球与环境学院,安徽 淮南 232001)
纳米银是指粒径在1~100 nm的银单质,因其具有优良的抗菌性能,被广泛应用于生物医学、化妆品和食品包装等领域[1],[2]232。然而,随着纳米银使用量的增加,它对自然环境的不利影响也逐渐受到重视。研究发现,纳米银不仅可以改变河流、湖泊等自然水体中微生物的种群结构,而且能够在食物链中富集[3-5]。KAEGI等[6]研究发现城市污水处理厂是纳米银进入自然水体前的重要“中转站”,在控制纳米银的水环境风险方面具有重要作用。然而,有研究发现,具有杀菌性能的纳米银可以抑制污水生物处理系统中硝化细菌、聚磷菌等微生物的活性,进而给污水处理厂的运行带来不利影响[7]84,[8]2,[9]。
研究表明,纳米银对污水生物处理的影响程度不仅与纳米材料本身特征有关,也与污水、污泥和微生物种群结构密切相关[7]84,[8]2,[10]。在我国的城市污水处理厂中,重金属是存在于污水和污泥中的一大类污染物[11]319,[12]2456。有研究表明,纳米银与重金属共存时,可以明显改变砷、镉和铜对水蚤的生物毒性和生物累积性,并影响铅、锌和银在底泥中的环境转化[13-14]。张传玲等[15]也发现,纳米银与镉共存可以对植物根系造成复合影响,与二者单独存在时所具有的毒性存在较大差异。这些研究均揭示了纳米银和重金属在环境中共存时产生的相互影响。城市污水处理厂中,六价铬(Cr(Ⅵ))是主要存在的重金属之一[12]2457,[16]。有研究发现污水中的总铬为0.1~1.2 mg/L,而污泥是Cr(Ⅵ)进入污水处理厂后的主要载体,污泥中总铬为10.6~639.0 mg/kg[11]319,[12]2457,[17]。Cr(Ⅵ)在一定条件下具有强氧化性,能够降低污水生物脱氮除磷的效率,对污水生物处理产生不利影响。在纳米银与Cr(Ⅵ)共存的状态下,二者的毒性和环境行为可能会相互影响,进而给污水生物处理和自然环境带来不同于其单独存在时的风险,但是,这方面的研究相对较少。因此,本研究将纳米银和Cr(Ⅵ)共同暴露于污水生物处理系统,研究它们对生物去除有机物、总磷(TP)和氨氮的影响,考察污泥粒径的变化,以及二者进入污水生物处理系统后的流向,揭示纳米银和Cr(Ⅵ)的复合毒性效应,以期为纳米银和Cr(Ⅵ)的环境风险评价提供基础数据。
1 方 法
1.1 试验装置与运行条件
试验装置采用有机玻璃制成的序批式活性污泥反应器(SBR)。反应器为直径14.0 cm、高42.5 cm的圆柱体,有效体积为5.0 L,采取顶部进水和底部空气曝气的运行方式,每个循环为8.0 h,包括:厌氧2.5 h、曝气4.0 h、沉淀1.0 h、排水10 min、空置20 min,每次排水3.0 L。反应器的初始污泥混合液悬浮固体(MLSS)为3 800 mg/L,污泥龄为25 d,温度为(24±3) ℃。
1.2 纳米银的制备
按照文献[9]中的方法,采用硼氢化钠还原硝酸银,并用聚乙烯醇作为分散剂,制备出粒径为(14±3) nm的纳米银颗粒。为了使纳米银在加入反应器前保持稳定,配制不同浓度的纳米银溶液,放置于低温箱(≤4 ℃)中。
1.3 污泥接种与进水水质
试验接种污泥来源于生活污水处理厂的二沉池。污泥取回后,用纱布过滤掉大颗粒物和杂质,并按照设定浓度将污泥加入到反应器中。使用人工配制废水驯化污泥2个月。待反应器运行稳定后,开展纳米银和Cr(Ⅵ)的暴露研究。按照文献[18]中的配方进行人工配水,化学需氧量(COD)、氨氮和TP分别为(375±8)、(57±2)、(13.0±0.6) mg/L。
1.4 检测方法
pH和溶解氧采用多功能水质分析仪(WTW Multi342)检测,COD、TP和氨氮采用多参数水质分析仪(5B-3B(V8))检测,污泥粒径采用粒度分析仪(马尔文MS2000)分析, MLSS采用《水与废水监测分析方法》(第四版)的重量法检测。
出水和污泥混合液中总银和总铬采用电感耦合等离子体发射光谱 (ICP-OES) 仪(PerkinElmer Optima 7000 DV))检测,步骤:取适量循环结束后的出水或污泥混合液,加2.0 mL浓硝酸,80 ℃加热20 min,再加1.0 mL硝酸和1.5 mL过氧化氢(体积分数30%),在160~200 ℃下消解到0.5 mL左右,用去离子水定容;使用0.45 μm针式滤头过滤,检测滤液中总银和总铬的含量。出水中溶解态银的含量检测步骤:取适量循环结束后的出水,经过0.45 μm针式滤头过滤后,使用超滤膜装置(Amicon)在5 000 r/min下离心过滤,检测滤液中溶解态银的含量。
1.5 暴露浓度和周期
设置4个相同的反应器,1号反应器为空白对照组,2号反应器暴露Cr(Ⅵ),3号反应器暴露0.1 mg/L纳米银与Cr(Ⅵ),4号反应器暴露1.0 mg/L纳米银与Cr(Ⅵ)(见表1)。在整个试验周期内,纳米银在3、4号反应器的使用量分别为0.1、1.0 mg/L;Cr(Ⅵ)在2、3、4号反应器的使用量相同,1~50、51~100、101~120、121~140 d依次为1.0、5.0、10.0、20.0 mg/L,暴露周期分别为50、50、20、20 d。

表1 纳米银和Cr(Ⅵ)的暴露质量浓度和暴露周期Table 1 Exposure mass concentrations and periods of silver nanoparticles and Cr(Ⅵ)
2 结果与讨论
2.1 对有机物去除的影响
由图1可见,4个反应器出水COD没有出现明显的趋势性变化,空白对照组的出水中COD平均质量浓度为8.8 mg/L,而单独暴露Cr(Ⅵ)的反应器出水中COD平均质量浓度为11.6 mg/L,由此可见,1.0~20.0 mg/L的Cr(Ⅵ)对有机物去除有显著的不利影响(P<0.01)。
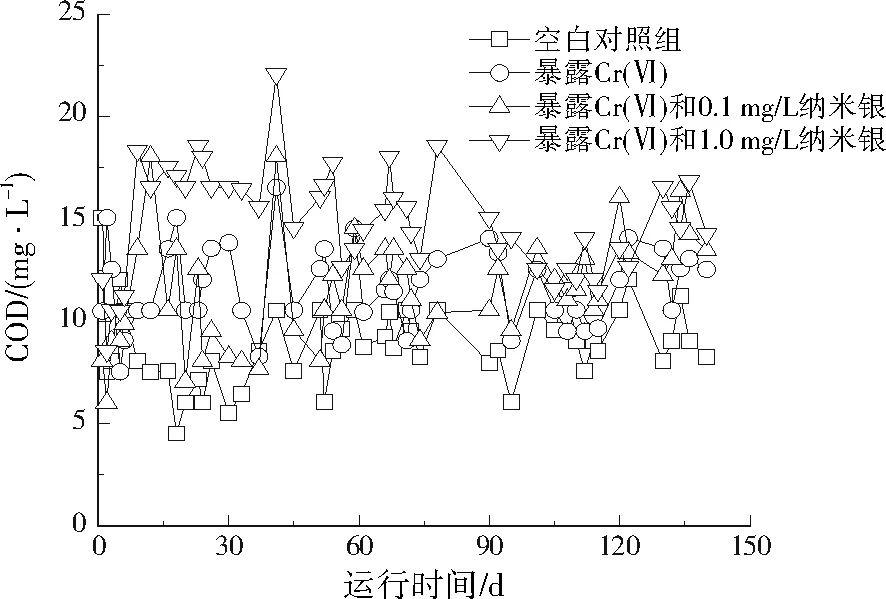
图1 纳米银和Cr(Ⅵ)对有机物去除的影响Fig.1 Effect of silver nanoparticles and Cr(Ⅵ) on the removal of organic matter
在Cr(Ⅵ)和0.1 mg/L纳米银的作用下,出水COD平均值为11.5 mg/L,与单独暴露Cr(Ⅵ)没有显著差别(P>0.05),这说明0.1 mg/L纳米银的加入没有引起Cr(Ⅵ)毒性的增强,而暴露Cr(Ⅵ)和1.0 mg/L纳米银后,出水中COD平均质量浓度显著增加,达到14.8 mg/L(P<0.01)。因此,1.0 mg/L纳米银的暴露,对COD的去除有显著的不利影响。但是,从图1可以看出,暴露后期(100 d后),COD逐渐降低到单独暴露Cr(Ⅵ)的状态。这反映了纳米银没有引起出水中COD出现明显的趋势性变化。这说明,≤20.0 mg/L Cr(Ⅵ)和≤1.0 mg/L纳米银对生物去除污水中有机物并没有产生明显的趋势性影响。文献[17]和[19]报道,当Cr(Ⅵ)小于40.0 mg/L时,对好氧和厌氧生物处理有机物不会产生明显影响,而1.0 mg/L纳米银可以引起COD去除率轻微降低,这与本研究的结果基本一致。因此,综合来看,Cr(Ⅵ)和纳米银共同暴露没有对污水生物去除有机物产生明显的毒性增强效应。
2.2 对氨氮去除的影响
由图2可见,空白对照组出水氨氮平均质量浓度为0.3 mg/L,没有出现明显波动。在暴露1.0 mg/L Cr(Ⅵ)后,出水中氨氮迅速上升,9 d后质量浓度达到34.9 mg/L,说明Cr(Ⅵ)对氨氮去除产生了较强抑制(P<0.01)。从图2也可以看出,加入0.1、1.0 mg/L纳米银前后,出水中氨氮的变化趋势较为接近,即≤1.0 mg/L的纳米银并未影响Cr(Ⅵ)对氨氮去除的抑制作用(P>0.05)。Cr(Ⅵ)对污水生物处理氨氮具有显著的抑制作用,主要是因为Cr(Ⅵ)可以导致氨氧化的功能表达基因(amoA)快速减少,进而抑制氨氧化细菌(AOB)的活性[20-21]。纳米银对污水生物处理系统中氨氮去除的影响较小,1.0 mg/L纳米银单独暴露时,氨氮去除没有受到影响[7]89。从图2可以看出,与Cr(Ⅵ)单独暴露相比,Cr(Ⅵ)和纳米银共同暴露并未明显改变氨氮的去除效率。
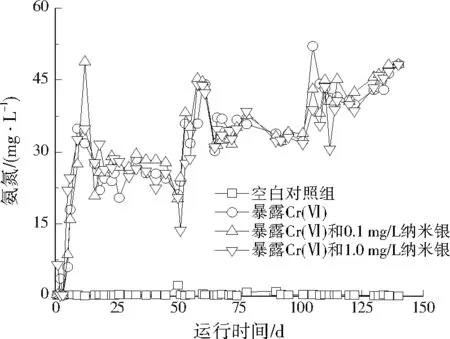
图2 纳米银和Cr(Ⅵ)对氨氮去除的影响Fig.2 Effect of silver nanoparticles and Cr(Ⅵ) on the removal of ammonia nitrogen
2.3 对TP去除的影响
从图3可以看出,空白对照组出水中TP在0.1~5.0 mg/L波动。在最初暴露的20 d内,1.0 mg/L Cr(Ⅵ)引起出水中TP快速升高后又使其恢复到暴露前的水平,这说明磷循环相关的微生物对1.0 mg/L Cr(Ⅵ)有一定的适应能力。暴露0.1 mg/L纳米银和Cr(Ⅵ)后,出水中TP的变化与单独暴露Cr(Ⅵ)没有显著差异(P>0.05)。暴露1.0 mg/L纳米银和Cr(Ⅵ)后,出水中TP最高值大于单独暴露Cr(Ⅵ)的水平,但是经过20 d暴露后,TP又恢复到正常水平。当加入的Cr(Ⅵ)达到5.0 mg/L时,出水中TP再次升高,并快速恢复正常。这说明纳米银和Cr(Ⅵ)在短期内对聚磷菌有一定的冲击作用,但是其活性能够快速恢复。图3也反映出≤1.0 mg/L纳米银与≤10.0 mg/L Cr(Ⅵ)共同暴露,对生物除磷并没有产生显著的复合毒性效应(P>0.05);当Cr(Ⅵ)达到20.0 mg/L时,共同暴露使得出水TP急剧上升,但单独暴露20.0 mg/L Cr(Ⅵ)时,在12 d后出水中TP含量才快速升高,这说明当Cr(Ⅵ)达到20.0 mg/L时,纳米银的暴露加速了Cr(Ⅵ)对除磷的不利影响。文献[7]和[19]研究均发现0.1 mg/L纳米银对污水生物除磷没有影响,但是1.0 mg/L纳米银可以降低污水生物除磷的效率,与本研究略有不同。文献[9]、[17]、[22]、[23]研究表明,污染物暴露对污水生物除磷的影响主要是通过抑制污泥中与磷代谢有关的聚磷菌活性,导致其厌氧释磷和好氧吸磷的能力减弱来实现的。
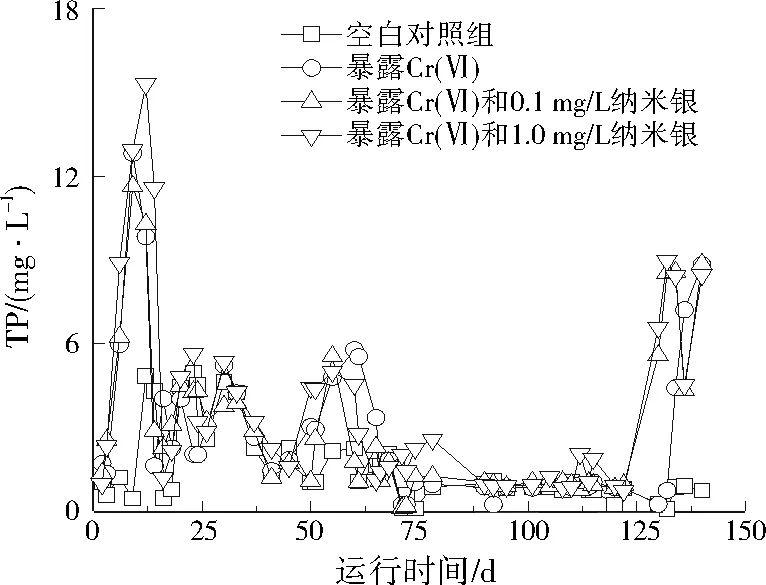
图3 纳米银和Cr(Ⅵ)对TP去除的影响Fig.3 Effect of silver nanoparticles and Cr(Ⅵ) on the removal of TP
2.4 对污泥粒径的影响
从图4可以看出,空白对照组污泥粒径随着运行时间的延长而逐渐增加,当加入1.0~20.0 mg/L Cr(Ⅵ)后,污泥粒径与未加入Cr(Ⅵ)的污泥粒径相比,其变化趋势没有发生明显改变,这说明≤20.0 mg/L Cr(Ⅵ)对污泥粒径没有显著影响(P>0.05)。
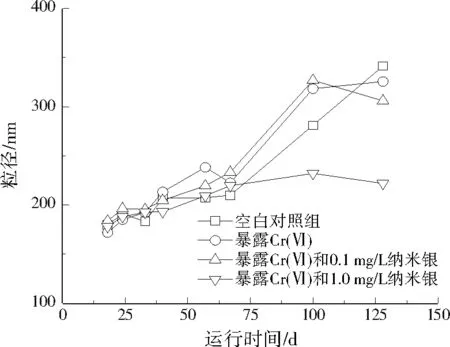
图4 纳米银和Cr(Ⅵ)对污泥粒径的影响Fig.4 Effect of silver nanoparticles and Cr(Ⅵ) on the sludge particle size
≤20.0 mg/L Cr(Ⅵ)和0.1 mg/L纳米银共同暴露未对污泥粒径的变化趋势产生显著的复合影响(P>0.05);≤20.0 mg/L Cr(Ⅵ)和1.0 mg/L纳米银共同暴露时,污泥粒径的变化趋势在最初阶段没有明显改变,但在暴露67 d后,污泥粒径增加趋势开始变缓,这说明1.0 mg/L纳米银和Cr(Ⅵ)短期共同暴露(>67 d)对污泥粒径没有影响,但是长期共同暴露(≥67 d)会降低污泥粒径的增长速率,当加入的Cr(Ⅵ)达到10.0 mg/L时,污泥粒径增长受到抑制,其原因可能是Cr(Ⅵ)和纳米银进入污水生物处理系统后,容易被污泥吸附,进而累积到污泥中,随着污泥富集的污染物增多,污泥受到的影响也越大,最终导致活性污泥胞外多聚物(EPS)减少,污泥絮体解体[7]89,[24]902,[25-26]。因此,Cr(Ⅵ)(≥10.0 mg/L)和纳米银(1.0 mg/L)可以对污泥粒径产生复合影响。
2.5 纳米银和Cr(Ⅵ)经过污水生物处理后的流向
图5反映出经过污水生物处理后,纳米银和Cr(Ⅵ)在出水和污泥混合液中的分布情况。从图5(a)可以看出,在Cr(Ⅵ)为1.0、5.0、10.0、20.0 mg/L的4个阶段内,暴露0.1、1.0 mg/L纳米银的反应器出水中总银在一定范围内波动,没有出现趋势性变化。同时,出水中溶解态银都低于检测限(3.0 μg/L)。因此,没有出现纳米银被Cr(Ⅵ)氧化成银离子的现象。从图5(b)可以看出,当纳米银为0.1 mg/L时,银在污泥混合液中没有出现累积,但是当达到1.0 mg/L时,银在污泥混合液中出现累积,这与文献[24]的研究结果一致。使用1.0 mg/L纳米银的反应器中,当暴露140 d时,污泥混合液中总银达到16.3 mg/L,银在污泥混合液中出现趋势性累积。原因可能是纳米银受到水质和污泥的影响,能够快速团聚并被污泥吸附,最终富集到污泥中[24]905。
从图5(c)和图5(d)可以看出,当Cr(Ⅵ)≤10.0 mg/L时,出水中总铬保持相对稳定,但是当Cr(Ⅵ)达到20.0 mg/L时,出水中总铬急剧增加,并在20 d后达到14.6 mg/L;同时,污泥混合液中的总铬在整个试验阶段一直持续增加,这说明Cr(Ⅵ)主要富集到污泥中。文献[25]研究发现,Cr(Ⅵ)的去除和污水中的糖类物质密切相关,且SBR和砂滤池可以去除95%的总铬。因此,当污水中含有≤1.0 mg/L纳米银和≤10.0 mg/L Cr(Ⅵ)时,银和铬主要赋存在污泥中;当污水中含有20.0 mg/L Cr(Ⅵ)时,不仅会引起铬在污泥中富集,而且会使出水中的总铬增加;但是,20.0 mg/L Cr(Ⅵ)没有引起出水中总银的升高。
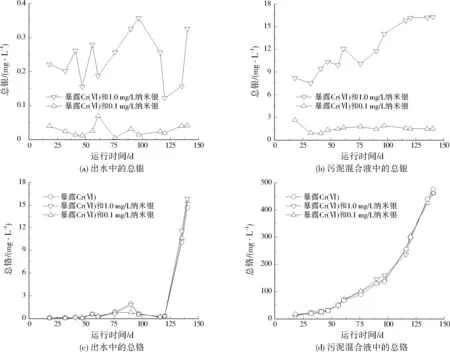
图5 纳米银和Cr(Ⅵ)经过污水生物处理后的流向Fig.5 Fate of silver nanoparticles and Cr(Ⅵ) after sewage biological treatment
2.6 纳米银和Cr(Ⅵ)形成复合效应的原因
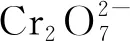
(1)
(2)
Ag++e-→Ag0,E0=0.80 V
(3)
(4)
图3反映出当Cr(Ⅵ)达到20.0 mg/L时,纳米银和Cr(Ⅵ)对污水生物除磷产生了一定的复合影响,结合此阶段反应器出水中总铬升高以及污泥混合液中总银和总铬升高的现象,其产生复合作用的原因可能为暴露过多的Cr(Ⅵ)使污泥的吸附能力达到饱和,进而影响到污泥吸附纳米银和促进纳米银团聚的能力,这会导致污泥混合液中存在更多分散状态的纳米银;纳米银产生的纳米效应会影响到聚磷菌的活性,进而降低污水生物除磷效率[7]86。随着污泥混合液中总铬进一步升高,它对聚磷菌的活性也产生了抑制,进而影响到除磷效率。因此,在污泥吸附饱和的情况下,纳米银和Cr(Ⅵ)的复合毒性对污水生物除磷有一定的影响。
2.7 对环境风险的启示
随着纳米银使用量的增加,其释放量也不可避免地逐渐增加。因此,纳米银进入水体、土壤和人工设施(如污水处理厂、垃圾填埋场)等环境后的风险也引起了重视[2]235。文献[13]、[14]、[15]研究表明纳米银不仅会直接危害环境安全,还可以和重金属(如As(Ⅴ)、镉、铜、铅、锌和汞等)产生复合作用,间接产生生态风险。由于Cr(Ⅵ)在特定条件下具有强氧化性,它遇到纳米银后所造成的生态影响可能会与其单独存在时有很大不同。从本研究结果来看,纳米银和Cr(Ⅵ)共同暴露于污水生物处理系统时,仅在暴露后期对除磷和污泥粒径有复合影响,对有机物和氨氮的去除没有产生明显的复合影响,这主要与该反应器中污泥混合液的pH呈弱碱性有关,这种条件下Cr(Ⅵ)不具有强氧化性,无法对纳米银颗粒的化学转化造成有效影响。但是,环境(如水体、底泥、土壤和污水处理厂等)中Cr(Ⅵ)的赋存条件和地球化学转化特征都较为复杂,不仅存在着偏酸性的赋存环境,更是有Cr(Ⅲ)向Cr(Ⅵ)的自然转化[33-34],这种情况下,纳米银和Cr(Ⅵ)的复合毒性将会更加复杂。综合来看,当前污水处理厂进水中纳米银和Cr(Ⅵ)都较低(<1.0 mg/L)[35-36],再结合其进水pH大致为7~8的情况,可以看出二者目前对污水生物处理带来的复合毒性效应较小。
3 结 论
(1) ≤1.0 mg/L纳米银和20.0 mg/L Cr(Ⅵ)在试验条件下共同暴露没有对污水生物去除有机物和氨氮产生复合毒性,但是对污水生物除磷产生了一定的复合影响,降低了污水除磷效率,而1.0 mg/L纳米银和20.0 mg/L Cr(Ⅵ)则对污泥粒径产生了一定的复合影响并减缓了污泥粒径增长速率,二者共同暴露所引起的复合生态风险不应忽视。
(2) 污水中含有≤1.0 mg/L纳米银和≤10.0 mg/L Cr(Ⅵ)时,银和铬主要赋存在污泥中;污水中含有20.0 mg/L Cr(Ⅵ)时,铬不仅会富集到污泥中,还会增加出水中总铬的含量。
