电场-磁性铁酸钴催化剂协同促进镁法脱硫产物氧化性能
2022-04-27车宜行田红景
车宜行,杜 瑾,田红景
(青岛科技大学 化工学院,山东 青岛 266042)
为了避免SO2污染,各种烟气脱硫技术被开发、利用[1],而其中镁法烟气脱硫技术以其脱硫效率高、运行稳定、不易结垢等优势迅速被推广,成为了一项重要的烟气脱硫技术[2]。脱硫产物MgSO3的催化氧化是处理镁法烟气脱硫产物的一种重要途径[3]。为了使镁法烟气脱硫技术得到更广泛的的应用,在MgSO3的催化氧化方面已有许多人做了很多研究。
经过一系列的研究工作,Co2+被证明在促进脱硫产物氧化方面是最有效的[4-5]。为了避免金属离子排放造成的二次污染问题,汪黎东课题组研究了负载型钴基固体催化剂在促进镁法烟气脱硫产物氧化方面的性能,可将MgSO3的氧化速率提高到非催化条件下的4~8倍,大大减少了钴离子的浸出,可循环利用且对环境友好[6-8]。但催化剂仍然需要通过过滤回收,回收过程耗时较长,不利于工业大规模应用。具有磁性的铁酸盐常被用在污水处理方面,催化性能好、结构稳定且易于回收[9-11],目前尚未用于亚硫酸盐催化氧化的研究。
电化学方法因其操作简单,条件温和且环境友好的特点正被广泛的应用到各个反应体系中。通过引入电化学方法,许多染料废水[12-13]以及有机污染物如苯酚[14]等废水的氧化降解可以获得更高的效率。
在本研究中,通过共沉淀法制备了CoFe2O4/MCM-41复合催化剂。采用廉价的石墨片用作电极将电场引入MgSO3催化氧化系统。在不同实验条件下测试了电场增强MgSO3催化氧化反应的动力学性能。研究结果可为亚硫酸盐氧化脱硫副产物的回收利用提供参考,对推广镁法烟气脱硫具有一定意义。
1 实验部分
1.1 试剂与仪器
MCM-41,天津南华催化剂有限公司;无水亚硫酸钠(Na2SO3)、六水合氯化镁(MgCl2·6H2O)、六水合硝酸钴(Co(NO3)2·6H2O)、九水合硝酸铁(Fe(NO3)3·9 H2O)、无水乙醇(CH3CH2OH)、氢氧化钠(NaOH)、氯化钠(NaCl)、氯化钡(BaCl2)、丙三醇(C3H8O3)、氨水(NH3·H2O)、盐酸(HCl),国药集团化学试剂有限公司。
X射线衍射仪,D-MAX 2500/PC型,日本Rigaku公司;冷场发射扫描电子显微镜,JSM-7500F型,日本JEOL公司;场发射透射电子显微镜,JEM-2100F型,日本JEOL公司;紫外-可见分光光度计,TU-1800型,北京普析通用仪器有限责任公司;直流电源,UTP 1306S型,优利德科技(中国)股份有限公司;空气压缩机,DET-550型,达尔拓空压机有限公司;p H计,PHS-3C型,仪电科学仪器股份有限公司;万用表,VC 97型,深圳市胜利高电子科技有限公司。
1.2 实验原料的制备
1.2.1 MgSO3样品的制备
由于MgSO3在空气中容易被氧化,为了避免杂质对实验结果的影响,采用自制的MgSO3进行氧化试验,每次实验现配现用。将200 m L去离子水加热至约40℃,称取22 g Na2SO3溶于其中,然后将35.58 g MgCl2·6H2O缓慢加入。持续剧烈搅拌,得到MgSO3沉淀,将沉淀抽滤并用去离子水洗涤3~5次,转移至真空干燥箱中,在60℃、-0.08 MPa下干燥5 h,得到干燥的MgSO3样品。
1.2.2 CoFe2O4/MCM-41催化剂的制备
根据文献[6]采用共沉淀法制备了钴质量分数为4%的CoFe2O4/MCM-41。将1 g MCM-41分散在40 m L去离子水中超声处理1 h。按照n(Fe)∶n(Co)=1∶2将0.576 g Fe(NO3)3·9H2O和0.197 g Co(NO3)2·6H2O溶解在20 m L去离子水中。然后将混合金属盐溶液加入到MCM-41悬浊液中,持续搅拌并将混合溶液加热至85℃。逐滴滴加4.8 mol·L-1NH3·H2O到混合溶液中,直到混合溶液的p H达到12.0。然后将混合溶液保持搅拌1 h。最后,通过磁力回收产物,用无水乙醇和蒸馏水洗涤。将样品在100℃烘箱中干燥12 h,然后在马弗炉中以5℃·min-1的加热速率在500℃下进一步煅烧2 h,得到CoFe2O4/MCM-41。制得的CoFe2O4/MCM-41在溶液中使用磁铁可以实现回收。
1.3 MgSO3的电化学催化氧化
MgSO3的电化学催化氧化装置见图1。反应容器为内径为7 cm,高16 cm的玻璃反应器。尺寸均为5 cm×4.5 cm的阴阳两极用电极夹固定,垂直放置在玻璃反应器中,保持两电极间距为4 cm。在玻璃反应器中加入300 m L去离子水,将温度调节至45℃后加入1 g·L-1催化剂,调节电动搅拌器转速稳定,以消除电场极化作用对溶液中传质过程的影响。转速稳定后用1 mol·L-1盐酸与1 mol·L-1氢氧化钠溶液调节p H为8.0并在实验过程中保持p H稳定于8.0,使用空气压缩机向反应器中通入空气,控制进气流量为1 L·min-1,控制电流密度为66.7 m A·cm-2。在加入50 g·L-1Mg-SO3样品后开始计时,分别在5、10、15、20、30 min时用移液枪取出1 m L溶液,加入2 m L的1 mol·L-1盐酸将其中的沉淀物溶解后,移至100 m L容量瓶中,定容至100 m L[15]。采用硫酸钡比浊法[16]对不同时间点所取溶液中的硫酸根浓度进行测量。取10 m L稀释后的溶液置于100 m L烧杯中,加入去离子水稀释至50 m L,再加入小转子和2.5 m L稳定剂溶液(由75 g NaCl、300 m L去离子水、30 m L盐酸溶液(ρ=1.19 g·m L-1)、50 m L甘油与100 m L无水乙醇配制而成),在磁力搅拌器上中速搅拌,待转速稳定后加入0.2 g BaCl2并开始计时,搅拌1 min静置9 min后在420 nm的波长下对混合液的吸光度进行测量。按照相同方法对0~40 mg·L-1硫酸根标准溶液的吸光度-浓度标准曲线进行测量,根据标准曲线可以得出在不同时间点反应溶液中的硫酸根浓度。硫酸根浓度与时间呈线性关系,斜率即为MgSO3的氧化速率[6]。
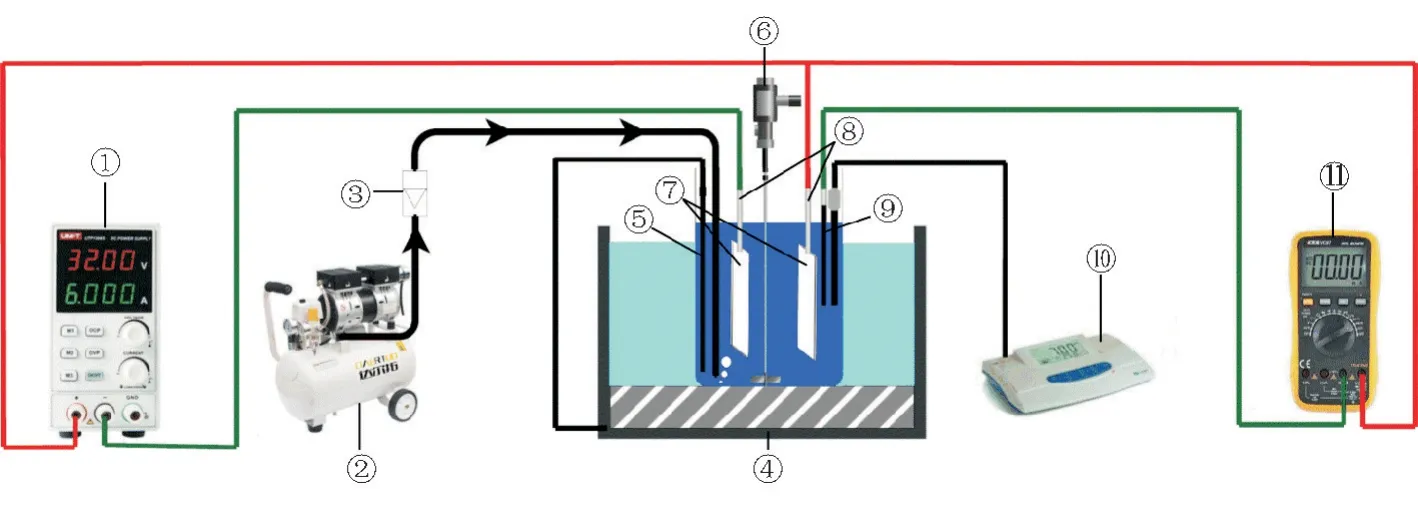
图1 MgSO3的电化学催化氧化装置Fig.1 Apparatus of electrochemical-catalyzed oxidation of MgSO3
2 结果与讨论
2.1 CoFe2 O4/MCM-41催化剂的表征
2.1.1 XRD分析
MCM-41载体与CoFe2O4/MCM-41的XRD谱图,见图2。从图2可以看出,MCM-41为非晶结构。CoFe2O4/MCM-41在35.5°与62.7°处出现了两个较为明显的衍射峰,分别对应于CoFe2O4标准卡片(JCPDS 22-1086)的(311)与(440)两个晶面,并且载体MCM-41的结构未被破坏。通过XRD测试,说明了CoFe2O4成功地被负载到了MCM-41上。另外,通过XRD图像可以发现由于CoFe2O4的峰强度较低且呈宽峰状态,说明CoFe2O4在MCM-41上的分散性较好,这对于催化反应来说具有积极作用。
狗蛋睡着后,哥们儿朝洛蒙洗了,把自己剥葱皮一样脱得个精光,早早地钻进被窝里候着。媳妇却厨房里磨磨蹭蹭,拾掇拾掇这个,摆弄摆弄那个,总是不停手。好像是故意躲避着他似的。

图2 MCM-41载体与CoFe2 O4/MCM-41的XRD谱图Fig.2 XRD spectra of MCM-41 carrier and CoFe2 O4/MCM-41
2.1.2 SEM,TEM与HRTEM分析
图3为MCM-41载体与CoFe2O4/MCM-41的SEM图像。由图3(a)可以看出,纯MCM-41载体具有丰富的孔结构,这会造就CoFe2O4/MCM-41具有丰富的表面积,可以大大提高催化剂与反应物的接触面积,有利于反应的进行。通过图3(b)对CoFe2O4/MCM-41表面形貌的观察,可以发现CoFe2O4成功的分布在了MCM-41的表面及孔道中,且合成的CoFe2O4/MCM-41仍然保留了孔道结构,这有利于提高催化剂的催化性能,对于反应起到了促进作用。

图3 MCM-41载体与CoFe2 O4/MCM-41的SEM照片Fig.3 SEM images of MCM-41 carrier and CoFe2 O4/MCM-41
CoFe2O4/MCM-41的TEM和HRTEM照片如图4所示。通过图4(a)可以看出,CoFe2O4广泛分布在MCM-41内部,借助MCM-41丰富的孔道结构,CoFe2O4/MCM-41的表面积得到了极大的提高,这有助于提高反应过程中催化剂与SO2-3的接触几率,极大的提升反应速率。图4(b)对CoFe2O4/MCM-41的晶面进行了观测,在图像区域内发现了晶格间距为0.253与0.148 nm的两种晶面,分别对应于CoFe2O4的(311)与(440)晶面,与XRD结果一致。通过XRD、SEM、TEM及HRTEM的结果,可以证明CoFe2O4/MCM-41材料的成功合成。

图4 CoFe2 O4/MCM-41的TEM、HRTEM照片Fig.4 TEM and HRTEM images of Co Fe2 O4/MCM-41
2.2 电场对MgSO3催化氧化的加速性能
2.2.1 电场对催化氧化反应的加速作用
为了证明电场对反应的加速作用,在p H=8.0条件下分别对纯曝气、纯电场、有CoFe2O4/MCM-41催化剂无电场、CoFe2O4/MCM-41催化剂有电场以及模仿文献[16]中方法制备的4%(质量分数)Co负载量的Co3O4/MCM-41催化剂无电场的情况进行了实验探究,实验结果如图5所示。根据结果可以知CoFe2O4/MCM-41催化剂的效果要强于根据文献[16]方法制备的Co3O4/MCM-41催化剂。而且可以明显看到电场的加入有效提高了MgSO3的催化氧化速率,加入电场作用后,反应速率与仅含CoFe2O4/MCM-41催化剂条件相比又提高了近一倍。并且在电场与催化剂的共同作用下反应速率达到了无催化剂无电场时的10倍。说明电场确实可以有效促进MgSO3的催化氧化反应。另外发现在电场与CoFe2O4/MCM-41的共同作用下反应速率的数值大于纯电场条件下与CoFe2O4/MCM-41催化条件下的速率之和,说明电场对于反应体系并非简单的叠加作用,而是存在一定的协同效应,电场的引入提高了反应体系中的电子转移速率,既可以促进SO2-3的直接氧化[17],又可以促进催化剂上自由基的生成[18]。
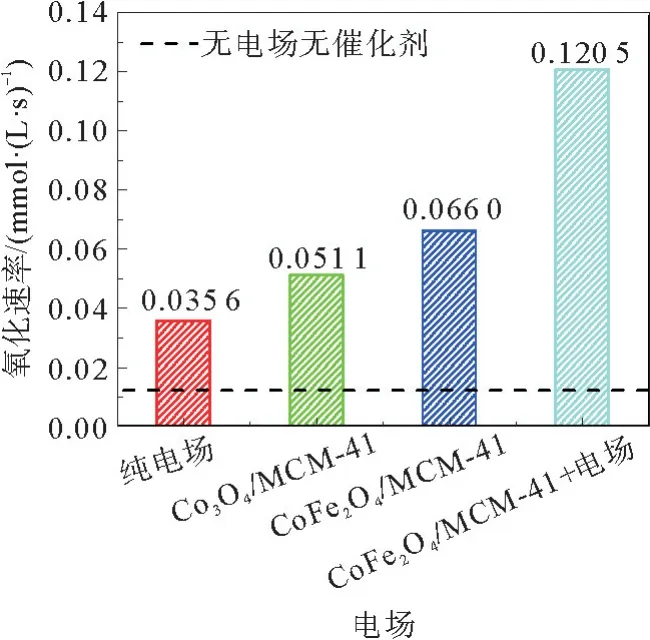
图5 电场对催化氧化反应的加速作用Fig.5 Acceleration effect of electric field on the catalytic oxidation reaction
2.2.2 p H 对氧化速率的影响
MgSO3的氧化速率随溶液的p H值变化的情况如图6所示。分别在p H=7、8、9和10的反应溶液中进行了实验研究。结果表明,当p H值从7增加到8时,MgSO3的氧化速率增加。原因可能是由于在相对较低的p H值下溶液中H+浓度的增加导致向HSO-3或H2SO3的转化,这降低了的浓度,从而降低了MgSO3的氧化速率[19]。当p H值从8增加到10时,MgSO3的氧化速率降低,这可能是由于OH-离子和Co Fe2O4催化剂上的活性位点的结合导致催化活性降低[20]。因此可以确定本反应的最佳p H为8。
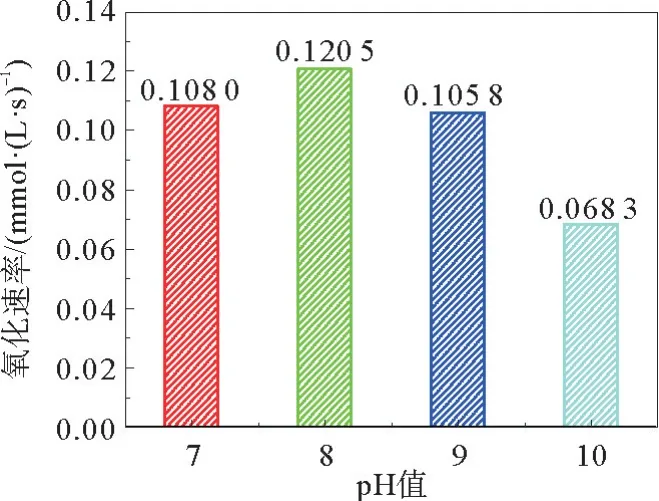
图6 pH对氧化速率的影响Fig.6 Effect of p H on oxidation rate
对MgSO3初始加入量对氧化速率的影响进行了研究,结果见图7。从图7中可以看出,MgSO3的初始添加量对反应速率没有显着影响,由反应对数图(图7插图)可以看出反应相对于MgSO3初始添加量的反应级数约为0。造成这一结果的原因是MgSO3在45℃时的溶解度约为0.87 g[19],因此在反应过程中溶液中的总是处于饱和状态,MgSO3初始添加量的增加与溶解的MgSO3的量没有直接关系,因此MgSO3初始添加量的增加对氧化速率没有显著影响。

图7 MgSO3初始加入量对氧化速率的影响Fig.7 Effect of initial addition of MgSO3 on oxidation rate
2.2.4 催化剂用量对氧化速率的影响
催化剂用量对氧化速率的影响见图8。由图8可以看出,催化剂用量在0 g·L-1至3 g·L-1的浓度范围内,MgSO3氧化速率随催化剂用量的增加而增加。这是因为催化剂用量的增加使活性位点的浓度增加。由反应速率与催化剂用量的对数图(图8插图)可以看出氧化速率相对于催化剂用量的反应级数为0.46,其作用类似于Co2+离子催化剂(反应级数为0.44)[21]。原因可能是由于在这个催化剂用量范围内,催化剂的作用类似于Co2+,消除了内扩散步骤对反应的影响[19]。
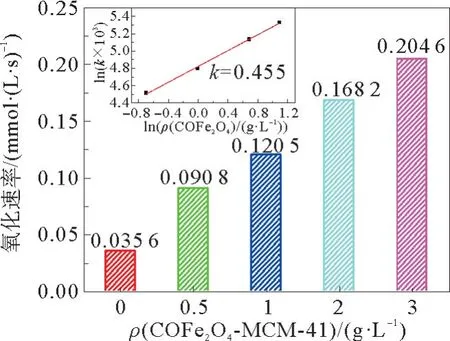
图8 催化剂用量对氧化速率的影响Fig.8 Effect of catalyst dosage on oxidation rate
2.2.5 温度对氧化速率的影响
MgSO3氧化速率受温度的影响,见图9。通过实验结果发现在298~358 K的温度范围内,随着反应温度的升高,MgSO3氧化的反应速率增加。此外,绘制了反应速率的对数与1/T关系图像(图9插图)。可以通过Arrhenius公式从斜率计算反应活化能,对数图的斜率为-2 011.68,因此计算得到的活化能为16.73 kJ·mol-1。由此可知反应物需要较少的活化能即可达到过渡态。由于活化能较低,可以推断氧化反应受本征反应步骤的影响程度较小,结合内扩散对反应的影响较小,因此推测反应可能受氧气的外扩散步骤控制[19]。

图9 温度对氧化速率的影响Fig.9 Effect of temperature on oxidation rate
2.2.6 空气流量对氧化速率的影响
空气流量对氧化速率的影响见图10。由图10可以看出,当空气流量从18 L·h-1增大至60 L·h-1的过程中,随空气流量增加,MgSO3氧化速率增加较快,而当空气流量由60 L·h-1增加至180 L·h-1时,虽然空气流量得到了较大提升,但MgSO3的氧化速率增加量却较低。这可能是由于当空气流量在18~60 L·h-1之间时,随空气流量增大,一方面增大了气液传质面积,从而减小了传质阻力,另一方面气体对溶液的搅拌作用逐渐增强,促进了溶解氧分子在液相中的传质。而当空气流量在60~180 L·h-1之间时,部分气泡发生碰撞团聚,导致气液接触面积变化不大,对溶液的搅拌效果不明显,因此,在此流量范围内空气流量的增加对总体反应速率的影响减小[22-23]。由此可以推测,反应受控于氧气的外扩散。

图10 空气流速对氧化速率的影响Fig.10 Effect of air flow rate on oxidation rate
3 结 论
将磁性CoFe2O4/MCM-41催化剂用于MgSO3的催化氧化,并向反应体系中引入电场,证明了电场可有效提高MgSO3的催化氧化速率,在电场与Co Fe2O4/MCM-41催化剂的共同作用下,反应速率可达到纯曝气氧化的10倍左右。通过对比不同p H下的反应速率,确定最佳的反应p H=8。另外对MgSO3初始添加量、催化剂用量对反应速率的影响进行了研究,发现当MgSO3初始添加量、催化剂用量值增加,MgSO3的氧化速率也随之提高,且催化剂用量与MgSO3初始添加量所对应的的反应分级数分别为0.46、0。通过研究温度对反应速率的影响,得到电场下反应表观活化能为16.73 kJ·mol-1。通过上述结论结合空气流量对反应的影响实验,证明反应受到氧气的外扩散步骤控制。研究结果为镁脱硫副产物的回收利用提供了新的思路,对镁法脱硫技术的推广具有积极意义。
