金银团簇基光学传感器设计及其对镉离子的检测性能
2022-04-27王子平杜芳林
王子平,刘 勇,杜芳林,袁 勋*
(1.潍坊科技学院 山东半岛卤水资源高值化绿色化综合利用工程技术研发中心,山东 寿光 262700;2.青岛科技大学 材料科学与工程学院,山东 青岛 266042)
重金属污染对生态环境和人类健康具有严重的威胁,已经受到全世界范围内的广泛关注。其中,镉离子(Cd2+),作为一种高危险性重金属离子,广泛存在于水体及农作物中,长期摄入,会导致包括肾功能障碍和癌症在内的一系列健康问题[1]。到目前为止,科研人员已开发出多种镉离子(Cd2+)检测方法[2-3],如原子吸收光谱法、比色法、质谱法、电化学法等。然而,上述检测方法多存在仪器贵重、操作复杂、检测灵敏度差、成本高昂、耗时耗力等问题,严重制约其对各种复杂水环境、农产品中Cd2+的日常检测。因此,开发低成本、高选择性、高灵敏度、瞬时响应、操作简便的Cd2+传感器具有十分重要的意义。
荧光法因其输出信号高、检测灵敏、操作简便和瞬时响应的特点,在重金属离子检测方面显示出明显的优势。因此,Cd2+荧光探针的设计越来越受到人们的关注。常用的Cd2+荧光探针主要为有机荧光分子、量子点和配合物。然而这些荧光探针常存在合成路线复杂、光稳定性差(如有机染料),以及毒性(如量子点)等问题。另外,在检测过程中容易出现相互干扰,使几种具有相似特征的分析物的鉴别检测失效。因此,设计易于合成的、光稳定及环境友好的Cd2+荧光纳米探针,实现对Cd2+检测的低成本、高选择性、高灵敏度、瞬时响应,仍然是一项具有挑战性的工作。
近年来,荧光贵金属纳米团簇[4-5]由于其超小的尺寸(<2 nm)、较高的量子产率、大的斯托克斯位移、良好的光稳定性和生物相容性,已发展成为一类新型的替代传统有机染料和半导体量子点的荧光探针材料[6],在生物成像[7]及分子、离子检测[8]等应用方面广受青睐。例如,一系列的荧光贵金属纳米团簇已被用于构建多种荧光传感器[9-10],实现了对不同的金属 离 子(如Hg2+[9-13]、Cu2+[14-15]和Pb2+[16]等)的检测。基于以往的团簇基荧光传感器的设计经验,若使团簇基荧光传感器具有优异的检测性能,荧光贵金属纳米团簇须具备以下特点:荧光量子效率高(即保证高灵敏性)、与被分析物的作用力强且专一(即保证瞬时响应和高选择性)、稳定性好(即保证性能稳定)[8]。另外,多数荧光传感器对金属离子的检测多是基于金属离子诱导荧光淬灭的检测机制,该机制在被分析物浓度低及存在多种干扰物种时常出现假阳性检测信号,而基于荧光转换或增强的团簇基光学传感器则能较好的避免该问题。因此,开发具有强烈荧光、高稳定性且与Cd2+具有强特异性作用的贵金属纳米团簇,或能实现对Cd2+的低成本、高选择性、高灵敏度、瞬时响应检测。
本研究利用还原型谷胱甘肽作为还原剂和保护配体,通过“一锅煮”的合成方法制备了具有“聚集诱导”(AIE)特性[17]的强烈荧光金银合金纳米团簇(Au Ag NCs),并基于Cd2+对该团簇的AIE荧光增强效应,实现了对于Cd2+的低成本、无标签光学检测。同时,由于Cd2+与Au Ag NCs表面的羧基极强的亲和力,通过AIE可瞬间实现荧光性质的大幅提升,从而提升其对Cd2+检测的灵敏度(检测限10 nmol·L-1)、响应速度(<1 min)及选择性。
1 实验部分
1.1 试剂与仪器
氯金酸、硝酸银、还原型谷胱甘肽、硝酸镉、硝酸铬、硝酸锰、硝酸钴、硝酸镍、硫酸铜、硝酸锌、硝酸钡、硝酸铅、硝酸铝、硝酸镁、硝酸铁、醋酸汞、氢氧化钠,国药集团试剂;超纯水。
紫外-可见分光光度计,UV1800型,日本岛津公司;荧光光谱仪,FL8500型,珀金埃尔默公司;时间分辨荧光光谱仪,Fluorologo-3型,HORIBA Jobin Yvon公司;透射电镜,JEM 2100型,日本电子公司;X射线光电子能谱仪,Escalab 250XI型,Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 荧光Au Ag NCs的合成
将0.45 m L的氯金酸(HAuCl4,20 mmol·L-1)、0.05 m L的硝酸银(Ag NO3,20 mmol·L-1)和0.75 m L的谷胱甘肽溶液(GSH,20 mmol·L-1)与3.75 m L超纯水在室温下混合,形成GSHAu(I)/Ag(I)配合物。然后将该配合物溶液慢速搅拌(600 r·min-1),并加热至85℃。搅拌2 h即可形成具有AIE特征的荧光Au Ag NCs。将合成的Au Ag NCS用脱盐柱PD-10提纯后待用。
1.2.2 荧光Au Ag NCs对Cd2+的检测选择性
合成的金银合金团簇用脱盐柱PD-10提纯后溶于水中(1 m L,100μmol·L-1),加入Na OH调节p H值为11,然后在其中分别加入20μL 100 μmol·L-1金属离子(Cr2+、Mn2+、Co2+、Ni2+、Cu2+、Zn2+、Ba2+、Pb2+、Cd2+、Al3+、Mg2+、Fe3+、Hg2+)。将溶液充分混合,用荧光光谱仪记录相应的荧光光谱。
1.2.3 荧光Au Ag NCs对Cd2+的检测灵敏度
利用NaOH将金银合金团簇溶液的p H值调节为11。取1 m L稀释后的Au Ag NCs(10μmol·L-1,p H=11)与100μL一系列不同浓度Cd2+离子标准溶液混合。充分混合1 min后,在激发为370 nm的条件下测定溶液的荧光强度。
2 结果与讨论
2.1 Au Ag NCs的表征
Au Ag NCs的紫外-可见吸收和发光光谱见图1。如图1所示,合成的Au Ag NCs溶液颜色为黄色(插图①),其紫外-可见吸收光谱显示其在~370 nm处出现明显的吸收肩峰(曲线a)。该数据表明成功合成了金属纳米团簇,并排除了其为大尺寸的具有表面等离子共振效应(SPR,吸收峰峰值520 nm)的金银纳米颗粒的可能。透射电镜(TEM)的结果显示合成的Au Ag NCs尺寸小于2 nm(图2)。此外,Au Ag NCs具有强烈的荧光特性,如图1所示,在365 nm紫外光照射下,Au Ag NCs溶液呈现强烈的橙色发光(插图②),荧光发射峰为610 nm(曲线c),激发峰为370 nm(曲线b),与吸收峰相吻合,表明合成的Au Ag NCs具有较大的斯托克斯位移(>200 nm)。同时,通过分析橙色荧光Au Ag NCs的荧光发光寿命,如图3所示,合成的Au Ag NCs的荧光平均寿命达到微秒级(~1.60μs)。尤其是通过荧光衰减响应分析证实了该团簇荧光的三重态发射,寿命分别为1.53μs(~41.6%),1.62μs(~58.3%)和10.49μs(<0.1%)。这些结果证实了Au Ag NCs的荧光是由团簇表面的GSH-Au(I)/Ag(I)配合物的聚集诱导引起的,荧光发射归因于GSH配体S原子到Au原子(配体-金属电荷转移(LMCT)或配体-金属-金属电荷转移(LMMCT))的电荷转移以及随后的辐射弛豫[18]。

图1 AuAg NCs的紫外-可见吸收和发光光谱Fig.1 UV-Vis absorption and luminescence spectra of Au Ag NCs

图2 AuAg NCs的TEM照片Fig.2 TEM image of Au Ag NCs

图3 AuAg NCs的发光衰减曲线和对应的三指数拟合曲线Fig.3 Luminescence decay profile and corresponding tri-exponential fit of the Au Ag NCs
为进一步证明这一结论,利用X射线光电子能谱(XPS)检测了Au 4f在Au Ag NCs中的氧化态,见图4。如图4所示,Au Ag NCs的Au 4f光谱在以84.1 e V为中心的Au 4f7/2和87.8 e V为中心的Au 4f5/2的束缚能几乎相同。它们的Au 4f7/2XPS光谱被反卷成Au(I)和Au(0)组分,其结合能分别为84.3和83.7 e V。在上述XPS分析的基础上,Au Ag NCs中占主导地位的为Au(I)(≈62.5%)。这些团簇的发光寿命和氧化态的结果为AIE特征的Au Ag NCs的成功合成提供了支持证据。
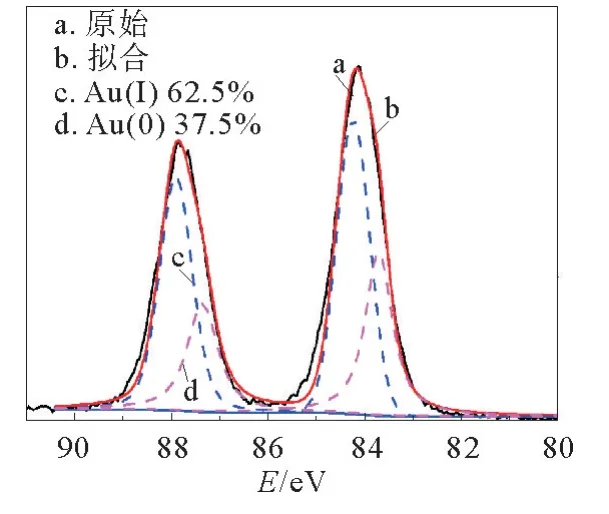
图4 AuAg NCs中Au 4f的XPS谱,与Au(I)和Au(0)峰反卷积Fig.4 XPS spectrum of the Au 4f of the Au Ag NCs deconvoluted with Au(I)and Au(0)peaks
2.2 Au Ag NCs选择性检测Cd2+
考察了合成的Au Ag NCs样品对不同的金属离子(Cr2+、Mn2+、Co2+、Ni2+、Cu2+、Zn2+、Ba2+、Pb2+、Al3+、Mg2+、Fe3+、Hg2+和Cd2+)的选择性,见图5。从图5可以看出,Cd2+对Au Ag NCs的荧光增强作用十分显著,荧光强度增强了近3.5倍多。当离子浓度降到1μmol·L-1时,只有Cd2+使团簇产生强烈的荧光增强作用,虽然Zn2+有微弱的增强作用,但是与Cd2+相比,可以忽略。以上表明Au Ag NCs对Cd2+的荧光增强现象具有选择性和特异性,Au Ag NCs纳米团簇荧光探针对Cd2+可以进行选择性检测。

图5 AuAg NCs对不同金属离子的选择性Fig.5 Selectivity of Au Ag NCs at p H=11 toward different metal ions
2.3 Au Ag NCs对Cd2+检测的工作曲线和检测限

图6 在不同的Cd2+离子浓度下的AuAg团簇(10μmol·L-1)的发射光谱(λex=370 nm)Fig.6 Photoemission spectra(λex=370 nm)of Au Ag NCs(10μmol·L-1)in the presence of different Cd2+ion concentrations
在不同的Cd2+离子浓度下的Au Ag团簇(10 μmol·L-1)的发射光谱(λex=370 nm)见图6。从图6可以看出,在一定范围内,随着Cd2+离子浓度的增大,纳米团簇的荧光强度(发射波长为610 nm)随之增强。在较低的浓度区间内,Au Ag NCs的荧光增强情况与金属离子的浓度呈线性关系,当Cd2+浓度在0~80 nmol·L-1范围内时,其线性回归方程为y=0.287+0.004 2x(R2=0.998),检测限(LOD)为10 nmol·L-1(图7)。根据美国环境保护局的数据,LOD低于饮用水中镉的最大污染物水平(45 nmol·L-1)。如此高的灵敏度使利用Au Ag NCs鉴别Cd2+存在潜在的实际应用[19]。

图7 AuAg NCs相对发光(I/I0)与Cd2+离子浓度的关系Fig.7 Relative luminescence(I/I0)of Au Ag NCs as a function of Cd2+ion concentration
2.4 机理探讨
以前的报道中,Cd2+在不同p H值下可以以不同的方式与GSH配位[20],Cd2+与羧基、半胱氨酸残基与甘氨酸残基之间的肽键、谷胱甘肽的氨基基团有较强的结合,并使团簇产生了聚集,从而聚集诱导发光。为了清楚验证NCs的这种聚集,采集了未加入Cd2+的团簇相应的TEM图像,见图8。高p H下的NCs均表现出较好的分散性,虽有部分聚集但是尺寸较小,最大为50~60 nm(如图8(a)),而加入Cd2+后,团簇明显聚集,存在较大颗粒,尺寸最大为300 nm左右(如图8(b))。因此,上述不同的荧光增强可能主要与p H调节引起配体壳层-GSH的结构变化以及随后与Cd2+结合有关。因为团簇表面配体有大量的羧基和氨基(GSH配体有两个羧基,一个氨基),在高p H值下,一价羧基去质子化,Cd2+与一价羧酸阴离子之间高亲和力的静电和配位相互作用[21],形成了相互间或内交联,如图9所示。除了中和配合物上的负电荷外,还使Au(I)-GSH配合物更紧密,并促进了亲水性键和致密团聚体的形成。团簇聚集后,会限制羧基配体的振动转动和增加自旋轨道耦合效应,最终导致团簇在电子态的跃迁过程中发生系间穿越的效率大大增加,从而导致更强的荧光发射。

图8 在pH=11时,未添加Cd2+和添加Cd2+的TEM照片Fig.8 TEM images of the Au Ag NCs at p H=11 with and without Cd2+

图9 Cd2+诱导AuAg NCs聚集荧光增强示意图Fig.9 Schematic illustration of Au Ag NCs aggregation luminescence enhancement induced by Cd2+
3 结 论
设计了一种简单、低成本、无标签的基于具有强烈荧光性质的Au Ag NCs的光学传感器,利用Cd2+对该团簇的聚集诱导荧光增强效应,实现对Cd2+的选择性检测。本研究中,Cd2+与Au Ag NCs表面的羧基(谷胱甘肽分子含有两个羧基)具有强的亲和力,能诱导Au Ag NCs聚集实现荧光增强,致使该光学传感器对Cd2+具有良好的选择性。另外,由于Au Ag NCs具有强烈的荧光性质及AIE特性,该传感器对Cd2+检测也表现出优异的灵敏度(检测限低至10 nmol·L-1)和快速的时间响应性(<1 min)。
