柯氏无梗囊霉双重培养体系的构建1)
2022-04-27董芮豪姚莉梅向润江龙
董芮豪 姚莉梅 向润 江龙
(贵州大学,贵阳,550025)
丛枝菌根(AM)真菌是一种内生菌根真菌,可与地球上80%以上的陆生维管植物互利共生[1-2]。丛枝菌根真菌孢子萌发的菌丝侵入植物根部,在土壤中形成高度分枝的结构和密集的菌丝网络结构[3],从而增加养分吸收面积,为植物提供大量营养元素促进植物生长[4-5];宿主植物也为丛枝菌根真菌提供生长和发育的必要碳源[6]。已有研究表明,丛枝菌根真菌可作为天然菌肥和生防制剂[7],具有促进植物对土壤矿质养分的吸收[8]、增强植物抗逆性和抗病性[9-10]、改善土壤结构[11-12]、修复土壤中的重金属污染[13-14]等功能;在林业生产中,特别对培育菌根化苗木,有广泛的应用前景。因此,开展丛枝菌根真菌的生物学研究,实现丛枝菌根真菌规模化生产纯净菌剂,是丛枝菌根真菌的重要研究方向[15]。
由于丛枝菌根真菌专性共生的特点,必须依靠寄主植物完成生命周期,这极大地限制了丛枝菌根真菌接种剂的规模化生产[16-17]。为了建立一个以丛枝菌根真菌为基础的可持续产业,生产大量、纯净的无污染孢子,已经开发了许多技术研究丛枝菌根真菌的培养,传统方法包括盆栽法、雾化法、水培法、玻璃珠分室法、丛枝菌根真菌无宿主培养法[18-22];但是,这些方法在高质量接种物生产方面有很大局限性。因此,丛枝菌根真菌培养的主流方法,是利用植物Ri T-DNA转化根作为宿主,接种丛枝菌根真菌孢子,在人工培养基上建立丛枝菌根真菌-Ri T-DNA转化根双重培养体系,既能在最短的时间内获得大量、纯净的孢子繁殖体,又能清晰观察到丛枝菌根真菌完整生活周期,是解决丛枝菌根真菌纯培养、菌剂规模化生产最有效的方法[23-24]。目前,双重培养体系已经在马铃薯[25]、胡萝卜[26]、大豆[27-28]、亚麻[29]、紫云英[30]、番茄[31]等植物中成功建立。
丛枝菌根真菌孢子萌发是建立双重培养重要因素之一。在离体条件下,丛枝菌根真菌孢子萌发受多种因素的影响,如消毒处理、培养基成分、激素、pH、温度、孢子密度、孢子自身分泌的抑制物等因素[32]。丛枝菌根真菌表面消毒的传统方法,是结合常用消毒剂(如氯胺(T)、吐温20、硫酸链霉素、硫酸庆大霉素等)对孢子进行消毒[33];而在试验中发现效果并不稳定,这也是丛枝菌根真菌离体双重培养重要的难题之一。有研究表明:水琼脂培养基更有利于丛枝菌根真菌孢子萌发,当培养基pH<5.5或者pH>8.0时孢子萌发率显著下降,而培养基在pH为6.5环境中孢子萌发效果最好[34];通过加入促进孢子萌发的激素独脚金内酯(GR24)、精胺(SPM),能明显促进丛枝菌根真菌孢子的萌发,但是浓度过高或过低都会降低孢子的萌发率[35-36]。因此,筛选出孢子萌发的最适条件,是建立丛枝菌根真菌双重培养的前提。目前,关于柯氏无梗囊霉(Acaulosporakoskei)双重培养的研究较少,为此,本研究利用发根农杆菌(Agrobacteriumrhizogenes)C58C1诱导烟草Va116子叶产生毛状根,与柯氏无梗囊霉成功建立离体双重培养体系,并产生了新生孢子;本研究结果,可为丛枝菌根真菌的生理学、遗传学以及丛枝菌根真菌与植物共生分子机制等方面的研究提供参考,也可为丛枝菌根真菌规模化生产纯净菌剂提供技术支撑。
1 材料与方法
1.1 供试材料
发根农杆菌(Agrobacteriumrhizogenes)菌株为C58C1、烟草品种为Va116,保存于贵州大学生命科学学院植物生理学实验室。丛枝菌根(AM)真菌菌株,从贵州省梵净山自然保护区土壤中分离获得的柯氏无梗囊霉(Acaulosporakoskei)。
抗生素:利福平(Rif)、乙酰丁香酮(AS)、特美汀(Tim)、头孢噻肟(Cef)、氯胺(T)、吐温20、独脚金内酯(GR24)、精胺(SPM)、硫酸庆大霉素、硫酸链霉素,购自北京索莱宝生物公司。
1.2 烟草Va116毛状根诱导
烟草Va116无菌苗的获得:先将烟草Va116种子用体积分数为75%的酒精消毒1 min、质量分数为10%的次氯酸钠消毒15 min,每一步都在无菌水中漂洗3~5次;然后将种子放于Murashige-Skoog(MS)固体培养基上,于25 ℃、14 h/d、光强2 000 lx下培养获得无菌苗。
发根农杆菌侵染液制备:将发根农杆菌C58C1在利福平质量浓度为100 mg/L的抗性YEP(质量浓度为5 g/L的NaCl+质量浓度为10 g/L的蛋白胨粉末+质量浓度为10 g/L的酵母提取物)培养基活化2次后,当菌液在600 nm处的吸光值为0.6~0.8时,3 000 r/min离心10 min,将底部沉淀移入MS液体培养基中,加入乙酰丁香酮,混匀后,制成浓度为100 mmol/L的侵染液。
毛状根的诱导:取烟草Va116无菌苗幼嫩叶片,切成约2 cm×2 cm,每皿10片,每个处理3个重复,于固体MS培养基中预培养3 d,在侵染液中浸泡8~10 min,放入共培养固体培养基(MS+浓度为100 mmol/L的乙酰丁香酮),25 ℃暗培养3 d;接着将叶片转移到抑菌固体培养基(MS+质量浓度为500 mg/L的头孢噻肟+质量浓度为500 mg/L的特美汀),pH为6.0,每5~7d转移1次,记录每次转移的数据,并在20 d后统计数据。待叶片边缘长出毛状根后,距叶片1 cm处,将毛状根切成长度约3 cm的根段,转移到除菌固体培养基(0.5倍MS+质量浓度为500 mg/L的头孢噻肟+质量浓度为500 mg/L的特美汀),pH为6.0,每5~7 d转移1次,直至农杆菌除干净,转入不含任何激素或抗生素的0.5倍MS培养基中进行继代培养。
rolB基因的聚合酶链式反应(PCR)检测:用北京擎科生物科技有限公司提供的试剂盒,提取毛状根总DNA。聚合酶链式反应反应体系(10 μL)——DNA聚合酶(Premix Ex Taq)为5 μL、正反引物各0.5 μL、模板0.5 μL、超纯水3.5 μL。聚合酶链式反应反应条件——95 ℃预变性3 min、95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸50 s,30个循环,72 ℃延伸10 min。
1.3 丛枝菌根真菌孢子萌发条件的优化
丛枝菌根真菌孢子表面消毒:柯氏无梗囊霉孢子采用湿筛倾注-蔗糖离心法,从土壤中分离[37]。消毒液A的配制——质量浓度为20 g/L的氯胺(T),每0.1 L加2滴吐温20,混匀后用0.22 μm孔径滤膜过滤。消毒液B的配制——质量浓度为200 mg/L的硫酸链霉素+质量浓度为100 mg/L的硫酸庆大霉素,-20 ℃储存备用。孢子消毒方法1——在A液中浸泡10 min,无菌水冲洗3~5次后,转入B液中处理10 min;孢子消毒方法2——先在体积分数75%的酒精中浸泡1 min,重复方法1的操作。
不同pH时孢子萌发数量统计方法:将消毒的孢子放在pH为5.5、6.0、6.5、7.0、7.5的水琼脂培养基(琼脂质量浓度为8 g/L),4 ℃低温处理7 d后放入25 ℃恒温培养,每皿放置20个孢子,每个处理3个重复,20 d后统计数据。
不同质量浓度独脚金内酯处理时孢子萌发数量统计方法:配制不同质量浓度(0、150、450、750、1 050 pg/L)独脚金内酯(GR24)的水琼脂培养基(pH=6.0),加入消毒的孢子,4 ℃低温处理7 d后,放入恒温培养箱中25 ℃暗培养,每皿放置20个孢子,每个处理3个重复,20 d后统计数据。
不同质量浓度精胺处理时孢子萌发数量统计方法:配制不同质量浓度(0、40、80、120、160 mg/L)精胺的水琼脂培养基(pH=6.0),加入消毒的孢子,4 ℃低温处理7 d后,放入恒温培养箱中25 ℃暗培养,每皿放置20个孢子,每个处理3个重复,20 d后统计数据。
1.4 柯氏无梗囊霉-烟草Va116毛状根双重培养体系的建立
丛枝菌根真菌接种和培养:将长势好的烟草Va116毛状根分别接入Modified Strullu-Romand(MSR)培养基、0.5倍MS培养基中预培养,孢子消毒后,先接种于水琼脂培养基中萌发,观察并标记孢子萌发的方向,然后将带有孢子的培养基挖出,移入到预培养的毛状根附近,置于恒温培养箱中25 ℃倒置培养。
菌根侵染方法:毛状根的菌根染色,主要参照文献[38]的方法进行染色观察。
1.5 数据处理
毛状根诱导率=(产生毛状根的外植体数量/外植体总数量)×100%;
孢子萌发率=(孢子萌发数/接种孢子总数)×100%;
孢子污染率=(孢子污染数/接种孢子总数)×100%。
2 结果与分析
2.1 烟草Va116毛状根的获得
烟草Va116种子用体积分数为75%的酒精消毒1 min、质量分数为10%的次氯酸钠消毒15 min,获得无菌苗(见图1A);发根农杆菌C58C1菌液在600 nm处的吸光值为0.6~0.8、侵染时间为8~10 min,共培养3 d(见图1B),转入抑菌培养基2次后,叶片边缘出现毛状根(见图1C、D),其毛状根的诱导率为53.33%。毛状根经过3次的除菌培养后,在无任何激素的0.5倍MS培养基上继代培养(见图1E),30 d时毛状根生长迅速可长满整个培养皿(见图1F)。新生毛状根具有大量的白色根毛和众多的分枝,向上或沿培养基生长,无向地性等特征,从形态学角度确定烟草毛状根诱导成功。在分子水平上对烟草Va116毛状根进行聚合酶链式反应检验,由图2可见:毛状根的总DNA中扩增出了预期的rolB基因的特异性条带741 bp,该条带和阳性对照发根农杆菌C58C1扩增出的条带相同,而未转化的则没有扩出。从分子水平上说明,发根农杆菌的T-DNA已经整合到了烟草Va116毛状根基因组中。
2.2 孢子萌发优化培养
2.2.1不同消毒方法对丛枝菌根真菌孢子萌发率和污染率的影响
为获得纯净无污染的孢子建立共生体系,根据孢子萌发率和污染率,比较了2种不同消毒方法的消毒效果(见表1)。由表1可见:方法1,污染率较高,20 d时孢子萌发率为36.67%、污染率为23.33%;方法2,孢子萌发效果好,且污染率低,20 d时孢子萌发率可达48.33%、污染率仅为6.67%;两者之间的差异均达显著水平(P<0.05)。由此可知,方法2的消毒效果较好,添加体积分数75%的酒精可明显降低孢子的污染率,且萌发率比方法1高1.3倍。
2.2.2 不同pH对丛枝菌根真菌孢子萌发的影响
将已消毒的孢子分别接种在pH为5.5、6.0、6.5、7.0、7.5的水琼脂培养基中,孢子在pH为6.0的水琼脂上萌发率最高(为48.34%),显著高于其他pH的培养基(P<0.05)。pH>6.5时会抑制孢子的萌发;pH为7.0、7.5时,孢子萌发率分别为21.67%、18.34%(见表2)。
2.2.3 独脚金内酯对丛枝菌根真菌孢子萌发的影响
为了提高孢子萌发率,通过加入独脚金内酯促进孢子萌发(见表3)。由表3可见:独脚金内酯质量浓度在0~450 pg/L之间,促进了孢子萌发,质量浓度在450 pg/L时萌发率达到最高值(为61.67%),显著高于其他质量浓度(P<0.05);质量浓度大于450 pg/L时,随质量浓度的增加,抑制了孢子的萌发。
2.2.4 精胺对丛枝菌根真菌孢子萌发的影响
由表4可见:不同质量浓度的精胺对孢子萌发有显著影响。精胺质量浓度为40 mg/L时萌发率最高(为58.34%),显著高于其他质量浓度的(P<0.05);随着质量浓度的提高,孢子萌发率不断降低,且低于对照组的萌发率,说明精胺质量浓度>40 mg/L时均对孢子萌发起到抑制作用。
2.3 烟草Va116毛状根与柯氏无梗囊霉双重培养
将萌发的孢子放入MSR培养基中的烟草Va116毛状根附近(见图3A);培养15 d后,孢子的菌丝逐渐伸长,与毛状根接触,形成多级分枝;30 d左右,在毛状根周围形成菌丝网络结构(见图3B),在根的表皮上形成入侵点(见图3C),并且一些分支的菌丝逐渐变得膨大,形成菌丝圈(见图3D);直到45 d时,首次长出新生孢子,新形成的孢子最初呈乳白色,直径为20~40 μm(见图3E~H)。继续观察,孢子逐渐成熟,成熟时孢子的壁也慢慢变厚,直径40~60 μm,此时孢子为棕黑色(见图3I)。
采用台盼蓝染液对侵染的根段进行染色,在显微镜下观察到孢子的菌丝接触根的表皮形成入侵点(见图4A),菌丝从根表皮入侵到皮层内形成大量的根内菌丝(见图4B~E),并且还观察到泡囊结构的形成(见图4F)。由此可见,烟草Va116离体毛状根,能作为宿主为柯氏无梗囊霉孢子提供营养,使其完成整个生命周期。
培养基的成分,对孢子萌发和双重培养的建立有直接影响。将萌发的孢子分别接入0.5倍MS、MSR培养基,发现MSR培养基中孢子10 d就能与毛状根接触,在0.5倍MS培养基中孢子萌发比较慢,导致萌发的菌丝还未接触到毛状根就停止生长。0.5倍MS培养基中,柯氏无梗囊霉不能与烟草Va116毛状根建立双重培养。
3 讨论
本研究利用发根农杆菌C58C1诱导烟草Va116毛状根,建立了稳定的烟草毛状根体系,获得了大量的毛状根,与柯氏无梗囊霉首次建立双重培养体系,并成功产孢。毛状根的诱导,是通过发根农杆菌侵染植物细胞,使其Ri T-DNA整合到植物基因组中;除菌培养,是诱导毛状根最关键的步骤,在除菌过程中需要定期更换培养基,否则,农杆菌复发会使毛状根致死[39]。离体双重培养的前提,是获得大量的毛状根,以毛状根作为宿主,生长状况不良可直接影响丛枝菌根真菌孢子的发育。而发根农杆菌诱导的毛状根,不仅在无激素培养基上迅速生长,而且能保持良好的遗传稳定性,为丛枝菌根真菌的接种和双重培养提供了大量宿主材料[40]。
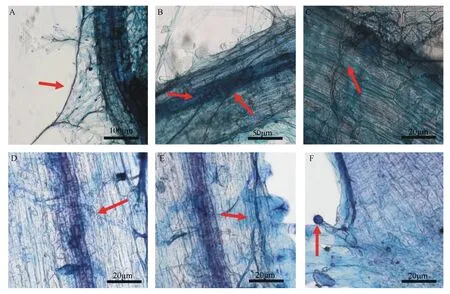
A为台盼蓝染色显示柯氏无梗囊霉孢子菌丝侵入毛状根;B~E为根内菌丝的形成;F为囊泡结构的形成。
孢子消毒,是实现高效体外培养的最关键步骤。孢子消毒的以往研究中,球状巨孢囊霉(Gigasporamargarita)孢子用质量浓度为50 g/L的氯胺(T)+质量浓度为400 mg/L的链霉素+2滴吐温20,进行消毒,孢子萌发率为72%、污染率为10%[33];摩西斗管囊霉(Funneliformismosseae)孢子用质量浓度为20 g/L的氯胺(T)+2滴吐温20、质量浓度为100 mg/L的硫酸庆大霉素+质量浓度为200 mg/L的硫酸链霉素消毒,孢子萌发率为48.88%、污染率为9.98%[26]。因此,本研究在已有研究的基础上对消毒方法做了改进,先用体积分数75%酒精浸泡1 min,再结合常用消毒剂处理孢子,既提高了孢子萌发率,最高可达48.34%,又降低了孢子污染率,仅为6.67%,这为丛枝菌根真菌孢子消毒提供了可行的方法。
在前期的研究中,发现影响双重培养体系的因素很多,如毛状根生长状况、培养基类型、培养基pH、培养温度、外源物质等[41]。Raj et al.[42]利用胡萝卜毛状根与异形根孢囊霉(Rhizophagusirregularis)在MSR培养基中产生了大量孢子;Costa et al.[43]利用胡萝卜毛状根与易误巨孢囊霉(Gigasporadecipiens)、明根孢囊霉(Rhizophagusclarus)进行双重培养,易误巨孢囊霉孢子培养基最适pH为6.5、培养温度为26.5 ℃时,孢子产量最高;而明根孢囊霉培养基最适pH为4.0、培养温度为26.7 ℃时,孢子产量最高。Becard et al.[44]通过在培养基中加入一些外源激素,可促进丛枝菌根真菌孢子萌发。本研究采用的孢子培养基为MSR培养基,pH为6.0,于25 ℃恒温培养,成功建立双重培养体系,产生了新生孢子。经过4个月的培养,孢子菌丝形成多级分支分布于整个生长空间,其中最长的菌丝约为4 048 μm,每条菌丝上都有菌丝圈,并且产生孢子的菌丝都是以主干菌丝分支成二分叉结构,尤其在根段周围菌丝的分支更多;可能是因为毛状根附近更利于孢子和烟草Va116毛状根之间养分的相互运输,促进了菌丝的生长,这与已有研究的结果[31]相似。不同的接种方法,对柯氏无梗囊霉建立共生体系具有很大的影响。将消毒后的柯氏无梗囊霉孢子直接接种于烟草Va116毛状根附近,在观察过程中发现,孢子萌发的菌丝背离毛状根生长,使得菌丝侵染毛状根的时间延长,且大部分菌丝还未接触到毛状根就停止生长,这与已有研究结果[26]相似。但是,将孢子消毒后先放入水琼脂培养基中培养,待孢子萌发后,标记孢子萌发方向,将菌丝生长方向正向接到毛状根附近,提高了菌丝和毛状根的接触率,缩短了孢子菌丝侵入毛状根时间,这与李欣欣等[28]研究结果相似。
综上所述,使用消毒方法2,水琼脂培养基pH为6.0、独脚金内酯质量浓度为450 pg/L、精胺质量浓度为40 mg/L,丛枝菌根真菌孢子萌发率最高。将萌发的孢子放入MSR培养基中与烟草Va116毛状根共培养,首次建立了柯氏无梗囊霉孢子双重培养体系,为丛枝菌根真菌菌剂的生产开辟了一条新的途径,也为进一步研究菌根的生理生化特性提供了可行的试验方法。
