香蕉对低pH和铝毒胁迫的响应
2022-04-27张江周李宝深吴良泉
张江周 李宝深 吴良泉







摘 要:香蕉是世界重要的熱带亚热带水果,在热带经济的发展中占有重要的地位。我国是世界香蕉重要生产国之一,总产量仅次于印度,位居世界第二。低pH和铝毒是香蕉生产中面临的重要限制因子,严重影响香蕉的产量和品质。明确低pH和铝毒胁迫对香蕉生长和养分吸收的影响,为调控酸性土壤提供重要的理论依据。本研究分别在盆栽和水培条件下开展试验,盆栽试验设置pH 3.7和6.5两个梯度,选择‘威廉斯B6’‘巴西’和‘南天黄’3个香蕉品种,对比不同品种香蕉对低pH响应的差异性。试验结果显示,低pH显著抑制香蕉生长和养分吸收。种植在高pH 6.5土壤上的3个香蕉品种的生物量及不同部位(根系、假茎和叶片)养分含量(磷、钾、钙和镁)显著高于种植在低pH 3.7土壤上的香蕉。与高pH相比,生长在pH 3.7的土壤上,生物量平均下降77%,氮、磷、钾、钙、镁等养分吸收量下降73%~604%;而相同pH条件下,不同品种间总体上差异不显著。水培试验设置0、25、50、100 μmol/L四个铝浓度,香蕉根尖苏木精染色结果显示,随着铝浓度的增加,香蕉根尖颜色逐渐加深,出现明显铝毒现象。香蕉地上部生物量和养分含量(氮、磷、钙和镁)随着铝浓度的增加呈下降趋势。100 μmol/L 铝浓度显著降低了香蕉根系的生长速率、地上部生物量、叶缘与叶中心SPAD值及钙和镁的吸收量。本研究表明蕉园土壤低pH和铝毒显著影响了香蕉的生长和养分吸收,不同品种间表现出相同的趋势,研究结果为酸性土壤调控提供重要参考,有助于促进香蕉产业提质增效与绿色发展。
关键词:香蕉;低pH;铝毒;养分吸收中图分类号:S668.1 文献标识码:A
Response of Banana to Low pH and Aluminum Toxicity Stress
ZHANG JiangzhouLI BaoshenWU Liangquan
1. College of Resources and Environment, Fujian Agriculture and Forestry University / International Magnesium Institute, Fuzhou, Fujian 350002, China; 2. College of Resources and Environmental Sciences, China Agricultural University / National Academy of Agriculture Green Development / Key Laboratory of Plant-Soil Interactions, Ministry of Education, Beijing 100193, China; 3. Biotechnology Research Institute, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi 530007, China
Banana ( spp.) is an important fruit in tropical and subtropical regions of the world. It plays a crucial role in the development of tropical economy. China is one of the world’s main banana planting countries, with the second highest total production in the world after India. Low pH and Al toxicity are the main limiting factors in banana production and seriously decrease the banana yield and quality. Therefore, identifying the effects of low pH and Al toxicity stress on banana growth and nutrient uptake can provide theoretical basis for regulating the soil health of acid soils. In this study, pot and hydroponic experiments were conducted. The pot experiments were set under soil pH of 3.7 and 6.5, with the banana varieties of ‘Williams B6’ ( AAA Cavendish cv. Williams B6), ‘Brazil’ ( AAA Cavendish cv. Brazil) and ‘Nantianhuang’ ( AAA Cavendish cv. Nantianhuang), to study the differences in the response of banana varieties to low pH. The results showed that low pH significantly inhibited banana growth and nutrient uptake. The three banana varieties grown at high pH 6.5 soils had significantly higher biomass and nutrient contents (N, P, K, Ca and Mg) of different parts (roots, pseudostems and leaves) than those on low pH 3.7 soils. Compared to high pH soils, bananas grown at pH 3.7 showed an average decrease of 77% in biomass and 73%-604% in nutrient uptake of N, P, K, Ca and Mg, while no significant differences were observed among banana varieties. In the hydroponic experiments, four Al concentrations of 0, 25, 50, 100 μmol/L were applied to explore the response to Al stress. The results of hematoxylin staining of banana root tips showed that the colors of banana root tips gradually deepened with the increase of Al concentrations, and the Al toxicity appeared obviously. The above-ground biomass and nutrient contents (N, P, Ca and Mg) of banana showed a decreasing trend with increasing Al concentrations. Banana grown in Al concentrations of 100 μmol/L showed a significant decrease of root growth rates, shoot biomass, SPAD values of leaf margin and leaf center, and Ca and Mg uptake. This study showed that low soil pH and Al toxicity significantly inhibited the growth and nutrient uptake of banana, with the same trend shown among different varieties. This research provides an important reference for acid soil management in banana orchards, and will contribute to the banana quality, nutrient efficiency and green development of banana industry in China.
banana; low pH; aluminum toxicity; nutrient uptake
10.3969/j.issn.1000-2561.2022.04.015
香蕉是重要的熱带亚热带作物,我国香蕉的总产量位居世界第二,是香蕉重要的生产国。我国香蕉主要种植在海南、广东、广西、云南、福建等区域,这些区域主要以酸性土壤为主,且长期的高温多雨造成土壤中钾、钙、镁等盐基离子大量流失,土壤中交换性阳离子主要以氢离子和铝离子为主。对我国主产区香蕉园土壤调查发现,海南蕉园土壤pH为4.05~6.86,平均值为5.42,pH<5.5的蕉园占48.7%;广西主要蕉园土壤pH在4.43~5.92,平均值为4.88,其中pH<4.5的蕉园占比30%,4.5~5.5的蕉园占比66.7%;对云南河口地区香蕉园调研发现,蕉园土壤pH为4.0~7.7,其中pH<4.5的蕉园占30.2%;福建漳州地区土壤pH变化范围为3.78~6.97,pH<5.5的蕉园占比92.0%。香蕉最适宜生长在弱酸性pH为5.8~6.5的土壤,低pH土壤会显著抑制香蕉的生长。土壤pH的下降会显著提高交换性铝的含量,导致作物出现严重铝毒,抑制作物生长。
低pH和铝毒是酸性土壤主要的障碍因子,这些障碍因子会影响作物的生长和养分吸收。生长在热带地区的番茄,铝毒胁迫会降低番茄生物量、根长和根表面积。在水培条件下,生长在pH为4.0营养液中的番茄幼苗地上部钙的吸收量显著降低。胡椒种植在pH<5.5的土壤上,主蔓由绿色变为黄色,叶片枯萎坏死,根系生长减少,抑制钙和镁的吸收。罗马荨麻在铝胁迫下显著降低其叶片干重,根系钾含量和叶片钾、钙含量。可可在铝胁迫下降低光合速率、气孔导度、叶片蒸腾速率和不同部位氮磷钾钙镁含量。水培条件下,78.5 μmol/L铝胁迫显著降低了香蕉假茎高度、叶面积和生物量,磷、钾、钙和镁的吸收受到抑制[16-17]。该研究品种为Grande Naine(AAA, dessert banana)、Agbagba(AAB, medium false horn plantain)、Obino l’Ewaï(AAB, French plantain)、Igitsiri(AAA-EA, ‘beer variety’)和Kayinja(ABB, ‘cooking variety’),区别于我国香蕉主栽品种威廉斯( AAA Cavendish cv. Williams)和巴西蕉( AAA Cavendish cv. Brazil)。不同的栽培品种对低pH和铝毒胁迫的响应可能不同,如铝敏感型和耐铝型玉米在相同浓度铝胁迫下表现不同。本研究分别在盆栽和营养液培养条件下研究低pH和铝毒对我国主栽香蕉品种(‘威廉斯B6’‘巴西’和‘南天黄’)生长和养分吸收的影响,定量评价酸性土壤主要障碍因子的生物学效应,为香蕉健康栽培和产业绿色发展提供重要的理论依据。
材料与方法
材料
供试香蕉品种为‘威廉斯B6’( AAA Cavendish cv. Williams B6)、‘巴西蕉’( AAA Cavendish cv. Brazil)和‘南天黄’( AAA Cavendish cv. Nantianhuang),香蕉种苗由当地香蕉组培苗公司提供,所有种苗叶片数均为4~5片,株高约10 cm。
方法
1.2.1 低pH对不同品种香蕉生长及养分吸收的影响 (1)试验设计。试验在广西隆安县开展,土壤取自管理模式相同的且相距较近的2个蕉园0~20 cm土壤剖面,其中一个为新开发蕉园,土壤pH较低,为3.7;另一个是连续施用10年有机肥的蕉园,土壤pH为6.5。取回的土壤放置阴凉处自然风干后过2 mm筛备用。
不同品种香蕉分别种植在pH 3.7和6.5土壤上,试验处理编号如下:‘威廉斯B6’(pH 3.7土壤WA,pH 6.5土壤WCK)、‘巴西蕉’(pH 3.7土壤BA,pH 6.5土壤BCK)和‘南天黄’(pH 3.7土壤NA,pH 6.5土壤NCK)。香蕉种植于图1装置内,该装置所盛土壤重量为7.5 kg,每盆种植1株香蕉,每个处理重复4次,共32株香蕉苗。种植时不施用任何肥料,待香蕉缓苗过后,每4~5 d浇一次营养液,每次营养液的用量为500 mL。营养液的组成如下(mmol/L):0.9 Ca(NO)、0.05 CaSO、0.05 CaCl、0.5 KCl、0.25 KSO、0.05 MgCl、0.05 MgSO、0.1 NHCl、0.05 (NH)SO和0.05 NaHPO,微量元素(μmol/L):80 HBO、80 FeEDTA、8 MnCl、0.8 ZnSO、0.8 CuSO和5.6 (NH)MoO。
试验于2015年9月2日开始,2015年12月4日收获,共计93 d。试验期间最高气温为34℃,最低气温为14℃,能满足香蕉对温度条件的需求。
(2)指标测定。香蕉收获时,测定的生长指标包括叶片数、青叶数、株高、假茎粗、叶长、叶宽和叶片SPAD值。株高是指从土壤表面到最上部两片叶片交叉“Y”处之间的距离,假茎粗为离土壤表面5 cm处假茎的直径,采用游标卡尺测定;叶长(,cm)是指叶片基部到叶尖的最长距离,叶宽(,cm)是指叶片最宽处长度,叶长和叶宽采用软尺测定,用于计算香蕉的叶面积。叶片SPAD值采用SPAD-502型叶绿素仪(日本)测定,SPAD值是30个测定值的平均值。香蕉叶面积计算方法参考丰锋等的方法,叶面积LA(cm)=‒59.06 + 0.7727 (×)。
取样时,香蕉分为根系、假茎和叶片3部分。香蕉根系用自来水清洗干净,吸水纸吸干根系表面的水分,分别称量各部分鲜重。称重后将假茎和叶片放置到105℃烘箱杀青30 min,在70℃温度下烘干至恒重;香蕉根系装入自封袋,在‒20℃下冷冻保存。测定时将根系样品缓慢解冻,使用根系扫描仪扫描后采用WinRhizo软件进行分析,获得总根长等根系形态学指标。根系扫描后放入烘箱烘干至恒重。
香蕉根系、假茎和叶片烘干后粉碎,经HSO-H2O消煮后,采用凯氏定氮仪测定氮含量;磷、钾、钙、镁、锌、铁、锰、铜和铝含量用HNO-HO微波消解仪消解后,采用电感耦合等离子体发射光谱仪测定。整个测定过程中,用标准样品进行质量监控。
1.2.2 香蕉对不同铝浓度胁迫的响应 (1)试验设计。试验在中国农业大学资源与环境学院温室中进行。以‘威廉斯B6’香蕉( AAA Cavendish cv. Williams B6)为研究对象,设置0、25、50、100 μmol/L四个铝浓度,铝以AlCl形式供应,每个处理4次重复。选择叶龄相同的香蕉组培苗,放到2.0 L不同铝浓度的营养液中培养,昼夜连续通气,每3 d更换一次营养液。营养液的组成见1.2.1。营养液的pH为4.5,每天用盐酸或氢氧化钠调节培养液pH。温室的培养条件如下:昼夜温度为25℃/18℃,光照强度为230 μmol/(m·s),光照时间为14 h/10 h。整个试验持续60 d,预培养20 d后,开始铝毒处理。
(2)指标测定。香蕉叶片SPAD值测定分为叶缘和中心2个部位,测定方法见1.2.1(2)。
生物量和根系形态测定方法见1.2.1(2)。
根系生长速率测定:在香蕉铝毒处理后0、1、2、4、8、12、24 h测定根系的生长速度,计算得出不同铝浓度胁迫下根系的生长速率。
根尖苏木精染色:根尖苏木精染色参照DELHAIZE等的方法。
香蕉根系、假茎和叶片氮、磷、钾、钙和镁含量测定方法见1.2.1(2)。
数据处理
在分析数据前对所有数据进行正态分布和方差齐性检验,必要时对响应变量进行对数、倒数或平方根转换。试验数据采用SPSS 16.0软件进行统计,单因素方差分析(One-way ANOVA),Duncan’s法检验处理间差异(<0.05)。采用一般线性模型对土壤pH和香蕉品种间的交互作用进行显著性检验。所有图形采用SigmaPlot 12.5软件作图。
结果与分析
低对不同品种香蕉生长及养分吸收的影响
2.1.1 香蕉生长 种植在pH为3.7土壤上的‘南天黄’株高显著低于‘威廉斯B6’和‘巴西蕉’,后二者株高差异不显著。‘威廉斯B6’下部叶片SPAD值显著高于‘巴西蕉’,但与‘南天黄’差异不显著。南天黄香蕉含水量显著高于‘威廉斯B6’,与‘巴西蕉’差异不显著。不同品种间香蕉青叶数、假茎粗、叶面积、上部叶片SPAD值、
生物量和根冠比差异不显著(表1)。
种植在pH为6.5土壤上的香蕉,‘南天黄’上部叶片SPAD值显著高于‘巴西蕉’,而与‘威廉斯B6’差异不显著。巴西蕉根冠比显著低于‘威廉斯B6’和‘南天黄’,而‘威廉斯B6’和‘南天黄’差异不显著。不同品种间香蕉青叶数、株高、假茎粗、叶面积、下部叶片SPAD值、生物量和含水量差异不显著(表1)。
香蕉品种及其与土壤pH的交互作用对生长指标(除株高)无显著影响。
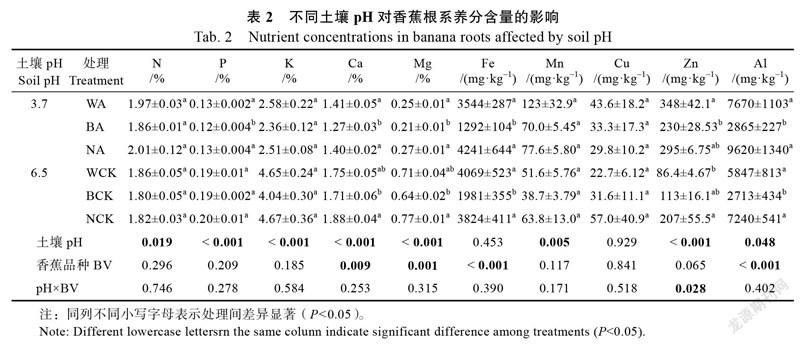
2.1.2 香蕉根系、假茎和叶片养分含量 生长在pH为3.7土壤上,‘威廉斯B6’和‘南天黄’根系磷、钙、镁、铁和铝含量显著高于‘巴西蕉’,而‘威廉斯B6’和‘南天黄’差异不显著。不同品种香蕉根系氮、钾、锰和铜含量差异不显著。生长在pH为6.5土壤上,‘南天黄’根系钙和镁含量显著高于‘巴西蕉’,而与‘威廉斯B6’差异不显著。‘巴西蕉’根系铁和铝含量显著低于‘威廉斯B6’和‘南天黄’,而‘威廉斯B6’和‘南天黄’差异不显著。土壤pH显著影响了根系氮、磷、鉀、钙、镁、锰、锌和铝含量,香蕉品种显著影响了根系钙、镁、铁和铝含量,土壤pH和香蕉品种交互作用显著影响了根系锌含量,而对其他养分含量无显著性影响(表2)。
香蕉种植在pH为3.7土壤上,‘威廉斯B6’和‘南天黄’假茎氮含量显著高于‘巴西蕉’,而‘威廉斯B6’和‘南天黄’差异不显著。‘南天黄’假茎铜和锌含量显著高于‘威廉斯B6’和‘巴西蕉’,而二者间无显著性差异。不同品种假茎磷、钾、钙、镁、铁、锰和铝含量差异不显著。香蕉种植在pH为6.5土壤上,‘巴西蕉’假茎氮和铜含量显著低于‘威廉斯B6’和‘南天黄’,而‘威廉斯B6’和‘巴西蕉’无显著差异,假茎钙含量与氮、铜含量的变化趋势相反。不同品种假茎磷、钾、镁、锰、锌和铝含量差异不显著。土壤pH显著影响假茎氮、磷、钾、钙、镁、锰和锌含量,香蕉品种显著影响了假茎氮、铁和铜含量,而对其他养分含量无显著影响,土壤pH和香蕉品种交互作用显著影响了假茎锌含量(表3)。
在pH为3.7土壤上生长的香蕉,‘南天黄’叶片氮和铜含量显著高于‘威廉斯B6’和‘巴西蕉’,而‘威廉斯B6’和‘巴西蕉’差异不显著。‘巴西蕉’和‘南天黃’叶片磷含量差异不显著,二者显著高于‘威廉斯B6’。‘威廉斯B6’叶片铁和铝含量显著高于‘巴西蕉’,而与‘南天黄’差异不显著。不同香蕉品种叶片钾、钙、镁、锰和锌含量差异不显著。在pH为6.5土壤上生长的香蕉,‘威廉斯B6’叶片镁含量显著高于‘南天黄’,而与巴西蕉无显著差异。巴西蕉叶片铁含量显著低于‘威廉斯B6’和‘南天黄’,后二者差异不显著。‘威廉斯B6’和‘巴西蕉’叶片锰、铝含量差异不显著,二者显著低于‘南天黄’。不同品种香蕉叶片氮、磷、钾、钙、铜和锌含量差异不显著。土壤pH显著影响了叶片磷、钾、钙、镁、铁、锰、铜和铝含量,香蕉品种显著影响了叶片氮、镁、铁、铜和铝含量,土壤pH和香蕉品种交互作用显著影响了叶片镁含量,而对其他养分含量无显著性影响(表4)。
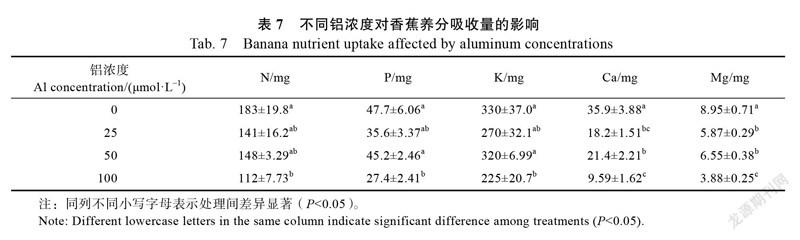
2.1.3 香蕉养分吸收量 种植在pH为3.7土壤上,‘巴西蕉’铁和铝吸收量显著低于‘威廉斯B6’和‘南天黄’,而后两者差异不显著。‘威廉斯B6’锌吸收量显著高于‘巴西蕉’,而与‘南天黄’差异不显著。不同香蕉品种氮、磷、钾、钙、镁、锰和铜吸收量差异不显著。种植在pH为6.5土壤上,‘威廉斯B6’和‘南天黄’铁、铝吸收量显著高于‘巴西蕉’,而前两者差异不显著。不同品种间其他元素吸收量差异不显著。土壤pH显著影响了香蕉氮、磷、钾、钙、镁、铁、锰和铝吸收量。香蕉品种显著影响了铁和铝吸收量,而对其他养分吸收量的影响差异不显著。土壤pH和香蕉品种交互作用对养分吸收量无显著影响(表5)。
香蕉对不同铝浓度的响应
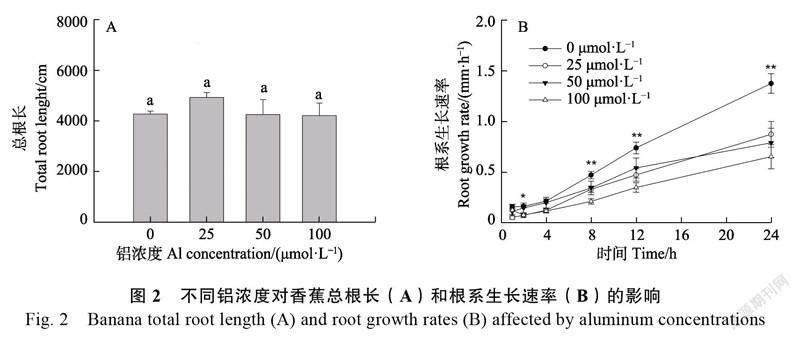
2.2.1 香蕉根系生长 不同铝浓度胁迫对香蕉总根长和根系生长速率的影响见图2。与对照(0 μmol/L Al)相比,添加不同浓度铝未显著影响
根系总长度(图2A),但显著降低了根系的生长速率(图2B)。在铝胁迫8 h后,香蕉根系生长速率显著低于对照。香蕉根尖苏木精染色结果显示,随着铝浓度的增加,香蕉根尖颜色逐渐加深(图3B)。
2.2.2 香蕉生物量 地上部生物量随铝浓度的增加呈下降趋势。在100 μmol/L Al,地上部生物量显著低于对照和50 μmol/L Al处理。不同铝浓度处理地下部生物量差异不显著(图4A和图4B)。与其他处理相比,100 μmol/L Al显著降低叶缘SPAD值,其他处理间差异不显著;对照叶中心SPAD值显著高于100 μmol/L Al胁迫下SPAD值,而与25、50 μmol/L Al胁迫下叶中心SPAD值差异不显著。
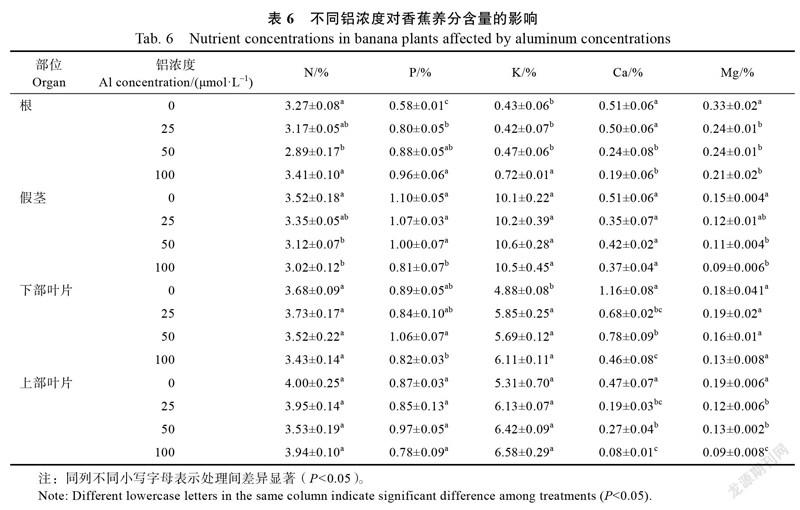
2.2.3 香蕉养分含量和养分吸收量 铝胁迫显著影响了香蕉养分含量和吸收量。与对照相比,铝浓度增加显著增加了根系磷和钾的含量,降低了钙和镁的含量。在50、100 μmol/L Al胁迫下,假茎氮、磷(除50 μmol/L Al)和镁的含量显著低于对照,而假茎钾含量差异不显著。对照下部叶片钙含量和上部叶片钙、镁含量显著高于铝胁迫处理,而下部叶片氮、镁含量及上部叶片氮、磷和钾含量差异不显著(表6)。100 μmol/L Al胁迫显著降低养分吸收量,在25、50 μmol/L Al胁迫下养分吸收量差异不
显著,但镁吸收量显著低于对照(表7)。
讨论
酸性土壤低pH和铝毒会显著抑制香蕉生长。在pH 3.7条件下,土壤速效钾和交换性钙含量处于较低的水平,这是因为在pH<5的酸性条件下,土壤中铝主要以Al形式存在,铝离子取代了黏土矿物上钾、钙离子等阳离子,降低了钾、钙等阳离子的有效性。因此,低pH抑制了香蕉对养分的吸收,降低了香蕉不同部位养分含量和总吸收量,从而影响了香蕉的生长。生长在pH 3.7土壤上的香蕉含水量显著低于生长在pH 6.5土壤上的香蕉,水分胁迫是低pH和铝毒最先表现出来的症状,是由多种原因造成的,需要进一步探究。低pH对香蕉叶面积、不同部位镁含量降低或提高的相对比例较大,这些指标可能被用于评价不同品种的耐酸性,但还需在大田条件下进行深入研究。种植在相同土壤条件下的不同香蕉品种表现趋势类似,说明试验中选用的威廉斯B6、巴西蕉和南天黄香蕉可能是低pH敏感型品种。本试验条件下不能为区分低pH敏感型或耐低pH型品种提供足够的数据支撑,需要选择更多的香蕉品种在大田开展相关研究。
根系生长是评价铝胁迫常见的指标,已经在小麦等作物的研究上得到广泛地应用。香蕉在铝胁迫下显著降低了根系的生长速率。这是因为铝对根系生长的影响主要位于根冠,根尖是最先受到影响的部位。铝会干扰根尖分生组织的细胞分裂,通过与果胶的交联作用增加细胞壁的刚性,同时也会影响DNA的复制。采用苏木精染色法同样证明,随着铝浓度的增加,香蕉根尖染色后颜色逐渐加深。苏木精染料能与细胞中铝形成复合物,反映出根系对铝的耐受性。铝胁迫也会降低香蕉对氮、磷、钾、钙和镁营养元素的吸收,与在柑橘、玉米等作物上的研究结果一致。铝还可以与根系的磷形成一种难溶物质,影响磷的运输,从而导致植物磷的含量下降。铝还可以强烈竞争质外体上多价阳离子结合位点,降低根皮层细胞质外体多价阳离子(Mg、Ca、Zn等)负载量,抑制对阳离子的吸收;同时铝还可以阻塞钙离子通道,降低钙离子的吸收量,通过封闭转运蛋白上镁离子的结合位点而抑制镁离子的吸收。叶片钙和镁的临界值分别为0.45%和0.2%,铝胁迫处理上部叶片钙和镁的含量在临界值以下。而镁是叶绿素的中心原子,叶片镁含量的下降导致叶绿素含量降低,光合作用受到抑制。本研究也证实了铝胁迫条件下显著降低了叶片SPAD值。光合作用受到抑制会影响光合产物的合成,从而影响香蕉植株的生长,与前人在香蕉上研究结果类似。本研究侧重于铝胁迫对香蕉生长和养分吸收的影响,其中的生理和分子机制有待进一步研究。
结论
低pH(3.7)显著抑制了香蕉的生长和养分吸收,‘威廉斯B6’‘巴西蕉’和‘南天黄’3个主栽香蕉品种表现出相同的趋势。在铝胁迫下,香蕉地上部生物量和养分含量(氮、磷、钙和镁)随着铝浓度的增加呈下降趋势。香蕉根尖苏木精染色结果显示,随着铝浓度的增加,香蕉根尖颜色逐渐加深,出现明显铝毒现象。100 μmol/L Al显著降低了香蕉根系的生长速率、地上部生物量、叶缘与叶中心SPAD值及钙和镁的吸收。综上,低pH和铝毒显著抑制了香蕉生长和养分吸收,培育健康土壤对促进香蕉生长和提升香蕉产量、品质意义重大。
参考文献
- ROBINSON J C, GALÁN SAÚCO V. Bananas and plantains (2 edition). In: Crop Production Science in Horticulture, 19 UK: CABI Publishing, 2010.
- DE WAARD P W F, SUTTON C D. Toxicity of aluminium to black pepper ( L.) in Sarawak[J]. Nature, 1960, 188: 1129-1130.
- ZU C, LI Z, YANG J, YU H, SUN Y, TANG H, YOST R, WU H. Acid soil is associated with reduced yield, root growth and nutrient uptake in black pepper ( L.) [J]. The Journal of Agricultural Science, 2014, 5: 466-473.
- DOGAN I, OZYIGIT I I, DEMIR G. Influence of aluminum on mineral nutrient uptake and accumulation in L[J]. Journal of Plant Nutrition, 2014, 37(3): 469-481.
- RUFYIKIRI G, DECLERCK S, DUFEY J E, DELVAUX, B Arbuscular mycorrhizal fungi might alleviate aluminium toxicity in banana plants[J]. New Phytologist, 2000, 148(2): 343-352.
- RUFYIKIRI G, DUFEY J E, NOOTENS D, DELVAUX B. Effect of aluminium on bananas (spp.) cultivated in acid solutions. II. Water and nutrient uptake[J]. Fruits, 2001, 56(1): 5-16.
- DELHAIZE E, CRAIG S, BEATON C D, BENNET R J, JAGADISH V C, RANDALL P J. Aluminum tolerance in wheat ( L.) I. uptake and distribution of aluminum in root apices[J]. Physiology, 1993, 103(3): 685-693.
- SOMERS D J, GUSTAFSON J P. The expression of aluminum stress induced polypeptides in a population segregation for aluminum tolerance in wheat ( L.)[J]. Genome, 1995, 38(6): 1213-1220
- ZHANG H, JIANG Z, QIN R, ZHANG H, ZOU J, JIANG W, LIU D. Accumulation and cellular toxicity of aluminum in seedling of [J]. 2014, 14(1): 264.
- EEKHOUT T, LARSEN P, DE VEYLDER L. Modification of DNA checkpoints to confer aluminum tolerance[J]. in , 2017, 22(2): 102-105.
- GUO P, QI Y P, CAI Y T, YANG T Y, YANG L T, HUANG Z R, CHEN L S. Aluminum effects on photosynthesis, reactive oxygen species and methylglyoxal detoxification in two species differing in aluminum tolerance[J]. Tree Physiology, 2018, 38(10): 1548-1565.
- RUFYIKIRI G, NOOTENS D, DUFEY J E, DELVAUX B. Effect of aluminium on bananas (spp.) cultivated in acid solutions: I. Plant growth and chemical composition[J]. Fruits, 2000, 56(6): 367-379.
