利用PLDMV/Twin-Strep侵染性克隆纯化HC-Pro病毒蛋白
2022-04-27杨秀坤沈文涛庹德财王赫言普黎小瑛朱国鹏周鹏
杨秀坤 沈文涛 庹德财 王赫 言普 黎小瑛 朱国鹏 周鹏

摘 要:番木瓜畸形花葉病毒(Papaya leaf distortion mosaic virus, PLDMV)是一种新的潜在威胁番木瓜种植业的病毒,其辅助成分蛋白酶(helper component- proteinase, HC-Pro)是PLDMV编码参与病毒复制、运动、寄主植物症状表现的多功能蛋白,因此纯化获得具有功能活性的HC-Pro蛋白,研究其多功能性具有重要意义。本研究利用In-Fusion拼接策略和E.coliCell-Free快速构建植物病毒侵染性克隆法,一步快速地将28个氨基酸组成的蛋白标签Twin-Strep插入到PLDMV HC-Pro氨基端,成功获得了基于农杆菌的携带Twin-Strep标签的PLDMV侵染性克隆pPLDMV-Strep。通过农杆菌渗透注射接种番木瓜植株,从感染PLDMV-Strep的番木瓜叶片总蛋白中,利用Twin-Strep蛋白标签亲和层析分离纯化获得PLDMV HC-Pro蛋白,并通过LC/ESI-MS/MS(liquid chromatography electrospray ionization tandem mass spectrometric)对其进行蛋白N端和C端序列测序,证明了纯化获得完整的PLDMV HC-Pro蛋白。研究结果为后续解析PLDMV HC-Pro在病毒侵染过程中的功能及与寄主蛋白相互作用奠定了基础。
关键词:番木瓜畸形花叶病毒;HC-Pro;马铃薯Y病毒;蛋白纯化中图分类号:S436.67 文献标识码:A
Purification of the Potyviral Helper Component-proteinase Using Agroinfection-compatible Twin-Strep-tagged Infectious cDNA Clone of Papaya Leaf Distortion Virus
YANG Xiukun SHEN Wentao TUO Decai WANG He YAN Pu LI Xiaoying ZHU Guopeng ZHOU Peng
1. College of Horticulture, Hainan University / Key Laboratory of Quality Control of Tropical Horticultural Crops of Hainan Province, Haikou, Hainan 570228, China; 2. Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Science, Haikou, Hainan 571101, China
Abstract: Papaya leaf distortion mosaic virus (PLDMV, genus Potyvirus) is an emerging threat to papaya production. The helper component proteinase (HC-Pro) encoded by potyvirus is a multifunctional protein involved in different steps of the viral cycle including aphid-vector transmission, virus replication and movement, cleavage of the polyprotein and suppression of RNA silencing. To enable the study of HC-Pro functions, high quantities of protein are required. Here we describe the construction of a PLDMV infectious clone that produces HC-Pro protein with a Twin-Strep-tag fused at the N-terminus, and the development of an efficient method to purify large amounts of PLDMV HC-Pro protein for the virus-infected papaya plants. To construct an agroinfection-compatible Twin-Strep-tagged PLDMV infectious cDNA clone designated pPLDMV-Strep, the previously constructed pPLDMV-WT plasmid that contained the full-length cDNA of the wild-type PLDMV genome was used as the template to amplify two DNA fragments containing all PLDMV viral sequences, the backbone of binary vector pGreenII-35S and Twin-Strep-tag by PCR with specific two primer pairs. Then, both PCR amplified fragments were assembled to produce the pPLDMV-Strep vector using one-step In-Fusion Cloning. Based on theEscherichia coliCell-Free method, the pPLDMV-Strep were directly transformed intoAgrobacterium tumefaciensto prevent potential problems such as plasmid instability during propagation inE. coli. Sequencing of the PCR products fromA.tumefaciens transformants confirmed that the full-length viral sequences in pPLDMV-Strep was identical to that of the wild-type PLDMV isolate and the Twin-Strep-tag was introduced correctly into N-terminus of the PLDMV HC-Pro. The agroinoculated papaya seedlings withA. tumefaciens transformant harboring the plasmid pPLDMV-Strep developed systemic mosaic symptoms on leaves at 20 days post inoculation (dpi) which were similar to those caused by wild-type PLDMV. The results suggested that the PLDMV-Strep was infectious and insertion of Twin-Strep-tag into PLDMV genome did not affect the viral infectivity. Furthermore, a protocol for purifying rapidly the PLDMV HC-Pro from PLDMV-Strep-infected papaya leaves based on the Strep-tag-Tactin@XT affinity chromatography was developed. the N- and C-terminal peptides from the purified Twin-Strep-tagged HC-Pro were identified by liquid chromatography electrospray ionization tandem mass spectrometric (LC/ESI-MS/MS) analysis. Compared to previous several potyviral HC-Pro heterologous expression systems in baculovirus, yeast orE. coli,a major advantage of the expression system based on the agroinfection-compatible strep-tagged infectious cDNA clone was capable of producing more authentic HC-Pro proteins because purified PLDMV HC-Pro was from the virus-infected host plants. The results would provide a rapid and low-cost alternative method to obtain biologically active PLDMV HC-Pro protein and will facilitate to further study the structure and multifunction of PLDMV HC-Pro.
Keywords: Papaya leaf distortion mosaic virus; HC-Pro;Potyvirus; protein purification
DOI: 10.3969/j.issn.1000-2561.2022.04.004
马铃薯Y病毒属(Potyvirus)是目前最大的植物RNA病毒属,寄主范围十分广泛,是世界范围内危害多种粮食作物、经济作物和果树最严重的病毒属之一。辅助成分蛋白酶(HC-Pro)是Potyvirus病毒编码一个重要多功能病毒蛋白,在病毒的侵染循环过程中,通过与多种寄主蛋白互作发挥重要功能[1-2],主要包括:协助病毒蛋白前体的加工,调控转录后基因沉默,参与病毒的长距离移动,辅助蚜传,调控症状的形成,参与病毒的复制等[2-4]。HC-Pro的三级结构可以明显的分为3部分:羧基末端(C-terminal, C端)部分、中间区域、氨基末端(N-terminal, N端)部分,C端和N端有大约100个氨基酸,中央区有250个氨基酸左右,每个区域都存在不同功能的氨基酸保守基序[2]。N端区域含有丰富的半胱氨酸,该区域包括1个类似锌指结构的金属结合基序,其中的KITC保守结构域是蚜虫传播必需区域[5],N端区域主要参与病毒基因组的扩增、病毒的蚜传以及症状的形成等过程。中间区域可以参与病毒基因组的复制和长距离移动,同时还可以调控RNA沉默抑制活性以及与其他病毒的协生过程[6]。纯化获得具有功能活性的HC-Pro蛋白,研究其多功能性具有重要意义。目前表达HC-Pro的系统主要包括:大肠杆菌原核表达体系、酵母表达体系、重组杆状病毒和植物病毒表达体系、转基因植物表达体系和携带蛋白标签的HC-Pro病毒侵染性克隆系统。这些表达系统已被应用于西葫芦黄花叶病毒(Zucchini yellow mosaic virus, ZYMV)、烟草蚀刻花叶病毒(Tobacco etch virus, TEV)、烟草脉斑病毒(Tobacco vein mottling virus, TVMV)、李痘病毒(Plum pox virus, PPV)、菜豆普通花叶病毒(Bean common mosaic virus, BCMV)等马铃薯Y病毒属病毒的HC-Pro功能研究[7-11]。
番木瓜畸形花叶病毒(Papaya leaf distortion mosaic virus, PLDMV, genus Potyvirus)于1954年在日本琉球群岛的冲蝇首次被发现[12]。在我国,一直以来番木瓜环斑病毒(Papaya ringspot virus, PRSV, genusPotyvirus)是威胁我国番木瓜种植业最为严重的病毒病害。2012年8月,本研究组在海南种植的‘华农1号转基因抗PRSV番木瓜果园检测到PLDMV[13-14],病株表现出PRSV类似病症(叶片褪绿,黄化,嵌纹,皱缩和畸形;叶柄及嫩茎上会产生水浸状斑;果实上产生水渍状斑点,造成果实甜度,口感和风味下降,严重时可致果实畸形),极易被误认为感染PRSV,但2种病毒之间并无血清学关系[12]。HC-Pro蛋白对于解析PLDMV的致病机理以及病情防控策略研究至关重要。目前还没有纯化PLDMV HC-Pro的相关研究,因此本研究通过构建HC-Pro N端携带含28个氨基酸Twin-Strep标签的PLDMV全长侵染性克隆pPLDMV-Strep侵染番木瓜植株,利用Twin-Strep蛋白标签亲和层析分离纯化PLDMV HC-Pro蛋白,为后续研究其在病毒的侵染过程中的功能及与寄主蛋白互作机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料与菌株 本研究所采用的植物材料‘蜜红番木瓜幼苗种植于中国热带农业科学院热带生物技术研究所温室;野生型PLDMV侵染性克隆pPLDMV-WT由本研究组构建[15];农杆菌GV3101(pSoup)感受态细胞采購于上海唯地生物技术有限公司。
1.1.2 仪器与试剂 使用TaKaRa公司的Prime?STAR?Max DNA Polymerase进行基因片段扩增;产物回收试剂盒FastPure?Gel DNA Extraction Mini Kit、菌液PCR鉴定Taq酶2×RapidTaqMaster Mix采购自Vazyme公司;天根生化科技(北京)有限公司的RNAprep Pure多糖多酚植物总RNA提取试剂盒说明书进行RNA提取,Thermo Scientific 公司的RevertAid First Strand cDNA Synthesis Kit进行cDNA的合成;In-Fusion连接酶、DL5000 Marker以及DL15000 Marker均采购于TaKaRa公司、德国IBA公司的Strep- Tactin@XT亲和层析柱进行蛋白纯化;SDS-PAGE凝胶制备试剂盒、彩色预染分子蛋白质分子量标准等均购置武汉博士德生物工程有限公司。
1.2 方法
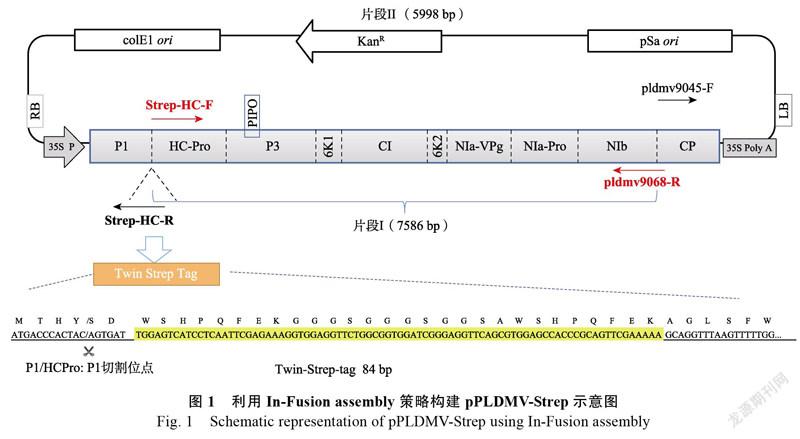
1.2.1 引物设计及基因扩增 为了将Twin-Strep标签(WSHPQFEKGGGSGGGSGGSAWSHPQF EK)插入P1与HC-Pro酶切位点MYHY/SD之后的位置,构建HC-Pro N端携带Twin-Strep标签的PLDMV侵染性克隆载体pPLDMV-Strep,本研究基于PLDMV-WT基因组全长序列(GenBank accession no. JX974555),设计引物对Strep-HC-F / PLDMV9068-R和PLDMV9045-F / Strep-HC-R(表1),其中引物Strep-HC-F/R中均含有Twin- Strep部分编码序列。分别利用这2对引物对,以pPLDMV-WT为模板进行PCR扩增基因片段I和II(图1)。片段I包含7494 nt的PLDMV-WT核苷酸序列(第1575~9068 nt)和Twin-Strep标签N端编码序列(第33~84 nt);片段II包含2659 nt的PLDMV-WT核苷酸序列(第1~1574 nt,9069~10153 nt),Twin-Strep标签C端编码序列序列(1~53 nt)和植物表达载体pGreenII-35S(KX826944)的骨架序列。PCR反应体系为:模板0.5 μL,PrimeSTAR Max Premix(2×)25 μL,正反向引物各0.5 μL,ddH2O 23.5 μL。PCR反应程序如下:98℃预变性1 min;98℃变性10 s,55℃退火10 s,72℃延伸2 min 30 s,循环25次;72℃终延伸5 min。
1.2.2 In-Fusion拼接及农杆菌转化鉴定 按照In-Fusion试剂盒说明书,将上述PCR扩增获得的I和II进行无缝克隆拼接,构建 pPLDMV-Strep载体。反应体系为:5×In-Fusion HD Enzyme Premix 2 μL,I片段4 μL,II片段4 μL。反应条件为:50℃,15 min。进一步利用本研究组建立的E. coliCell-Free one step快速构建植物病毒侵染性克隆法[16],将I和II的拼接产物转化至含pSoup辅助质粒的农杆菌GV3101感受态细胞,并利用引物对pldseq1081-F/pldseq3220-R(表1)进行菌液PCR鉴定。菌液PCR反应体系为:2×RapidTaqMaster Mix酶(Vazyme)10 μL,上下游引物各1 μL,菌液2 μL,ddH2O 7 μL。PCR的反应条件为:95℃预变性3 min;95℃变性15 s,50℃退火15 s,72℃延伸1 min,循环30次;72℃终延伸5 min。将鉴定为阳性的单克隆菌液送生工生物工程(上海)股份有限公司测序验证。
1.2.3 渗透注射接种番木瓜植株 将10 μL含测序正确的pPLDMV-Strep的农杆菌加入到5 mL含卡那霉素(50 μg/mL)与利福平(20 μg/mL)抗性的LB培养液中扩增培养,5000 r/min离心5 min后收集菌体,用农杆菌接种缓冲液[10 mmol/L MgCl2,2.50 mmol/L MES (pH=5.7)和100 μmol/L乙酰丁香酮(AS)]将菌液重悬至OD值为0.6,暗处理3 h以上,使用无针头的注射器对番木瓜叶片进行注射接种。同时以含有野生型番木瓜畸形花叶病毒pPLDMV-WT和pGreenII-35S空载体的农杆菌菌株为对照进行接种。对接种后的番木瓜植株进行定期观察,并记录发病情况。
1.2.4 PLDMV RT-PCR鉴定 取50~100 mg叶片按照天根生化科技(北京)有限公司的RNAprep Pure多糖多酚植物总RNA提取试剂盒说明书进行RNA提取。提取RNA后采用Thermo Scientific 公司的RevertAid First Strand cDNA Synthesis Kit进行cDNA的合成。以cDNA为模板,利用引物对pldseq1081-F/pldseq3220-R进行PLDMV RT-PCR鉴定。PCR扩增反应体系为:cDNA 2 μL,2?PrimeSTAR?Max DNA Polymerase 10 μL,正反向引物各0.5 μL,ddH2O,7 μL。PCR反應程序如下:98℃预变性1 min;98℃变性10 s,55℃退火15 s,72℃延伸30 s,循环25次;72℃终延伸2 min。
1.2.5 番木瓜总蛋白粗提取及Strep-Tactin@XT 亲和层析 取10 g病叶经液氮充分研磨后加入30 mL蛋白提取缓冲液[100 mmol/L Tris-HCl(pH=8.0),150 mmol/L KCl,10 mmol/L MgCl,10 mmol/L DTT,0.5 mmol/L EDTA,1% P40,1% Protein inhibitor]。将研磨过后的样品与蛋白提取缓冲液充分混匀后置于冰上冷却30 min,将冷却后的混合液以5000 r/min转速离心30 min后,分别用0.45 μm和0.22 μm针头过滤器将上清液过滤后得到粗提总蛋白液。最后参考德国IBA公司的Strep-Tactin@XT层析柱说明书的方法和步骤对粗提蛋白液进行亲和层析。
1.2.6 SDS-PAGE电泳及蛋白质谱检测 取上述层析产物进行SDS-PAGE凝胶电泳,切下目的蛋白胶条,首先利用50% ACN-50% 50 mmol/L NH4HCO3溶液脱色进行胶粒脱色,分别取浓度为25 ng/μL的Asp和Trypsin两种蛋白酶(用100 mmol/L Tris-HCl(pH 8.0)稀释)对目的蛋白分别进行37℃水浴酶解16 h,酶解后获得的样品通过液质联用LC-ESI-MS/MS分析,得到质谱原始结果经过软件Byonic分析,匹配数据,得到最终蛋白质谱鉴定结果(蛋白质谱鉴定的操作流程由北京百泰派克生物科技有限公司完成)。
2 结果与分析
2.1 构建pPLDMV-Strep所需拼接片段的克隆和In-Fusion拼接
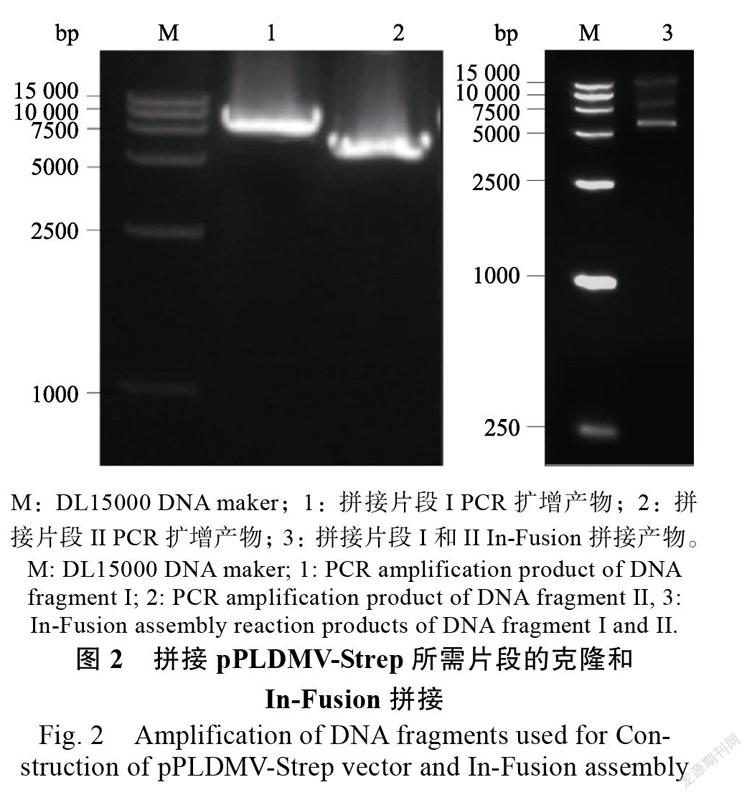
以pPLDMV-WT为模板,分别利用引物对Strep-HC-F/PLDMV9068-R和PLDMV9045-F/ Strep-HC-R经PCR扩增构建pPLDMV-Strep所需拼接片段I(7586 bp)和片段II(5998 bp),琼脂糖凝胶电泳结果显示:在预期大小位置出现了拼接片段I和II的特异条带。利用In-Fusion策略,将这上述2个片段I和II进行拼接后,其产物凝胶电泳结果显示(图2):除了拼接片段I和II外,还出现了一条14 000 bp左右的基因片段与预期13 576 bp结果一致,说明I和II已成功拼接,其产物可进一步进行农杆菌转化。
2.2 基于农杆菌的pPLDMV-Strep侵染性克隆的构建
将上述拼接片段I和II In-Fusion拼接产物进行农杆菌转化。随机挑选6个农杆菌转化子,利用引物pldseq1081-F和pldseq3220-R进行菌液PCR鉴定,结果显示:3~8号菌液均扩增出预期大小的片段(2223 bp)(图3A)。选取3号泳道的菌液送生工生物工程(上海)股份有限公司测序,测序结果显示:Twin-Strep标签序列正确的插入到了P1与HC-Pro酶切位点MYHY/SD后的位置(图3B),阅读框架无误,成功拼接获得了HC-Pro N端携带Twin-Strep标签的PLDMV侵染性克隆载体pPLDMV-Strep。
2.3 pPLDMV-Strep的侵染性分析
利用農杆菌渗透注射技术,分别将含有pGreenII-35S、pPLDMV-WT、pPLDMV-Strep的农杆菌渗透缓冲液注射到4~5叶期的番木瓜叶片。接种20 d后发现:在接种pPLDMV-Strep和pPLDMV的植株上的新叶均出现了典型的PLDMV病症:斑驳的花叶,叶片轻微卷曲,茎杆呈现水渍状的现象,而对照pGreenII-35S侵染的植株则无病症出现(图4A)。进一步对感染了病毒的系统叶片Twin-Strep插入位置进行RT-PCR和测序分析证明(图4B),基于农杆菌的pPLDMV-Strep侵染性克隆成功感染番木瓜植株,且Twin-Strep标签插入未影响其侵染性。
2.4 亲和层析分离PLDMV HC-Pro
通过分别提取感染了PLDMV-Strep和PLDMV-WT的番木瓜叶片总蛋白,经Strep- Tactin?XT High Capacity亲和层析柱纯化获得的层析产物,层析产物的SDS-PAGE分析发现(图5),来自感染了PLDMV-Strep的样品在55~ 72 kDa之间存在1条明显的蛋白条带,与预期大小带Twin-Strep标签的HC-Pro(Strep-HC-Pro)(56.5 kDa)一致,而无Twin-Strep标签PLDMV-WT感染样品对照则无任何条带产生,初步推测来自感染PLDMV-Strep样品层析产物在55~ 72 kDa之间出现的特异蛋白条带为Strep-HC-Pro。
2.5 Strep-HC-Pro N/C端序列分析
进一步利用LC/ESI-MS/MS对感染PLDMV- Strep样品层析产物在55~72 kDa之间出现的特异蛋白条带进行蛋白N/C端测序,二级质谱图结果表明,该条带N端氨基酸序列(WSHPQFEK)与Twin-Strep标签N端氨基酸序列一致(图6A),C端氨基酸序列(DSEMKHYLVG)与PLDMV HC-Pro C端氨基酸序列一致(图6B)。因此可以确定,利用携带Twin-Strep标签PLDMV侵染性克隆pPLDMV-Strep能够成功分离纯化出大小完整的PLDMV HC-Pro。
3 讨论
侵染性克隆是研究病毒的基因功能、侵染机理、病毒-宿主互作最为重要的基础研究工具。PLDMV-WT基因组全长为10 153 nt,对于较大的病毒而言,如果使用传统侵染性全长cDNA克隆构建法,将会扩增得到短的病毒片段,选择合适限制性内切酶,使用连接酶将这些片段逐步组装成质粒载体等繁琐的亚克隆步骤[16-18]。基于限制性内切酶和连接酶的病毒侵染性克隆构建方法耗时费力,连接效率低[19]。In-Fusion克隆技术通过识别目标DNA片段和线性化载体末端的15 bp同源序列将DNA片段和线性化载体高效地融合,该过程不需要使用任何限制性内切酶、连接酶。因此,本研究利用In-Fusion策略,将末端具有15个同源碱基的片段I(含有7586 nt PLDMV)和片段II(含2567 nt PLDMV和pGreenII-35S骨架序列)进行拼接,一步快速获得预期大小的侵染性克隆pPLDMV-Strep。
较大的病毒基因组全长在克隆到大肠杆菌宿主细胞进行侵染性克隆的过程中,经常导致病毒基因组全长在大肠杆菌宿主细胞中出现基因片段缺失、重组、突变等不稳定现象[15, 20-21],致使侵染性克隆构建失败,而产生这种现象被报道与病毒基因组编码的病毒蛋白对大肠杆菌有毒性有关。本研究为了避免PLDMV在大肠杆菌中的不稳定性,利用E. coli Cell-Free one step快速构建植物病毒侵染性克隆法避开大肠杆菌转化过程[15],直接将包含pPLDMV-Strep侵染性克隆的2个片段(I和II)In-Fusion拼接产物转化至农杆菌,成功获得了与野生型PLDMV-WT一样对番木瓜植株具有侵染性的携带Twin-Strep标签PLDMV侵染性克隆pPLDMV-Strep,为利用Twin-Strep蛋白标签亲和层析分离纯化PLDMV HC-Pro蛋白奠定基础。
与已报道的利用大肠杆菌原核表达体系、酵母表达体系、重组杆状病毒、植物病毒表达体系和转基因植物表达体系等表达、分离纯化不同Potyvirus成员HC-Pro相比,本研究采用携带蛋白标签的HC-Pro病毒侵染性克隆系统分离纯化PLDMV HC-Pro优点有:(1)通过病毒感染原宿主分离获得的病毒蛋白能真实地反映出病毒蛋白的结构、功能特点和生物活性;(2)有效避免原核表达体系可能产生的不溶性包涵体和其他异源表达可能产生的错误翻译后加工,从而影响后续功能分析。例如利用重组杆状病毒在昆虫细胞中表达TVMV HC-Pro,获得的HC-Pro虽然具有蛋白酶活性但却失去了蚜虫传播活性[7]。2004年RUIZ-FERRER等[9]利用酵母真核表达系统表达TEV HC-Pro,表达量达到了0.7 mg/L,但蚜虫传播生物活性较低。2011年FUELLGRABE等[10]利用大肠杆菌表达系统表达ZYMV HC-Pro,可能由于蛋白表达量高或是缺乏真核生物中翻译后修饰所需酶类而产生了不溶性包涵体。
HC-Pro是Potyvirus病毒蛋白中功能最多且最复杂的一种,它参与病毒复制、细胞间系统运动、寄主植物症状表现及抑制寄主植物的基因沉默效应等[22-23]。HC-Pro的多功能性预示着它们与寄主植物蛋白因子间的相互作用在病毒致病及植物防御过程中起重要作用,目前已报道与HC-Pro互作的寄主蛋白多达20余种,包括翻译起始因子eIF4E/iso4E、环指蛋白HIP1、叶绿体蛋白质NtMinD、番木瓜钙网蛋白PaCRT、转录因子RAV2等[24-27]。另外,HC-Pro可通过与21 nt和22 nt病毒来源的siRNAs(virus-derived small interfering RNAs)双链分子的竞争性结合,抑制RNA诱导沉默复合体(RNA-induced silencing complex, RISC)形成,是病毒抑制植物基因沉默的一种重要反防御途径[3]。因此,本研究利用携带Twin-Strep标签PLDMV侵染性克隆分离获得的PLDMV HC-Pro将为后续研究其与寄主蛋白和siRNAs相互作用奠定基础。
参考文献
- GARCIA-RUIZ H. Host factors against plant viruses[J]. Molecular Plant Pathology, 2019, 20(11): 1588-1601.
- VALLI A A, GALLO A, RODAMILANS B, LOPEZ-MOYA J J, GARCIA J A. The HCPro from the potyviridae family: an enviable multitasking helper component that every virus would like to have[J]. Molecular Plant Pathology, 2018, 19(3): 744-763.
- DEL TORO F J, DONAIRE L, AGUILAR E, CHUNG B N, TENLLADO F, CANTO T. Potato virus Y HCPro suppression of antiviral silencing in Nicotiana benthamiana plants correlates with its ability to bind in vivo to 21-and 22-nucle?o?tide small RNAs of viral sequence[J]. Journal of Virology, 2017, 91(12): e00367-17.
- IVANOV K I, ESKELIN K, BASIC M, DE S, LOHMUS A, VARJOSALO M, MAKINEN K. Molecular insights into the function of the viral RNA silencing suppressor HCPro[J]. Plant Journal, 2016, 85(1): 30-45.
- ATREYA C D, PIRONE T P. Mutational analysis of the helper component-proteinase gene of a potyvirus: effects of amino acid substitutions, deletions, and gene replacement on virulence and aphid transmissibility[J]. Proceedings of the National Academy of Sciences, 1993, 90(24): 11919-11923.
- REVERS F, GARCIA J A. Molecular biology of potyviruses[J]. Advances in Virus Research, 2015, 92:101-199.
- THORNBURY D W, HEUVEL J F V D, LESNAW J A, PIRONE T P. Expression of potyvirus proteins in insect cells infected with a recombinant baculovirus[J]. Journal of General Virology, 1993, 74(12): 2731-2735.
- GOYTIA E, FERNANDEZ-CALVINO L, MARTINEZ- GARCIA B, LOPEZ-ABELLA D, LOPEZ-MOYA J J. Production of plum pox virus HC-Pro functionally active for aphid transmission in a transient-expression system[J]. Journal of General Virology, 2006, 87(11): 3413-3423.
- RUIZ-FERRER V, GOYTIA E, MARTINEZ-GARCIA B. Expression of functionally active helper component protein of tobacco etch potyvirus in the yeast pichia pastoris[J]. Journal of General Virology, 2004, 85(1): 241-249.
- FUELLGRABE M W, BOONROD K, JAMOUS R, MOSE M, SHIBOLETH Y, KRCZAL G, WASSENEGGER M. Expression, purification and functional characterization of recombinant Zucchini yellow mosaic virus HC-Pro[J]. Protein Expression & Purification, 2011, 75(1): 40-45.
- KUMAR S, KARMAKAR R, GUPTA I, PATEL A K. Interaction of potyvirus helper component-proteinase (HcPro) with RuBisCO and nucleosome in viral infections of plants[J]. Plant Physiol Biochem, 2020, 151: 313-322.
- BAU H J, KUNG Y J, RAJA J A, CHAN S J, CHEN Y K, WU H W, YAH S D. Potential threat of a new pathotype of papaya leaf distortion mosaic virus infecting transgenic papaya resistant to papaya ringspot virus[J]. Phytopathology, 2008, 98(7): 848-856.
- TUO D C, SHEN W T, YAN P, LI X Y, ZHOU P. Complete genome sequence of an isolate of papaya leaf distortion mosaic virus from commercialized PRSV-resistant transgenic papaya in China[J]. Acta Virologica, 2013, 57(4): 452-455.
- YE C M, LI H P. 20 Years of transgenic research in China for resistance to papaya ringspot virus[J]. Transgenic Plant Journal, 2010, 4(1): 58-63.
- TUO D C, FU L L, SHEN W T, YAN P, LI X Y, ZHOU P. Generation of stable infectious clones of plant viruses by using Rhizobium radiobacter for both cloning and inoculation[J]. Virology, 2017, 510: 99-103.
- TUO D C, SHEN W T, YAN P, LI X Y, ZHOU P. Rapid construction of stable infectious full-length cDNA clone of papaya leaf distortion mosaic virus using in-fusion cloning[J]. Viruses, 2015, 7(12): 6241-6250.
- CHIANG C H, YEH S D. Infectivity assays of in vitro and in vivo transcripts of papaya ringspot potyvirus[J]. Botanical Bulletin-Academia Sinica Taipei, 1997, 38(3): 153-163.
- BOYER J C, HAENNI A L. Infectious transcripts and cDNA clones of RNA viruses[J]. Virology, 1994, 198(2): 415-426.
- LI M Z, ELLEDGE S J. Harnessing homologous recombination in vitro to generate recombinant DNA via SLIC[J]. Nature Methods, 2007, 4(3): 251-256.
- 庹德財. 番木瓜畸形花叶病毒检测鉴定及侵染性克隆构建与应用[D]. 海口: 海南大学, 2015.TUO D C. Identification, generation of infection full-length cDNA clones of papaya leaf distortion mosaic virus from Hainan (PLDMV-DF) and its use for GFP expression[D]. Haikou: Hainan University, 2015. (in Chinese)
- JOHANSEN I E. Intron insertion facilitates amplification of cloned virus cDNA in Escherichia coli while biological activity is reestablished after transcription in vivo[J]. Proceedings of the National Academy of Science, 1996, 93(22): 12400-12405.
- PLISSON C, DRUCKER M, BLANC S, GERMAN- RETANA S, THOMAS D, BRON P. Structural characterization of HC-Pro, a plant virus multifunctional protein[J]. Journal of Biological Chemistry, 2003, 278(26): 23753- 23761.
- VARRELMANN M, MAISS E, PILOT R, PALKOVICS L. Use of pentapeptide-insertion scanning mutagenesis for functional mapping of the plum pox virus helper component proteinase suppressor of gene silencing[J]. Journal of General Virology, 2007, 88(3): 1005-1015.
- GUO D, SPETZ C, SAARMA M, VALKONEN J P T. Two potato proteins, including a novel RING finger protein (HIP1), interact with the potyviral multifunctional protein HCpro[J]. Molecular Plant-microbe Interactions, 2003, 16(5): 405-410.
- ALA-POIKELA M, GOYTIA E, HAIKONEN T, RAJAMAKI M L, VALKONEN J P T. Helper component proteinase of the genus potyvirus is an interaction partner of translation initiation factors eIF(iso)4E and eIF4E and contains a 4E binding motif[J]. Journal of Virology, 2011, 85(13): 6784-6794.
- SHEN W T, YAN P, GAO L E, PAN X, WU J Y, ZHOU P. Helper component-proteinase (HC-Pro) protein of papaya ringspot virus interacts with papaya calreticulin[J]. Molecular Plant Pathology, 2010, 11(3): 335-346.
- JIN Y, MA D, DONG J, LI D, JIN J, TAO W. The HC-pro protein of potato virus Y interacts with NtMinD of tobacco[J]. Molecular Plant-microbe Interactions, 2007, 20(12): 1505-1511.
