高中化学解题技巧分析
2022-04-26陈艺君
陈艺君
(江苏省扬州南师大第二附属高级中学 211400)
1 高中化学的常用解题方法
1.1 守恒法
在高中化学学科中经常出现守恒这个词汇,作为化学的核心思想,守恒也是高中学生最主要的解题方法和策略.守恒主要包括原子守恒、质量守恒、电子守恒等.一般情况来说,在化学计算中多用质量守恒,因为化学变化前后具有相同的总质量,所以质量守恒还能够帮助学生验证解题结果是否正确;在复杂的化学方程式计算、连步反应计算以及有机物分子组成计算中多用原子守恒;电子守恒则多用于氧化还原反应中.
1.2 化学方程式法
在分析和计算化学题时,化学方程式可以让复杂的题目简单化,因此高中生必须对化学方程式进行熟练掌握.在化学学科中有很多问题都涉及到化合反应和分解反应,所以高中生可以利用化学方程式掌握其中一种关系,再结合题意设置未知数,利用化学方程式设置方程组,这也是高中化学最常用的解题策略之一.
2 高中化学解题技巧分析
例题1(2020年广东高考化学改编)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30%的H2O2、0.1 mol/L的Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.
①写出本实验H2O2的分解反应化学方程式,并标明电子转移的方向和数目____.
②设计实验方案:在不同H2O2浓度下,测定____.(要求所测得的数据能直接体现反应速率大小).
③参照表1格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据,数据用字母表示).

表1
(2)利用图1和图2中的信息,按图3装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的____(填“深”或“浅”),其原因是____.
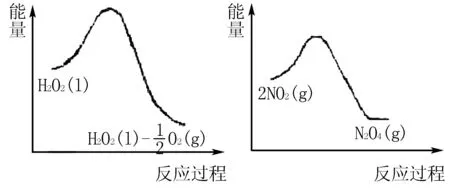
图1 图2
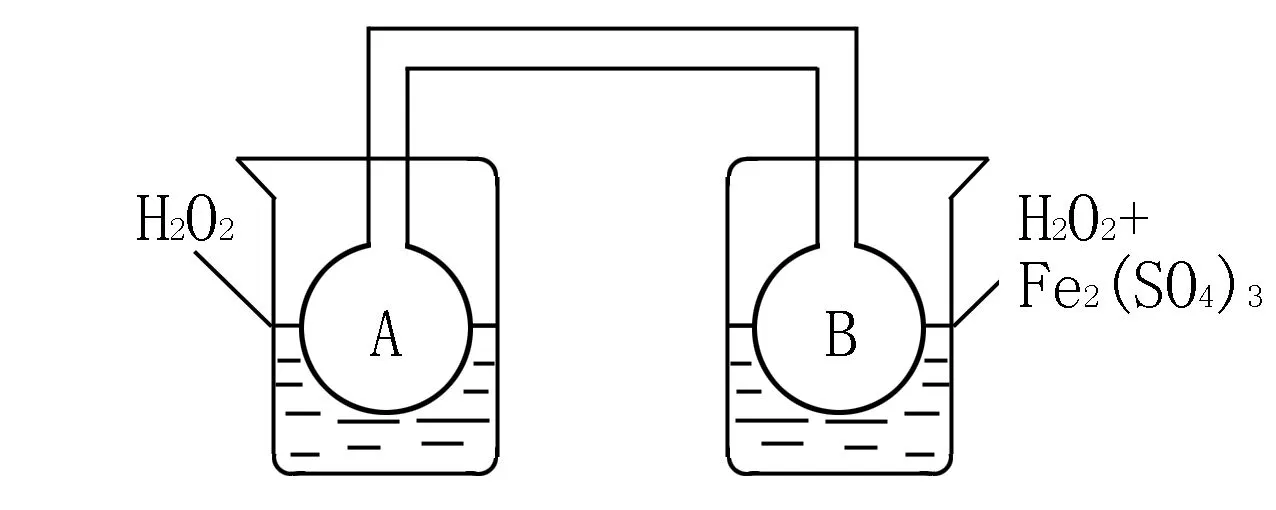
图3
试题解析(1)①先写出H2O2在Fe3+的催化下分解的化学方程式,在根据电子得出情况用双线桥法标出.
②收集相同体积的氧气所需时间或者相同时间所收集氧气的体积.
③解法一:不同浓度的H2O2分解在相同时间内产出的气体体积.
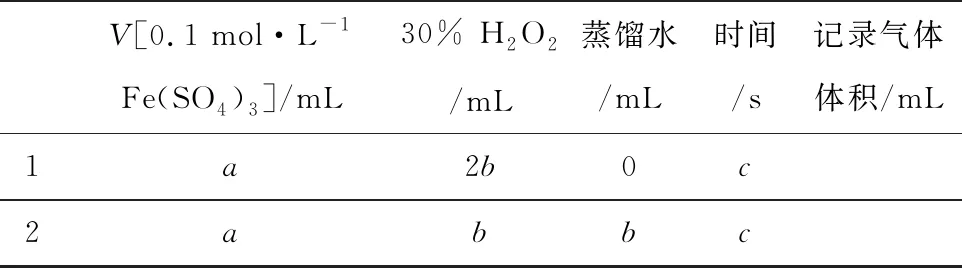
V[0.1 mol·L-1Fe(SO4)3]/mL30% H2O2/mL蒸馏水/mL时间/s记录气体体积/mL1a2b0c2abbc
解法二:不同浓度的H2O2分解产生的相同气体的体积所需要的时间.
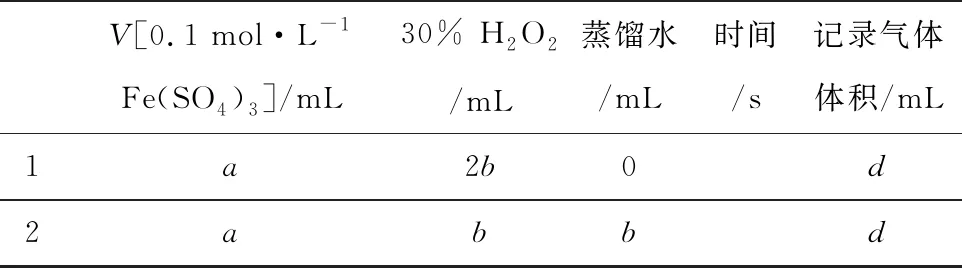
V[0.1 mol·L-1Fe(SO4)3]/mL30% H2O2/mL蒸馏水/mL时间/s记录气体体积/mL1a2b0d2abbd
(2)答案为深.原因是2NO2(红棕色)与N2O4(无色)之间的反应,ΔH<0是放热反应,且双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深.
这道高考题的主要目的是考察学生的主观表达能力和实验设计能力,对学生理论掌握和实验设计能力要求较高.这也说明高中学生在学习化学知识时必须要回归教材,能够对基础知识进行深刻把握并透彻理解,对于教材中所演示的实验也要要求学生进行自主探究,强化他们的实践动手能力和思考能力.
例题2(2019年全国卷第27题节选)环戊二烯可用于制备二茂铁Fe(C5H5)2,后者广泛应用于航天、化工等领域中.二茂铁的电化学制备原理如图4所示,其中电解液为溶解有浪化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂).
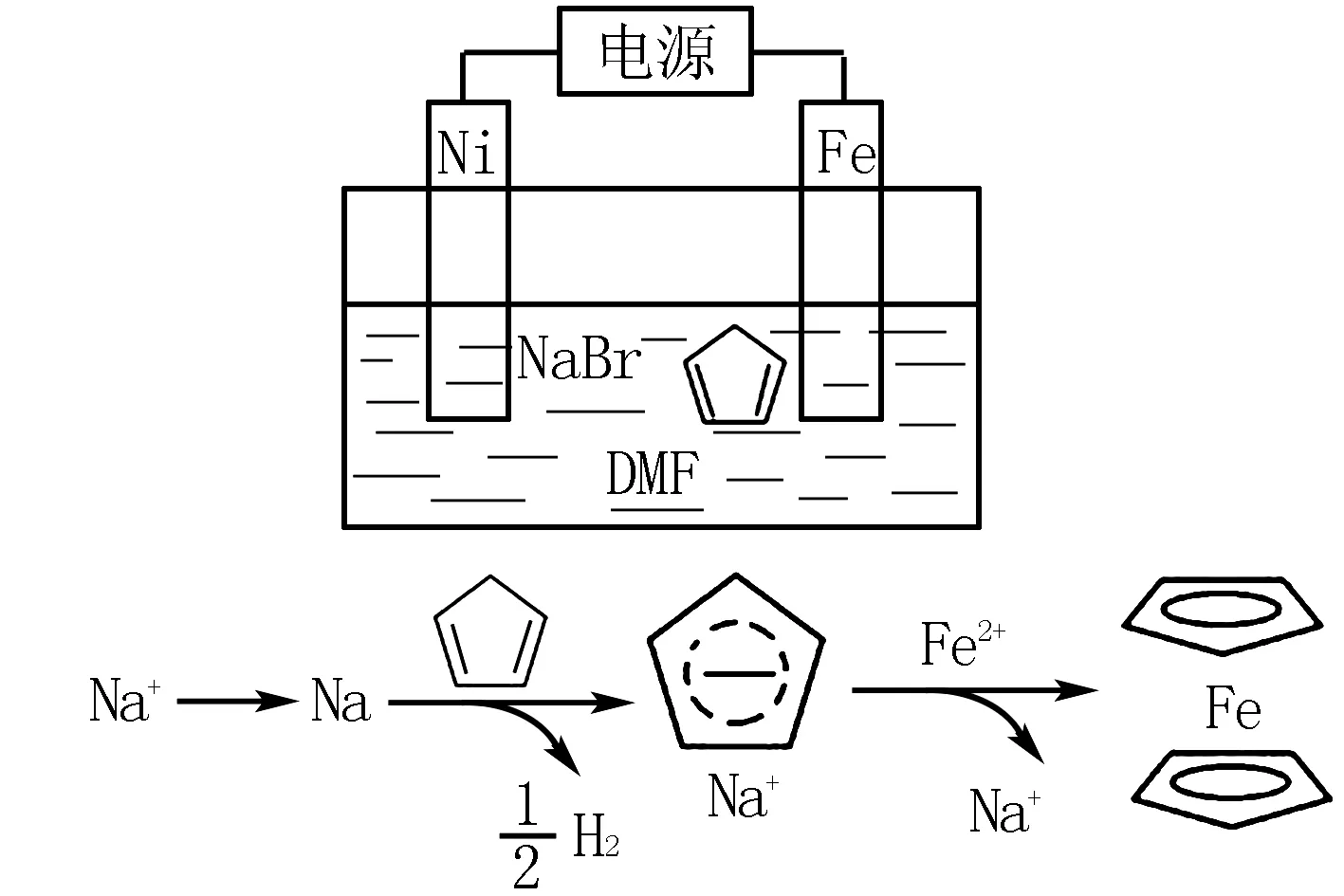
图4
请同学们回答:该电解池的阳极为____,总反应为电解制备需要在无水条件下进行,原因是____.
答案分别为:
Fe电极;因为化学方程式为

水会阻碍中间物Na的生成;水会电解生成OH-进一步与Fe2+反应生成Fe(OH)2.


电解必须在无水条件下进行,因为中间产物Na会与水反应生成NaOH和H2,Fe2+与OH-结合生成Fe(OH)2.此题需要学生根据得失电子判断电解池两极,再根据题中信息找准反应物与产物,最后配平电极反应式.
总结:本题所主要考察的就是电极反应式的书写,学生一定要明确电解池具有阴极和阳极两个电极,阳极在反应过程中失去电子、阴极在反应过程中得到电子,然后需要结合题干信息确定电极反应的反应物和生成物.此时可以用到质量守恒和电荷守恒定律,也就是在电极反应式两端的原子个数和电荷数量必须相等,以此来验证反应式是否正确.
例题3(2019年全国卷第13题)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如图5所示.电池反应为
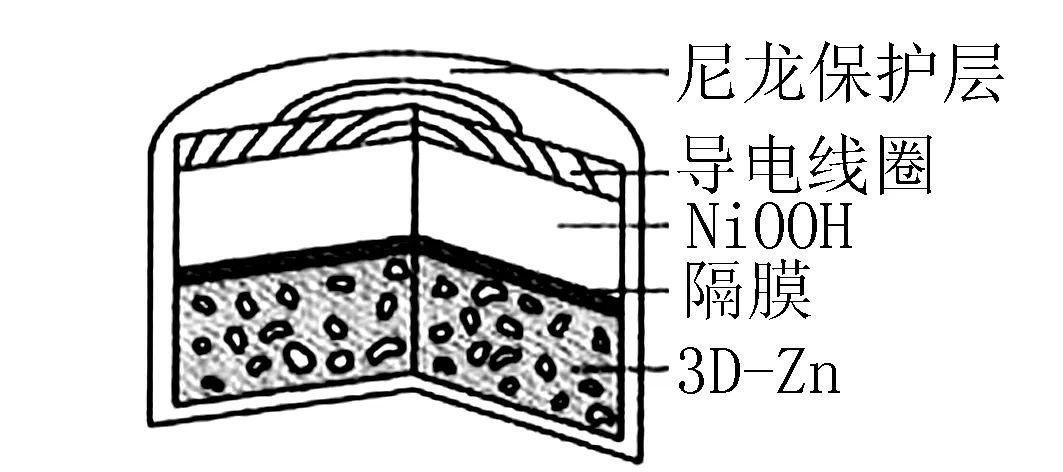
图5

ZnO(s)+2Ni(OH)2(s)
下列说法错误的是( ).
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为

C.放电时负极反应为

D.放电过程中OH-通过隔膜从负极区移向正极区
答案:D.
解析根据题目中提示“利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点”可知,三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高,所以A正确;充电相当于是电解池,阳极发生失去电子的氧化反应,根据总反应式可知阳极是Ni(OH)2失去电子转化为NiOOH,电极反应式为

NiOOH(s)+H2O(l)
B正确;放电时相当于是原电池,负极发生失去电子的氧化反应,Zn作负极反应生成ZnO,根据总反应式可知负极的极反应式为

C正确;放电时,负极上失电子,电子通过导线到达正极,溶液中OH-阴离子通过隔膜从正极区移向负极区,故D错误.
总结:这道高考题主要考察学生对原电池和电解池工作原理的掌握,原电池的负极失电子,电子通过导线到达正极,形成电流.而在电解质溶液中,离子的定向移动形成电流,阳离子向正极移动,阴离子向负极移动;电解池的阳极失电子,电子通过导线到达阴极,形成电流,在电解质溶液中,阳离子向阴极移动,阴离子向阳极移动.
综上所述,在高中化学学科的学习中,有很多高效的学习方法和解题技巧,需要学生在学习过程中进行总结,但是这必须以高中生能够对化学基础知识进行扎实掌握为基础,只有高中学生做到对化学基础知识的深入理解和记忆,才能够在解题过程中做到知识的灵活运用,才能帮助学生拥有更加清晰的解题思路,明确题目的考察意图,最终不断提高解题速度和解题正确率.
