响应面优化超声波提取冬凌草甲素工艺及其抗肿瘤活性研究
2022-04-26王吉鸿陈彦亮王广宇
郭 杰 ,郝 楠,陶 蕾,王吉鸿,陈彦亮,王广宇
(1.兰州职业技术学院生物工程系,甘肃 兰州 730070;2.河南省中药材生产技术推广中心,河南 郑州 450000)
当今,恶性肿瘤因其高死亡率、低治愈率,严重威胁着人类的健康。据世界卫生组织统计,世界范围内仅2020年新出现的恶性肿瘤患者便高达1929万例,其中,我国占23.69%(457万例),位居全球第一,其治疗已成为当今生命科学领域面对的重大难题之一[1−3]。由于现阶段的治疗手段存在损伤正常的机体组织,导致患者出现免疫力降低、肝肾功能受损或骨髓抑制等不良反应[4−6]。所以寻找一种高效、绿色、安全的肿瘤治疗药物已成为国内外学者的研究热点。冬凌草(Rabdosia rubescens)为唇形科香茶菜属碎米桠的干燥地上部分,资源在我国甘肃、陕西、河南等黄河流域均有广泛分布,最早收载于《救荒本草》,现被收载于《中国药典》[7]。中医认为冬凌草味苦、甘,性微寒,具有清热解毒、活血止痛、消炎抑菌和抑制肿瘤等功效,用于治疗咽喉肿痛、扁桃体炎、蛇虫咬伤等病症,并对食管癌、肝癌、肺癌、前列腺癌、膀耽癌等多种癌症疗效显著[8]。现代临床实验证明,冬凌草通过诱导细胞凋亡、调控癌细胞周期、改变生物膜的通透性等方式实现肿瘤抑制的效果[9]。
冬凌草作为中医传统治疗肿瘤的药物,其有效成分的开发利用有望为现有的天然活性抗肿瘤药物研究提供方向,近来年的研究发现,冬凌草中的有效成分——冬凌草甲素,因其具有抗肿瘤、抗菌抗炎、镇痛等药理作用成为当今抗肿瘤药物的研究热点[10]。目前,冬凌草甲素的提取方法主要为索氏提取法、热回流提取法和溶液浸提法等,这些方法存在提取时间长、效率低、能耗大等缺点[11−12]。超声辅助提取法因其具有操作简单、价格低廉且能有效提高提取效率、缩短提取时间、降低能耗等优点,广泛应用于各种生物活性物质的提取纯化[13−14]。近期针对冬凌草甲素的研究集中于冬凌草甲素的药理作用,对其高效提取方法鲜有研究[15−16]。
本研究立足于冬凌草,采用超声波法辅助提取冬凌草甲素,以克服传统浸提法成本高、分离时间长、能耗大等缺点。通过单因素确定工艺参数范围,经响应面法优化提取工艺研究冬凌草甲素高效绿色提取体系,并经过对HepG2细胞存活率和凋亡蛋白Caspase-3和Caspase-9表达的研究,初步研究冬凌草甲素的体外抗肿瘤活性,以期为天然抗癌物质的研发提取提供理论技术支持。
1 材料与方法
1.1 材料与仪器
冬凌草 由三门峡广宇生物制药有限公司提供,由河南农业大学农学院中药材系高致明教授鉴定为正品,自然晾干,干燥密封保存;人肝癌细胞系HepG2 购自中国典型培养物保藏中心(Chian Center for Type Cuture Collection, CCTCC);冬凌草甲素对照品(批号 E1526003,纯度≥98%) 上海阿拉丁生物科技股份有限公司;Cell counting Kit-8 (CCK-8)试剂盒(批号202001003)、总蛋白提取试剂盒(批号201908002)、Caspase-3(批号202005007)和Caspase-9检测试剂盒(批号202002010) 北京索莱宝科技有限公司;多克隆抗体Caspase-3(批号2019012006)、β-actin(批号201806015) 武汉三鹰生物技术有限公司;甲醇 色谱纯,天京永大化学试剂有限公司;其余试剂均为国产分析纯。
KQ-250DE超声波清洗机 昆山超声波仪器有限公司;GL21M离心机 凯达科学仪器有限公司;RE-52AA旋转蒸发器 南北仪器有限公司;TY-100L中药粉碎机 济南天宇专用设备有限公司;Agilent 1290高效液相色谱仪 美国安捷伦公司;X-mark酶标仪 美国BioRad公司;二氧化碳培养箱 美国Shellab公司;HX-ZD-100A振荡仪 华熙昕瑞分析仪器有限公司;DYCZ-24DN电泳仪 北京六一仪器厂。
1.2 实验方法
1.2.1 冬凌草甲素的提取 将冬凌草粉碎,过40目筛,根据冬凌草甲素的性质,依照“相似相容”原理,选择有机溶剂乙醇作为萃取剂,结合以往文献采用95%的乙醇作为冬凌草甲素的萃取剂[17−18]。称取1.0 g冬凌草粉末与95%乙醇混合后在超声作用下提取冬凌草甲素。在一定的超声条件下处理一定的时间,离心,收集上清液,旋转蒸发仪浓缩,挥发多余乙醇,吸取1 mL用甲醇定容至100 mL,用0.22 μm滤膜过滤,高效液相测定峰面积。
1.2.2 单因素实验
1.2.2.1 料液比对冬凌草甲素得率的影响 按1.2.1的实验步骤,设置不同的料液比(1:10、1:15、1:20、1:25、1:30 g/mL)在超声功率为200 W,超声时间1 h条件下萃取冬凌草甲素,每次试验重复3次,取平均值计算冬凌草甲素得率。
1.2.2.2 超声功率对冬凌草甲素得率的影响 按1.2.1的实验步骤,设置不同的超声功率(80、120、160、200、240 W),在料液比为1:20 g/mL,超声时间1 h条件下萃取冬凌草甲素,每次试验重复3次,取平均值计算冬凌草甲素得率。
1.2.2.3 超声时间对冬凌草甲素得率的影响 按1.2.1的实验步骤,设置不同的超声时间(0.5、1.0、1.5、2.0、2.5 h),在料液比为1:20 g/mL,超声功率200 W条件下萃取冬凌草甲素,每次试验重复3次,取平均值计算冬凌草甲素得率。
1.2.3 响应面试验 通过单因素实验确定参数范围,以冬凌草甲素得率为指标,利用Box-Behnken的中心组合试验设计原理进行试验设计,优化料液比、超声功率及超声时间的工艺参数,评价影响冬凌草甲素得率因素的主效应、相互效应及因素的二次效应关系,试验因素与水平设计见表1。
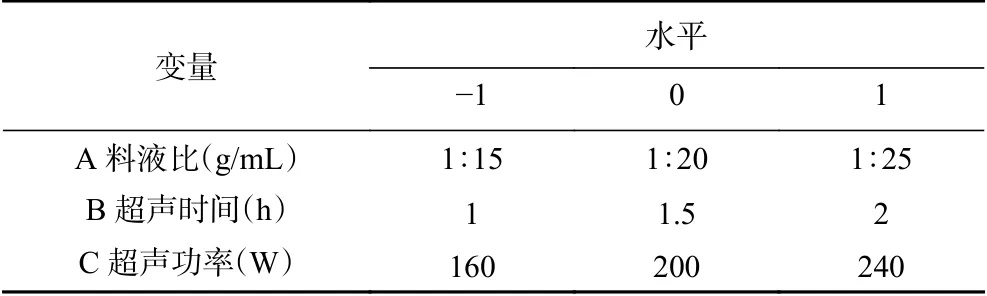
表1 Box-Behnken设计变量水平Table 1 The levels of variables for the construction of Box-Behnken design (BBD)
试验数据利用完全二次多项式方程进行多元线性回归拟合,计算冬凌草甲素得率和各实验因素之间的函数关系。
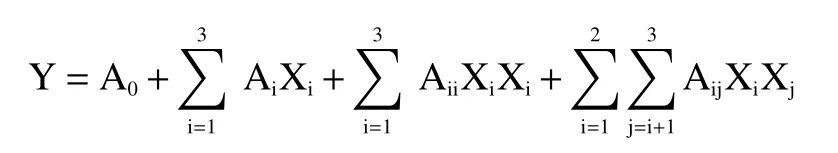
式中,Y为预测的响应值,即冬凌草甲素得率;A0是常数,Ai是线性系数,Aii是二次方系数,Aij是交互作用回归系数;Xi是自变量。
1.2.4 冬凌草甲素含量测定
1.2.4.1 色谱条件 Zorbax SB C18色谱柱(250 mm×4.6 mm, 5 μm),流动相:甲醇-水(50:50),流速:1.0 mL/min,柱温:35 ℃,进样体积:10 μL,检测波长:210 nm,冬凌草甲素保留时间14.76 min。
1.2.4.2 标准曲线绘制 冬凌草甲素标准品,95%乙醇溶解,分别配制0.1、0.2、0.4、0.6、0.8 mg/mL的标准溶液。按1.2.4.1的色谱条件,经高效液相测定冬凌草甲素的色谱峰面积。标准曲线的X轴与Y轴分别为对照品质量浓度及峰面积,得回归式:Y=23.153X−31.569。其中,相关系数R2=0.9996,表明该曲线在0.1~0.8 mg/mL范围内线性关系良好,适用于冬凌草提取液中冬凌草甲素质量浓度的计算。
1.2.4.3 冬凌草甲素得率测定 将1.2.2和1.2.3中制备的冬凌草甲素提取液体,经高效液相测定峰面积,并按如下公式计算冬凌草甲素的得率。

式中,Y表示冬凌草甲素得率(%);C为冬凌草甲素浓度(mg/mL);N为测定时的稀释倍数;V为提取液母液体积(mL);W为冬凌草原料质量(g)。
1.2.5 冬凌草甲素抗肿瘤实验
1.2.5.1 冬凌草甲素对肝癌细胞存活率的影响 将长势良好的人肝癌细胞系HepG2以104个/mL细胞密度接种于96孔板,适应生长12 h后,弃去原培养基,加入无血清培养基0.9 mL,分别加入40、80、120、160、200 μmol/L冬凌草甲素溶液0.1 mL,配成终浓度为4、8、12、16、20 μmol/L冬凌草甲素溶液(冬凌草甲素分子量为364.44,HPLC测定的提取液中冬凌草甲素量0.412 mg/mL,将提取液稀释56.5倍配置20 μmol/L冬凌草甲素母液),作用24 h后,将10 μL CCK-8检测液逐一加入各孔,1 h后酶标仪450 nm波长测其OD值,计算细胞存活率。
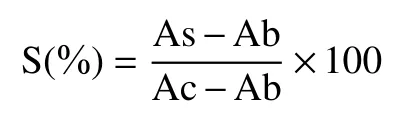
式中,S表示细胞存活率(%);As为试验孔的吸光度(含细胞、培养基、CCK-8和药物溶液);Ac为对照孔的吸光度(含细胞、培养基和CCK-8溶液);Ab为空白孔的吸光度(含培养基和CCK-8溶液)。
1.2.5.2 冬凌草甲素对肝癌细胞胞内凋亡蛋白的影响 5×105/mL HepG2细胞 接种于6孔板,贴壁培养12 h,弃去原培养基,加入无血清培养基2.7 mL,分别加入40、80、120、160、200 μmol/L冬凌草甲素溶液0.3 mL,配成终浓度为4、8、12、16、20 μmol/L冬凌草甲素溶液。37 °C含5% CO2浓度的CO2培养箱中培养24 h后,细胞刮板刮下,离心收集细胞,使用细胞裂解液在冰浴条件振荡裂解,细胞裂解液使用总蛋白提取试剂盒测定蛋白含量,Capase-3和Capase-9活性严格按照Capase-3和Capase-9活性测定试剂盒执行。
Western blotting检测Capase-3凋亡蛋白表达水平,取长势良好的HepG2细胞,D-hank`s清洗后加入细胞裂解液,依总蛋白提取试剂盒操作指导提取总蛋白。蛋白变性后取等量各组总蛋白上样进行SDS-PAGE电泳。待电泳前端溴酚蓝至分离胶下缘时停止电泳,进行1 h转膜。将完成转膜的PVDF膜以含5%脱脂奶粉的TBST溶液室温下封闭2 h。将封闭好的PVDF膜与一抗(Caspase-3,1:1000;βactin,1:1000)于4 ℃孵育过夜。次日取出后用TBST洗膜3次,加入二抗(1:1000)室温下置于摇床平缓晃动,孵育1 h。结束后以TBST洗膜3次后加入显色液覆盖整张膜,进行显色反应。
1.3 数据处理
所有数据均表示为平均值±标准差,运用Origin 9.0绘制实验数据相关图片,采用SPSS 18.0和Design-Expert 8.0数据处理系统进行统计分析。P<0.05或P<0.01表示差异具有统计学意义。
2 结果与分析
2.1 单因素实验结果
2.1.1 料液比对冬凌草甲素得率的影响 如图1所示,在1:10~1:20 g/mL的料液比范围内,冬凌草甲素得率逐渐升高,在料液比为1:20 g/mL时冬凌草甲素得率达到最高,之后得率不再随料液比的增加而增加。此现象可能是由于溶质和萃取剂的接触面积随着液料比的增加而扩大,更有利于冬凌草甲素的萃取[19−20];但料液比超过1:20 g/mL后,溶质已经达到了溶解平衡,所以得率不再增加,考虑到提取成本,液料比选择1:20 g/mL作为冬凌草甲素提取的最佳提取参数。
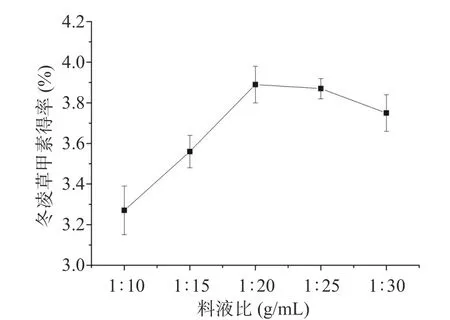
图1 料液比对冬凌草甲素得率的影响Fig.1 Effect of liquid to solid ratio on yield of oridonin
2.1.2 超声功率对冬凌草甲素得率的影响 如图2所示。超声功率在80~200 W范围内,冬凌草甲素得率随超声功率的升高而增加,此后继续增加超声功率,冬凌草甲素得率增高不明显,考虑到提取成本,超声功率为200 W作为冬凌草甲素提取的最佳提取参数。
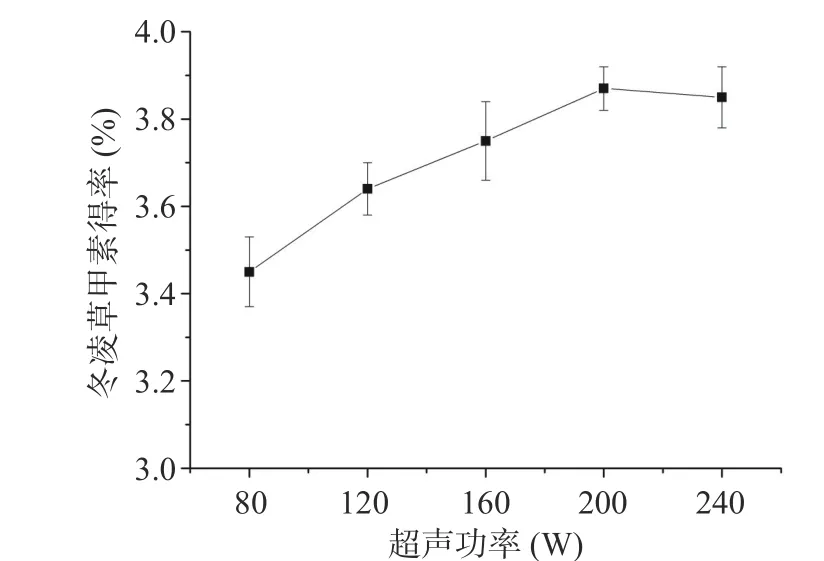
图2 超声功率对冬凌草甲素得率的影响Fig.2 Effect of ultrasonic power on the yield of oridonin
2.1.3 超声时间对冬凌草甲素得率的影响 超声时间对冬凌草甲素得率的影响见图3,提取时间在1.0 h以内,冬凌草甲素得率随提取时间的增长急速增加;在提取时间1.0~1.5 h范围内,冬凌草甲素得率随提取时间的延长缓慢增加;提取时间超过1.5 h以后增加趋势不明显。其原因可能是冬凌草甲素随着提取时间的延长,部分冬凌草甲素氧化分解[21],所以在时间超过1.5 h后冬凌草甲素得率会略有所下降。因此,选择1.5 h为冬凌草甲素最佳的超声时间。
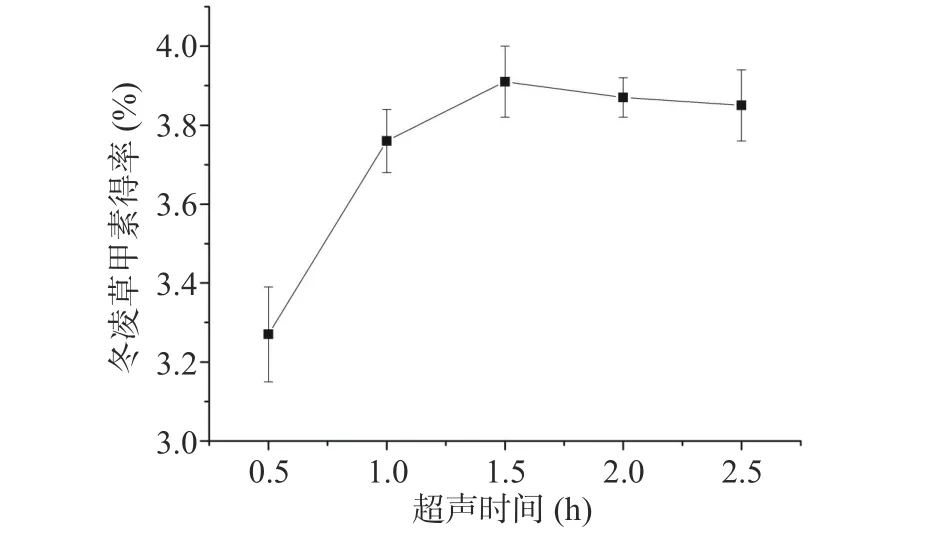
图3 超声时间对冬凌草甲素得率的影响Fig.3 Effect of ultrasonic time on the yield of oridonin
2.2 响应面法试验结果
2.2.1 响应面试验设计与结果分析 表2显示了Box-Behnken试验设计17个3因素和3水平的结果。使用SAS数据分析软件对数据进行分析,冬凌草甲素得率和试验变量采用以下二次多项式方程得出:
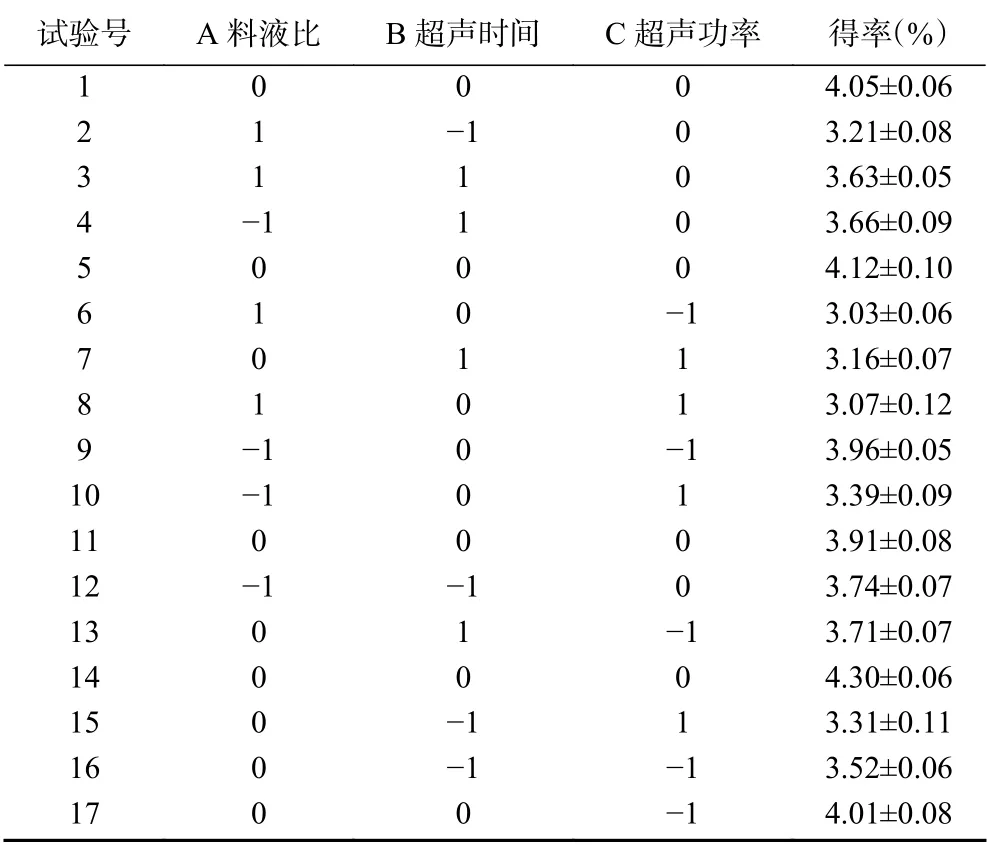
表2 Box-Behnken试验设计及结果Table 2 Box-Behnken design and results

式中,Y为冬凌草甲素得率,A为料液比,B为超声时间,C为超声功率。
经Design-Expert 8.0软件ANOVA法分析响应表面二次多项式模型的显著性。实验方差结果分析如表3所示,回归模型的拟合极显著(P<0.01),实验复相关系数(R2)是0.9329和校正测定系数(R2adj)是0.8467,失拟项不显著(P>0.05),以上结果均表明模型拟合程度高可靠性强,观察值和预测值之间的相关性良好,在实验变量范围内具有很高的显著性,可用该模型来分析和预测冬凌草甲素的提取条件,此外,低变异系数(CV)为4.23%表示模型的精度高。以上结果证实选用试验方法的准确性,可以用此回归方程对试验结果进行分析和预测。表3结果显示,所选各因素水平范围内,一次项A达到极显著水平(P<0.01),C达到了显著水平(P<0.05),表明料液比对冬凌草甲素得率的影响最大,要得到良好的响应值必须严格控制好料液比。各项因素对冬凌草甲素的影响大小顺序是:料液比(A)>超声功率(C)>超声时间(B)。
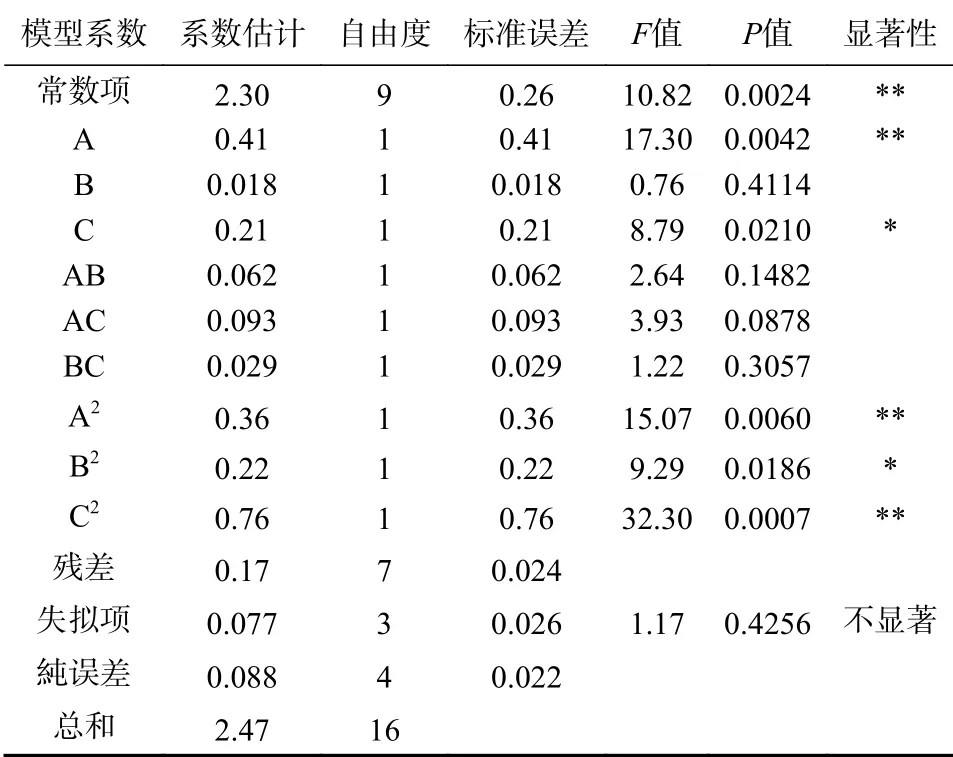
表3 回归模型的方差分析结果Table 3 The results of variance analysis of regression model
根据多元回归方程做出不同处理因素对冬凌草甲素得率影响相应三维响应面和二维等高线如图4所示。三维响应面阐释了当其他因素保持在零水平不变时,因变量之间的关系和两个测试变量之间的相互作用[22−23],二维等值线图的形状反映了变量之间的交互效应,圆图表示试验参数相互作用影响不显著,而椭圆轮廓图表示试验参数相互作用影响显著[24−25]。图4B呈现出料液比和超声功率间显著的交互作用,由此可知,冬凌草甲素得率与料液比、超声功率密切相关;图4C显示,等高线在超声功率轴向分布密集且呈陡然变化趋势,但其在超声时间轴向分布稀疏且变化趋势较为缓和,该结果提示,冬凌草甲素得率受超声功率的影响大于超声时间的影响。以上结果均可支持方差分析结果。
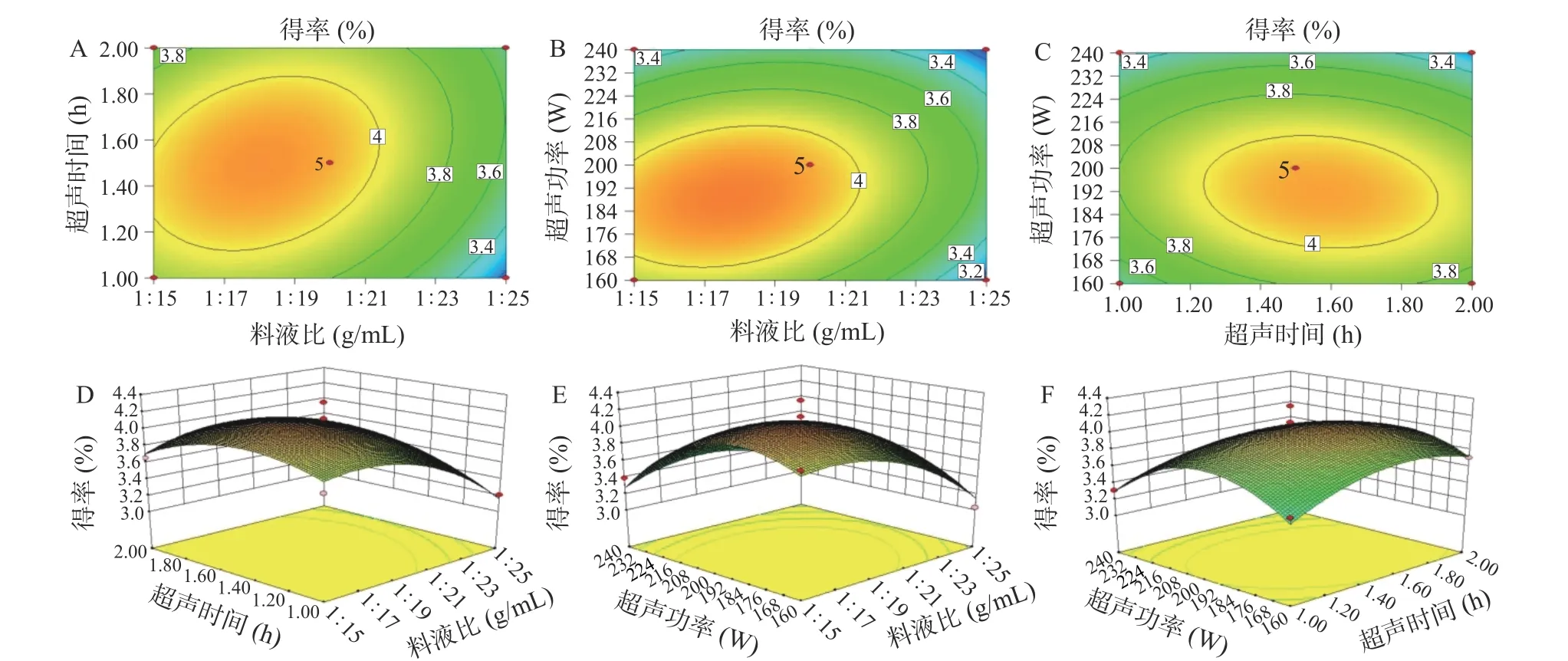
图4 不同处理因素交互作用对冬凌草甲素得率的响应面和等高线图Fig.4 Response surface plots and contour plots of the interactive effects on the yield of oridonin
2.2.2 最优工艺条件及验证实验 利用Design-Expert 8.0软件分析优化冬凌草甲素提取的最佳条件:料液比为1:17.73 g/mL,超声时间为1.51 h,超声功率为189.06 W。最佳条件下,冬凌草甲素预测最高得率为4.154%。为检验预测结果的可靠性,兼顾实际操作的便利性,将上述最佳提取条件修正为,料液比为1:18 g/mL,超声时间为1.5 h,超声功率为190 W进行重复实验。3次平行实验实际测得冬凌草甲素得率为(4.122%±0.102%),证实了预测值和实验值之间的良好相关性,表明该模型适用于冬凌草甲素的提取。
2.3 冬凌草甲素抗肿瘤作用
2.3.1 冬凌草甲素对肝癌细胞存活率的影响 冬凌草甲素对肝癌细胞存活率的影响如图5所示。冬凌草甲素处理组HepG2细胞存活率较空白对照组明显下降,其中,当冬凌草甲素浓度超过8 μmol/L之后,对肝癌细胞的存活率抑制与对照组相比差异显著(P<0.05),在4~20 μmol/L的范围内具有剂量依赖性,当浓度达到20 μmol/L时,HepG2细胞存活率低至60.72%。
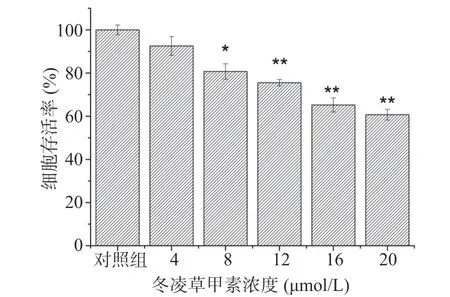
图5 冬凌草甲素对HepG2细胞存活率的影响Fig.5 Effect of oridonin on HepG2 cells viability
2.3.2 凌草甲素对肝癌细胞胞内凋亡蛋白的影响冬凌草甲素对肝癌细胞HepG2 Caspase-3和Caspase-9活性的影响如图6所示。与空白对照组相比,冬凌草甲素组细胞Caspase-3和Caspase-9活性明显上升,说明冬凌草甲素通过激活Caspase-3和Caspase-9蛋白表达,启动细胞凋亡程序。其中,冬凌草甲素浓度达到8 μmol/L以后肝癌细胞HepG2的Caspase-3和Caspase-9活性显著上升(P<0.05),且表现出良好的剂量依赖性。
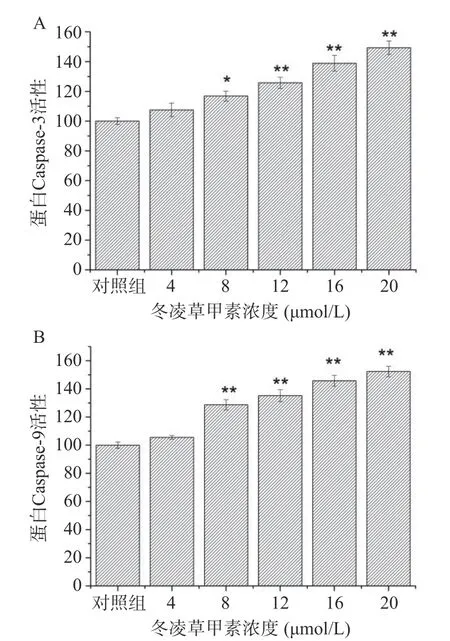
图6 冬凌草甲素对HepG2细胞Caspase-3(A)和Caspase-9(B)活性的影响Fig.6 Effect of oridonin on Caspase-3(A) and Caspase-9(B) activity
应用Western-Blot技术分析检测冬凌草甲素对肝癌细胞HepG2 Caspase-3蛋白表达的影响(如图7)。灰度扫描定量分析结果显示,经不同浓度冬凌草甲素处理后Caspase-3蛋白表达的变化。不同浓度冬凌草甲素处理24 h后,与对照组相比,加入冬凌草甲素处理后,Caspase-3的表达量随冬凌草甲素浓度的增加显著增加,呈现出一定的剂量依赖性;当冬凌草甲素浓度大于8 μmol/L后,Caspase-3的表达较对照组极显著升高(P<0.01),说明冬凌草甲素作用24 h在一定浓度时可以激活Caspase-3的表达。
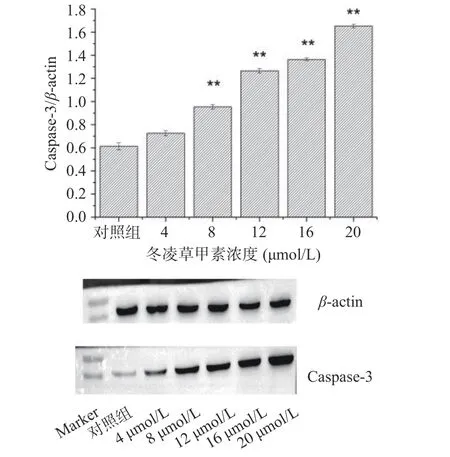
图7 冬凌草甲素对HepG2细胞Caspase-3表达量的影响Fig.7 Effect of oridonin on Caspase-3 expression in HepG2 cells
上述实验结果显示,冬凌草甲素作用于HepG2细胞后,通过增加Caspase-3和Caspase-9蛋白表达,启动细胞凋亡程序,降低细胞存活率,暗示此时HepG2细胞因细胞凋亡程序的启动引起细胞数目的下降,说明冬凌草甲素能通过促进线粒体途径介导的内源性途径促进细胞凋亡,降低细胞存活率,从而达到抑制癌细胞的目的。
3 讨论与结论
冬凌草甲素是中草药植物冬凌草的主要有效成分,现代药理学证实,冬凌草甲素因具有多种生物活性而受到广泛关注。冬凌草甲素常用的提取方法研究集中于热回流提取法、渗漉法、索氏提取法等,由于冬凌草甲素为热敏成分,这些提取方法存在提取时间长、提取效率低,降低生物活性等缺点。所以积极寻找更加适合提取冬凌草甲素的方法,可以更好地促进我国冬凌草植物资源的高值化利用。超声辅助提取法因其具有操作简单、价格低廉并且能有效提高提取效率、缩短提取时间、降低能耗等优点[26],可克服传统浸提法分离时间长、易失活、能耗大等缺点而被广泛应用于生物活性物质的提取。本研究利用响应面法优化提取冬凌草甲素的工艺参数,料液比为1:18 g/mL,超声时间为1.5 h,超声功率为190 W的条件下,冬凌草甲素得率达到4.122%。
冬凌草甲素的抗肿瘤活性是通过诱导癌细胞凋亡、调整细胞周期、改变生物膜的通透性等方面实现的。现已证实天冬氨酸特异性半胱氨酸蛋白水解酶(Caspase)家族在细胞凋亡发生过程中起着十分重要的作用[27]。其中,Capase-3是触发细胞凋亡级联反应的核心蛋白酶,是所有细胞凋亡信号传导的共同通路蛋白,其过量表达就会导致细胞凋亡[28−29]。许多的细胞凋亡通路都是经过线粒体完成的,所以线粒体也称之为“自杀武器储存库”[30−31]。大量文献报道在线粒体凋亡途径中,首先破坏了线粒体的氧化呼吸链,继而引起电子解偶联反应,产生大量的自由基,最终触发ATP损失和细胞色素C释放,最终激活凋亡蛋白Caspase-9介导的细胞凋亡[30,32−34]。体外细胞实验证实,冬凌草甲素可以大幅降低HepG2细胞的存活率,增加Caspase-3和Caspase-9蛋白表达,通过促进线粒体途径介导的内源性途径促进癌细胞凋亡,从而达到抑制癌细胞数目的目的。
